基于NLRP3信号通路探讨活血通脉颗粒对急性心肌梗死大鼠免疫炎症紊乱的干预作用
韩玉泽,田峥,钟雷
基于NLRP3信号通路探讨活血通脉颗粒对急性心肌梗死大鼠免疫炎症紊乱的干预作用
韩玉泽,田峥,钟雷
116001 辽宁,大连市友谊医院心内二科(韩玉泽);116001 辽宁,大连大学附属中山医院心内科(田峥);116001 辽宁,大连医科大学附属第一医院心内科(钟雷)
探讨活血通脉颗粒对急性心肌梗死(AMI)大鼠在免疫炎症紊乱的干预作用。
大鼠 42 只随机选 6 只为空白对照组,其余 36 只大鼠 AMI 造模。建模后存活大鼠 30 只随机分成 5 组,阳性药物对照组,AMI 组,活血通脉颗粒低、中、高剂量组,每组 6 只。空白对照组、AMI 组每天灌胃生理盐水,阳性药物对照组 184 mg/(kg·d) 灌胃辛伐他汀,活血通脉颗粒低、中、高剂量组按生药 2.7、5.4、10.8 g/(kg·d) 灌胃,每日 1 次,连续 28 d。同时建立人 H9C2 心肌细胞缺氧模型,缺氧处理 21 h,加药处理。HE 染色观察心肌组织形态学变化;MTS 检测心肌细胞活力变化;ELISA 检测心肌组织和心肌细胞中 IL-1β、TNF-α 水平;qRT-PCR 检测心肌组织中核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、接头蛋白 ASC(ASC)、半胱氨酸天冬氨酸蛋白水解酶 1(caspase-1)mRNA 水平;蛋白免疫印迹检测心肌组织中NLRP3、ASC、半胱氨酸天冬氨酸蛋白酶酶原(pro-caspase-1)、caspase-1 蛋白水平。
大鼠和人心肌细胞模型中,AMI 组心肌细胞破坏、死亡严重,形态及结构损害严重。随着活血通脉颗粒剂量的增加,心肌细胞坏死现象减弱,逐渐恢复形态。大鼠模型中,与空白对照组相比,AMI 组心肌组织中IL-1β、TNF-α、NLRP3、ASC、caspase-1 mRNA 和蛋白、pro-caspase-1 蛋白表达量升高(< 0.05)。与AMI 组相比,活血通脉颗粒低剂量组心肌组织中ASC、pro-caspase-1、caspase-1 蛋白表达量降低;活血通脉颗粒中、高剂量组心肌组织中IL-1β、NLRP3、ASC、caspase-1 mRNA 和蛋白、pro-caspase-1 蛋白表达量降低,并呈剂量依赖效应(< 0.05)。人心肌细胞中加药 6 h 时 IL-1β、TNF-α 的变化与大鼠模型中类似。
活血通脉颗粒可能通过减弱 NLRP3 信号通路、抑制促炎因子表达,实现对 AMI 大鼠的保护作用。
心肌梗死; 活血通脉颗粒; 免疫炎症; 核苷酸结合寡聚化结构域样受体蛋白 3 信号通路
急性心肌梗死(acute myocardium infarction,AMI)是持续性缺血缺氧引起的心肌坏死,近年来国内患病人数至少有 350 万,呈明显上升趋势。其主要临床特点是起病急、病死率高[1]。目前西药治疗AMI 会使患者出现恶心、腹泻、消化不良、瘙痒、肌痛、胰腺炎、感觉异常、外周神经病变、呕吐和贫血等诸多不良反应[2],因此寻找安全有效、副作用少的中药引起重视。活血通脉颗粒由多种中药配制而成,有改善缺氧状况及循环障碍、降血压、抑制血小板聚集等作用,在动物模型中,可缓解颈动脉粥样硬化兔炎症因子表达水平[3]。在临床上,可改善真性红细胞增多症患者凝血功能从而达到治疗疾病目的[4],但具体作用机制尚不明确。AMI 中大麻素受体 2 可抑制核苷酸结合寡聚化结构域样受体蛋白 3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)/接头蛋白ASC(apoptosis-associated speck-like protein contain a caspase activation and recruitment domain,ASC)/半胱氨酸天冬氨酸蛋白酶酶原(cysteinyl aspartate-specific protease-1,pro-caspase-1)信号通路从而抑制炎症反应以减少心肌梗死[5],但活血通脉颗粒对 AMI 大鼠和人心肌细胞作用尚未见报道。本研究建立 AMI 大鼠模型,观察活血通脉颗粒对AMI 大鼠心肌损伤的作用及对 NLRP3 信号通路的影响并建立人心肌细胞模型验证大鼠模型结果。
1 材料与方法
1.1 材料
1.1.1 实验对象 清洁级健康 SD 大鼠,雄性,重量 200 ~ 220 g,购自中科英海科技有限公司,许可证号:SCXK-2016-0167。饲养于(25 ± 1)℃、(50 ± 10)% 湿度、12 h 黑暗 12 h 光照的实验动物中心,所有实验均经本院动物实验伦理委员会批准;人 H9C2 心肌细胞购自美国 ATCC,货号:GD-C3218858。
1.1.2 药物 活血通脉颗粒由红景天、陈皮、茯苓、红花、生地、赤芍等组成,在云南省中医医院中药房购买并配制;辛伐他汀片购自成都华宇制药有限公司,批号:H005227。
1.1.3 试剂与仪器 苏木素-伊红(HE)染色试剂盒、蛋白裂解液购自北京索莱宝科技有限公司;大鼠 IL-1β、TNF-α、人 IL-1β、TNF-α 酶联免疫(ELISA)试剂盒,一抗 NLRP3(抗兔)、ASC(抗兔)、pro-caspase-1(抗兔)、caspase-1(抗兔)、内参 GADPH(抗鼠)、二抗羊抗兔、羊抗鼠均购自英国 Abcam 公司;Trizol 购自中国赛默飞世尔科技有限公司;cDNA 反转录试剂盒、2 × SYBR Premix Ex TaqTMII Probe QPCR Mix 购自美国 Fermentas 公司;DAB 辣根过氧化物酶显色试剂盒购自碧云天生物科技有限公司;DMEM 培养基、FBS 胎牛血清购自以色列 BI 公司;MTS 溶液购自上海贝博生物科技公司;FPMIC-razoII 型切片机购自德国Leica 公司;UIS2 型普通光学显微镜购自日本 Olympus 公司;4376600 型实时荧光定量 PCR 仪购自美国 ABI公司;E-Gel174 型蛋白凝胶成像仪购自美国 Invitrogen 公司;4700 型酶标仪购自美国 Awareness 公司。
1.2 方法
1.2.1 动物造模 参照文献[6]进行动物造模。42 只大鼠随机选 6 只为空白对照组,其余 36 只大鼠造模。10% 水合氯醛(4 ml/kg)对大鼠腹腔麻醉,气管插管并接呼吸机、心电图机,大鼠左侧胸骨备皮并消毒,3 ~ 4 肋间分离肌肉组织、快速挤出心脏,左冠状动脉前降支下 2 ~ 3 mm 处结扎,待左室前壁部分心肌变白、局部收缩减弱,心电图II 导联 ST 段较术前抬高 0.2 mV 以上即为造模成功。造模成功后立即缝合。术后连续 3 d 肌肉注射 4 万单位青霉素,预防伤口感染。造模过程中大鼠死亡 6 只,存活 30 只。
1.2.2 分组及给药 将造模成功的大鼠随机分为阳性药物对照组,AMI 组,活血通脉颗粒低、中、高剂量组,每组 6 只。阳性对照组灌胃 184 mg/(kg·d)辛伐他汀[7];空白对照组、AMI 组每天灌胃生理盐水;根据临床用药剂量,常用实验动物及人的表面积比例,活血通脉颗粒低(2.7 g生药/kg)、中(5.4 g生药/kg)、高(10.8 g生药/kg)剂量组予以相应剂量药物[8]。连续灌胃 4 周。
1.2.3 HE 染色观察心肌组织形态学变化 灌胃结束第二天,所有大鼠腹腔麻醉,立即打开胸腔分离心脏组织,部分组织–20℃冰箱冻存,部分–80℃冰箱冻存,其余放于 4% 多聚甲醛中。
固定于 4% 多聚甲醛中的组织过夜后至酒精中脱水,二甲苯中透明,石蜡包埋,冷冻凝固后切片,HE 染色,光学显微镜拍照。
1.2.4 ELISA 检测大鼠心肌组织中 IL-1β、TNF-α 水平 用–20℃冰箱冻存的组织制备组织匀浆,5000 r/min 离心 5 min,收集上清后分装待测。按照大鼠 IL-1β、TNF-α ELISA 试剂盒说明书步骤操作。
1.2.5 qRT-PCR 检测大鼠心肌组织中 NLRP3、ASC、caspase-1 mRNA 水平 –80℃冰箱中每个样品取部分组织,Trizol 法提取心肌组织总 RNA,cDNA 反转录试剂盒反转录 cDNA,qRT-PCR 仪对 NLRP3、ASC、caspase-1、GADPH 扩增。引物序列见表 1。扩增体系:cDNA 1 μl(50 ng/μl),F/R(10 μmol/L)各0.5 μl,2 × SYBR Premix Ex TaqTMII Probe QPCR Mix 10 μl,ddH2O 8.0 μl。反应条件:95 ℃ 90 s;95 ℃ 60 s,62 ℃ 55 s,45 个循环。2-∆∆CT法对心肌组织中 NLRP3、ASC、caspase-1、GADPH 表达水平定量分析。
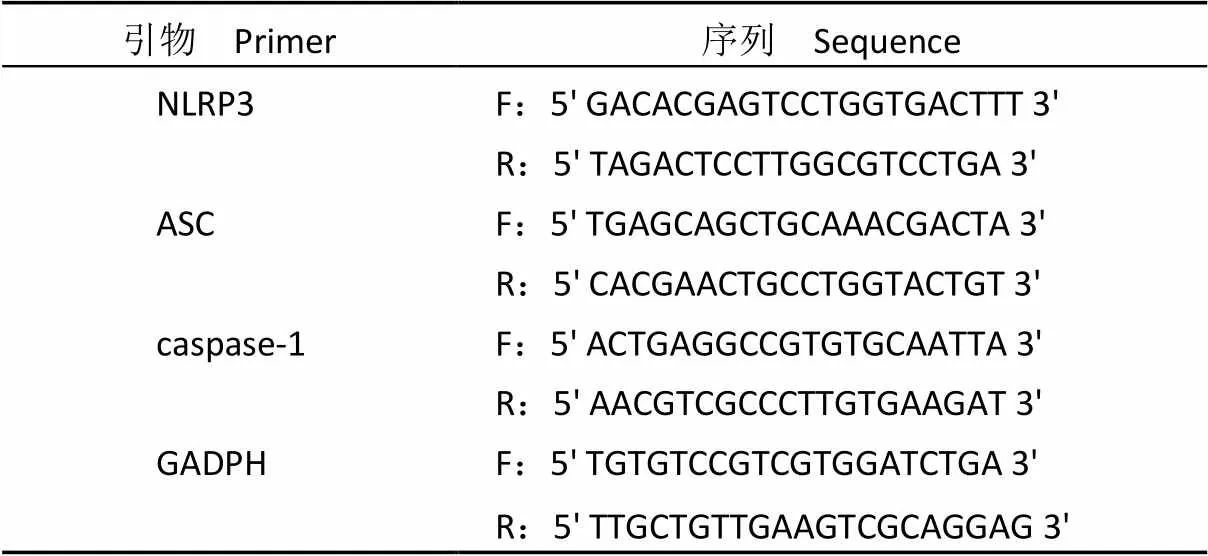
表 1 qRT-PCR 引物序列
1.2.6 蛋白免疫印迹检测大鼠心肌组织中 NLRP3、ASC、pro-caspase-1、caspase-1 蛋白水平 –80 ℃冰箱中每个样品取部分组织,在冰上研磨,每管加1 ml 蛋白裂解液冰上裂解 30 min,提取心肌组织总蛋白,凝胶电泳分离蛋白质后转膜;5% 脱脂奶粉室温封闭 2 h;对应加入一抗NLRP3、ASC、pro-caspase-1、caspase-1、GADPH,4 ℃孵育过夜;加入对应二抗,室温孵育 1 h。DAB 显色试剂盒避光显色,蛋白凝胶成像仪拍照和定量分析。
1.2.7 细胞培养 液氮中取出人 H9C2 心肌细胞,添加 10% FBS 的 DMEM 培养液常规培养,待细胞密度至 80% 时做后续实验。
1.2.8 细胞活力鉴定 实验前分别将辛伐他汀、水煎后的活血通脉颗粒过滤浓缩成 100 ml 定容。放入–20 ℃冰箱中梯度降温至–80 ℃,最后制成干粉,辛伐他汀相当于368 mg/100 ml、活血通脉颗粒相当于21.6 g生药/100 ml。10% FBS DMEM 培养液将上述干粉分别稀释成 1 ml 储备液,分装至–20 ℃冰箱备用。阳性药物对照组按(储备液:10% FBS DMEM 培养液 = 1:1),活血通脉颗粒各剂量组分别按低(储备液:10% FBS DMEM 培养液 = 1:7)、中(储备液:10% FBS DMEM 培养液 = 1:3)、高(储备液:10% FBS DMEM 培养液 = 1:1)稀释备用。
生长良好的细胞制成 5 × 104个/ml 悬浮液至 96 孔板中,每孔 100 μl 继续培养 24 h。参考文献[9],部分 96 孔板放入 95% N2、5% CO2培养箱中缺氧培养 21 h,对应位置分别加入辛伐他汀、活血通脉颗粒低、中、高剂量稀释液,AMI 组加 10% FBS DMEM 培养液;部分 96 孔板常规同样培养 21 h,加 10% FBS DMEM 培养液设为空白对照组,每孔 100 μl。所有 96 孔板分别在培养 0、3、6、9 h 时每孔加 10 μl MTS 溶液,37 ℃孵育3 h,酶标仪 490 nm 处测吸光度()。细胞存活率=[1 –(空白组–实验组)/空白组]× 100%。每孔设置 6 个重复。
1.2.9 ELISA 检测大鼠心肌细胞中 IL-1β、TNF-α 水平 6 孔板常规培养人 H9C2 心肌细胞,至细胞密度 80% ~ 90% 时部分按 1.2.8 缺氧造模方法处理细胞 21 h 后对应加药,AMI 组加 10% FBS DMEM 培养液;空白对照组常规培养 21 h 加 10% FBS DMEM 培养液,所有 6 孔板都常规培养6 h 后收集细胞。按照人 IL-1β、TNF-α ELISA 试剂盒说明书步骤操作。
1.3 统计学处理
2 结果
2.1 各组大鼠组织形态学变化
空白对照组心肌细胞排列整齐,细胞质染色均匀,细胞核分布单一。阳性药物对照组部分细胞细胞核破碎、局部核消失,部分血管可见中性粒细胞颗粒浸润现象。AMI 组心肌细胞凝固性死亡严重,大部分细胞膜碎裂并溶解,细胞质染色较深,血管充血明显、间充质水肿并伴有大量中性粒细胞颗粒浸润细胞现象明显。活血通脉颗粒低、中、高剂量组随着剂量的增加,心肌细胞凝固性坏死现象减弱,梗塞逐渐不明显,细胞核固缩、肿胀或溶解现象减缓,细胞质染色变深、细胞体积变大现象减弱,血管充血、间充质水肿和神经营养细胞浸润症状逐渐减弱(图 1)。
2.2 各组大鼠心肌组织中 IL-1β、TNF-α 表达量变化
与空白对照组相比,AMI 组、活血通脉颗粒低剂量组心肌组织中IL-1β、TNF-α 表达量升高,阳性药物对照组,活血通脉颗粒中、高剂量组心肌组织中TNF-α 表达量升高(< 0.05)。与阳性药物对照组相比,AMI 组、活血通脉颗粒低剂量组心肌组织中IL-1β、TNF-α 表达量升高,活血通脉颗粒中剂量组心肌组织中TNF-α 表达量升高(< 0.05)。与AMI 组相比,活血通脉颗粒中剂量组心肌组织中IL-1β 表达量降低,活血通脉颗粒高剂量组心肌组织中IL-1β、TNF-α 表达量降低(< 0.05)。与活血通脉颗粒低剂量组相比,活血通脉颗粒高剂量组心肌组织中IL-1β、TNF-α 表达量降低(< 0.05)。与活血通脉颗粒中剂量组相比,活血通脉颗粒高剂量组心肌组织中TNF-α 表达量降低(< 0.05)(表 2)。
2.3 各组大鼠心肌组织中 NLRP3、ASC、caspase-1 mRNA 表达量变化
与空白对照组相比,阳性药物对照组心肌组织中 NLRP3、ASC、caspase-1 mRNA 表达差异无统计学意义(> 0.05)。与空白对照组、阳性药物对照组相比,AMI 组,活血通脉颗粒低、中剂量组心肌组织中NLRP3、ASC、caspase-1 mRNA 表达量升高,活血通脉颗粒高剂量组心肌组织中NLRP3 mRNA 表达量升高、caspase-1 mRNA 表达量降低(< 0.05)。与AMI 组相比,活血通脉颗粒中、高剂量组心肌组织中NLRP3、ASC、caspase-1 mRNA 表达量降低(< 0.05)。与活血通脉颗粒低剂量组相比,活血通脉颗粒中剂量组心肌组织中NLRP3、caspase-1 mRNA 表达量降低,活血通脉颗粒高剂量组心肌组织中NLRP3、ASC、caspase-1 mRNA 表达量降低(< 0.05)。与活血通脉颗粒中剂量组相比,活血通脉颗粒高剂量组心肌组织中ASC、caspase-1 mRNA 表达量降低(< 0.05)(表 3)。
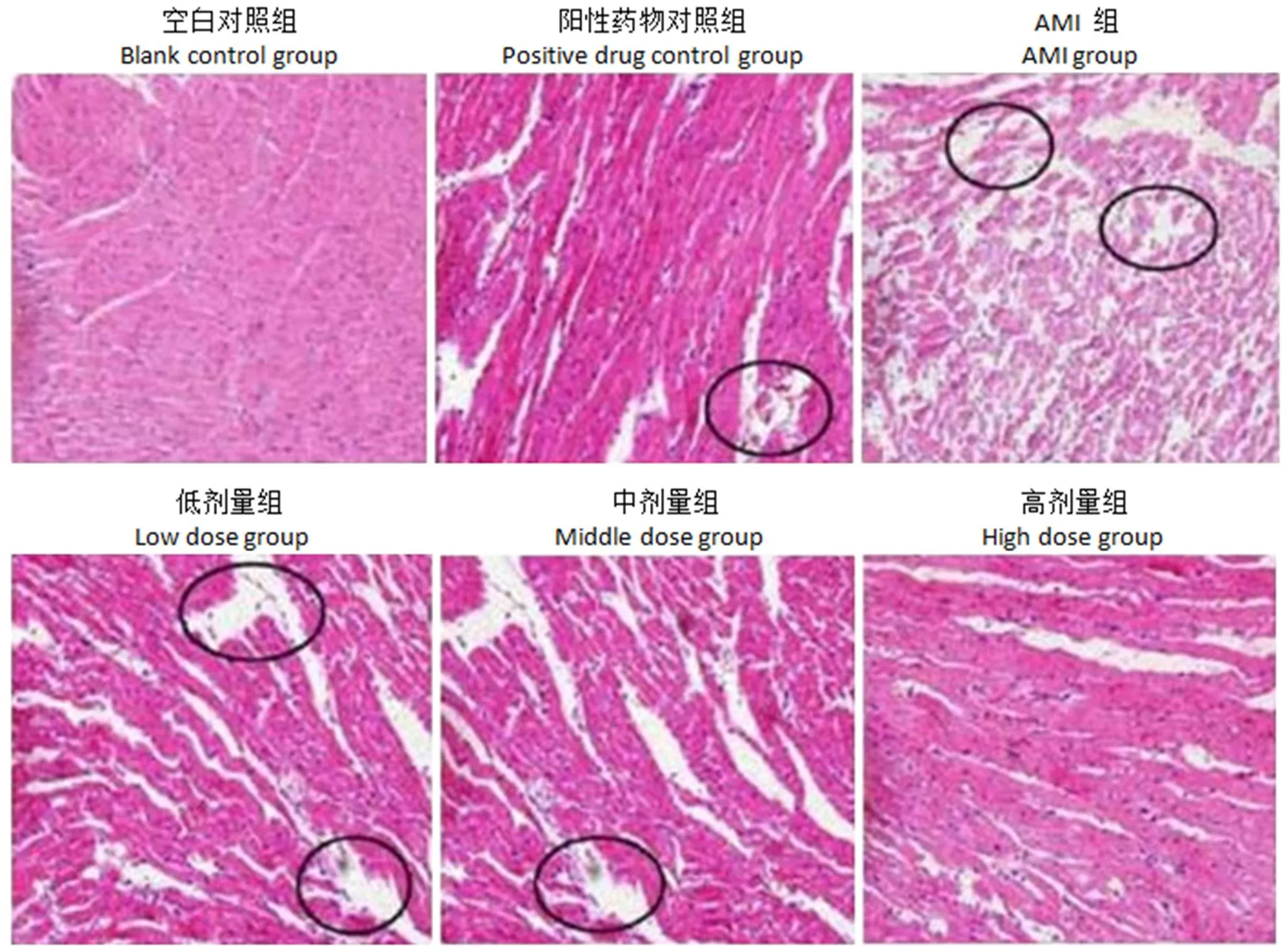
图 1 大鼠心肌组织形态学变化(圆圈表示细胞结构的破坏和炎症细胞渗透部位,200 ×)
Figure 1 Morphological changes of myocardium in rats (circle indicates destruction of cell structure and infiltration site of inflammatory cells, 200 ×)

表 2 各组大鼠心肌组织中 IL-1β、TNF-α 表达量变化(n = 6,)
注:与空白对照组相比,a< 0.05;与阳性药物对照组相比,b< 0.05;与 AMI 组相比,c< 0.05;与低剂量组相比,d< 0.05;与中剂量组相比,e< 0.05。
Notes: Compared with the blank control group,a< 0.05; Compared with positive drug control group,b< 0.05; Compared with AMI group,c< 0.05; Compared with the low dose group,d< 0.05; Compared with the middle dose group,e< 0.05.
2.4 各组大鼠心肌组织中 NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量变化
与空白对照组相比,阳性药物对照组心肌组织中 NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达差异无统计学意义(> 0.05)。与空白对照组、阳性药物对照组相比,AMI 组、活血通脉颗粒低剂量组心肌组织中NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量升高,活血通脉颗粒中剂量组心肌组织中ASC、pro-caspase-1 蛋白表达量升高,活血通脉颗粒高剂量组心肌组织中NLRP3、caspase-1 蛋白表达量降低(< 0.05)。与AMI 组相比,活血通脉颗粒低剂量组心肌组织中ASC、pro-caspase-1、caspase-1 蛋白表达量降低,活血通脉颗粒中、高剂量组心肌组织中NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量降低(< 0.05)。与活血通脉颗粒低剂量组相比,活血通脉颗粒中剂量组心肌组织中NLRP3、pro-caspase-1、caspase-1 蛋白表达量降低,活血通脉颗粒高剂量组心肌组织中NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量下降(< 0.05)。与活血通脉颗粒中剂量组相比,活血通脉颗粒高剂量组心肌组织中NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量下降(< 0.05)(图 2 和表 4)。

表 3 各组大鼠心肌组织中 NLRP3、ASC、caspase-1 mRNA 相对表达量变化(n = 6,)
注:与空白对照组相比,a< 0.05;与阳性药物对照组相比,b< 0.05;与 AMI 组相比,c< 0.05;与低剂量组相比,d< 0.05;与中剂量组相比,e< 0.05。
Notes: Compared with the blank control group,a< 0.05; Compared with positive drug control group,b< 0.05; Compared with AMI group,c< 0.05; Compared with the low dose group,d< 0.05; Compared with the middle dose group,e< 0.05.
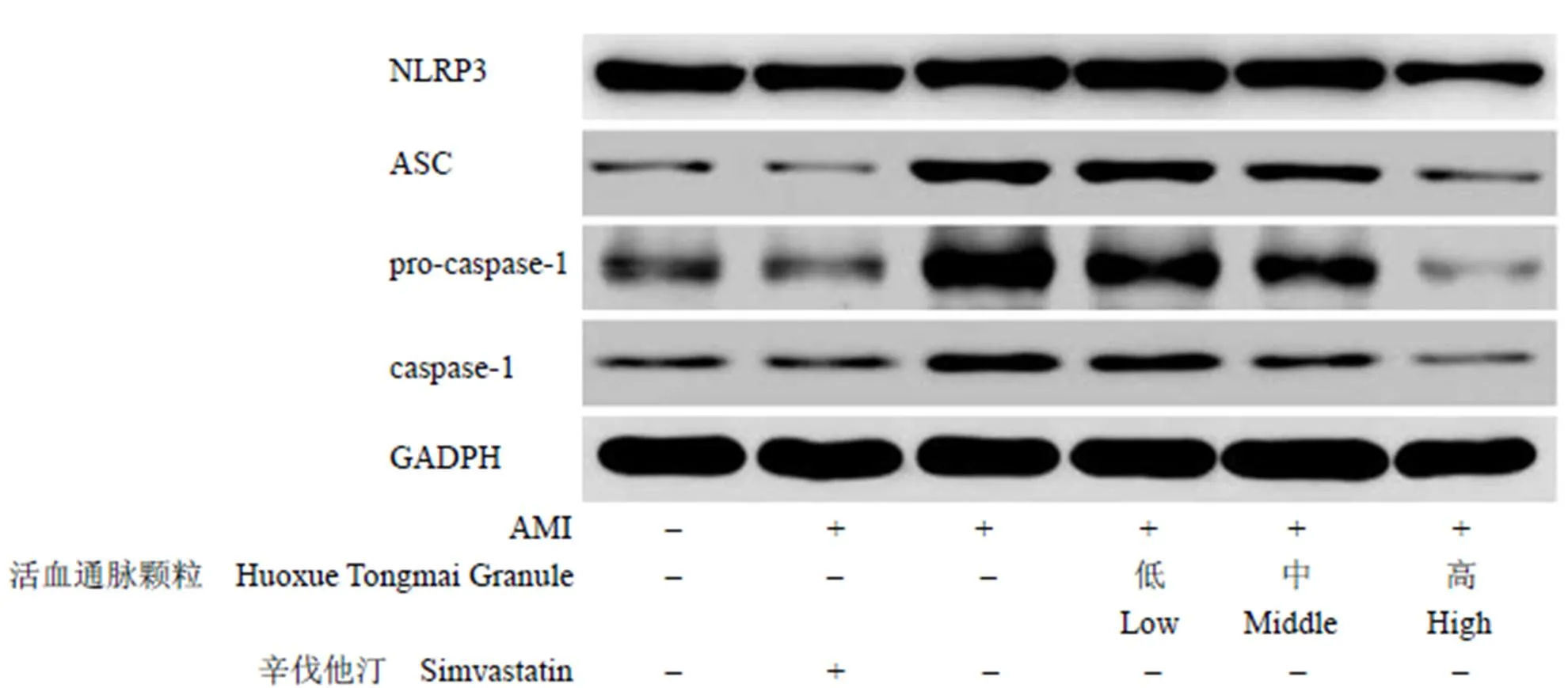
图 2 各组大鼠心肌组织中 NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量变化
Figure 2 Changes of expression of NLRP3, ASC, pro-caspase-1 and caspase-1 in myocardium of rats in each group

表 4 各组大鼠心肌组织中 NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量变化(n = 6,)
注:与空白对照组相比,a< 0.05;与阳性药物对照组相比,b< 0.05;与 AMI 组相比,c< 0.05;与低剂量组相比,d< 0.05;与中剂量组相比,e< 0.05。
Notes: Compared with the blank control group,a< 0.05; Compared with positive drug control group,b< 0.05; Compared with AMI group,c< 0.05; Compared with the low dose group,d< 0.05; Compared with the middle dose group,e< 0.05.
2.5 各组人心肌细胞活力鉴定
H9C2 细胞药物处理 0 h 时,与空白对照组相比,阳性药物对照组,AMI 组,活血通脉颗粒低、中、高剂量组细胞存活率降低(< 0.05)。药物处理 3 h 时,与空白对照组相比,阳性药物对照组,AMI 组,活血通脉颗粒低、中、高剂量组细胞存活率降低(< 0.05);与阳性药物对照组相比,AMI 组、活血通脉颗粒低剂量组细胞存活率降低(< 0.05)。药物处理 6、9 h 时,与空白对照组相比,阳性药物对照组,AMI 组,活血通脉颗粒低、中、高剂量组细胞存活率降低(< 0.05);与阳性药物对照组相比,AMI 组,活血通脉颗粒低、中剂量组细胞存活率降低(< 0.05);与 AMI 组相比,活血通脉颗粒低、中、高剂量组细胞存活率升高(< 0.05);与活血通颗粒低剂量组相比,活血通脉颗粒中、高剂量组细胞存活率升高(< 0.05);与活血通颗粒中剂量组相比,活血通脉颗粒高剂量组细胞存活率升高(< 0.05)(表 5)。
2.6 各组人心肌细胞药物处理形态
空白对照组细胞呈长梭形,细胞贴壁分布均匀、连接紧密、且密度较大。与空白对照组相比,阳性药物组细胞皱缩、密度减少;AMI 组细胞皱缩严重、部分细胞变圆形、细胞间隙变大、细胞死亡明显;活血通脉颗粒药物干预后,随着药物剂量的增加,细胞密度逐渐增大,形态逐步改善(图 3)。
2.7 各组人心肌细胞中 IL-1β、TNF-α 水平
与空白对照组相比,阳性对照组、活血通脉颗粒高剂量组心肌细胞中IL-1β 表达量升高,AMI 组,活血通脉颗粒低、中剂量组心肌细胞中IL-1β、TNF-α 表达量升高(< 0.05)。与阳性药物对照组相比,AMI 组、活血通脉颗粒低剂量组心肌细胞中IL-1β、TNF-α 表达量升高,活血通脉颗粒中剂量组心肌细胞中TNF-α 表达量升高(< 0.05)。与AMI 组相比,活血通脉颗粒中、高剂量组心肌细胞中IL-1β、TNF-α 表达量降低(< 0.05)。与活血通脉颗粒低剂量组相比,活血通脉颗粒中、高剂量组心肌细胞中IL-1β、TNF-α 表达量降低(< 0.05)。与活血通脉颗粒中剂量组相比,活血通脉颗粒高剂量组心肌组织中TNF-α 表达量降低(< 0.05)(表 6)。

表 5 各组人 H9C2 细胞药物处理不同时间细胞存活率(%,n = 6,)
注:与空白对照组相比,a< 0.05;与阳性药物对照组相比,b< 0.05;与 AMI 组相比,c< 0.05;与低剂量组相比,d< 0.05;与中剂量组相比,e< 0.05。
Notes: Compared with the blank control group,a< 0.05; Compared with positive drug control group,b< 0.05; Compared with AMI group,c< 0.05; Compared with the low dose group,d< 0.05; Compared with the middle dose group,e< 0.05.
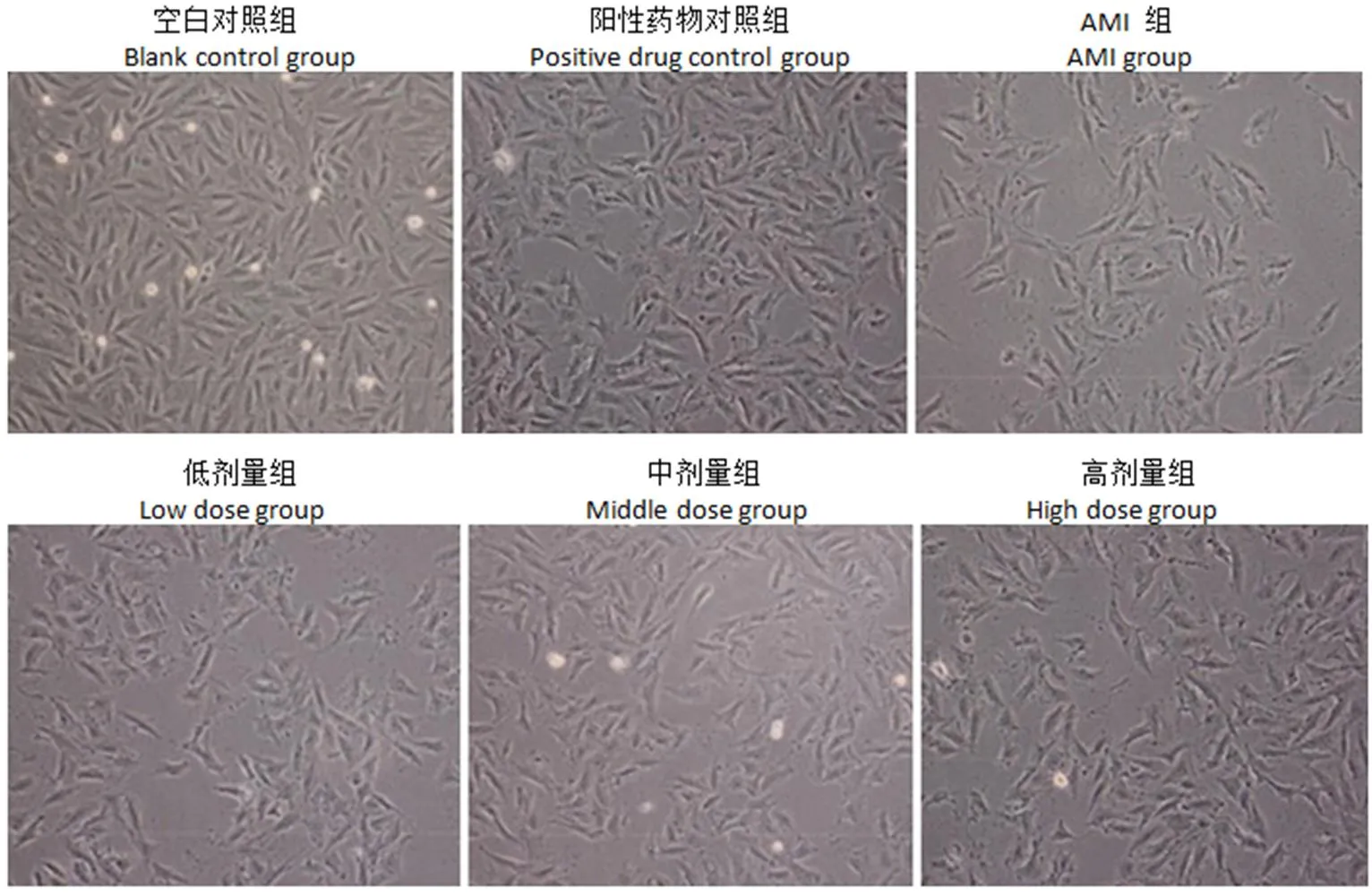
图 3 各组人 H9C2 细胞药物处理 6 h 时形态变化(200 ×)
Figure 3 Morphological changes of human H9C2 cells treated with drugs for 6 hours in each group (200 ×)

表 6 各组大鼠心肌细胞中 IL-1β、TNF-α 表达量变化(n = 6,)
注:与空白对照组相比,a< 0.05;与阳性药物对照组相比,b< 0.05;与 AMI 组相比,c< 0.05;与低剂量组相比,d< 0.05;与中剂量组相比,e< 0.05。
Notes: Compared with the blank control group,a< 0.05; Compared with positive drug control group,b< 0.05; Compared with AMI group,c< 0.05; Compared with the low dose group,d< 0.05; Compared with the middle dose group,e< 0.05.
3 讨论
AMI 发生常伴有心律失常、附壁血管形成、心力衰竭和心源性休克等一系列并发症,是冠心病的严重类型,目前发生率和病死率都较高,严重影响患者生活质量[9]。寻找安全有效的治疗方法迫在眉睫。本病属中医的“真心痛”、“厥心痛”范畴,其并发症属心悸、喘证、厥脱等范围[10]。中药治疗 AMI 较安全且不易复发,银杏内酯 B 提高 AMI 患者射血分数、益气活血方可实现 AMI 患者心肌重建,改善心肌缺血现状[11-12],活血通脉颗粒主要成分由红景天、法半夏、陈皮、茯苓、甘草、桃仁、当归、川芎、麝香、红花、生地、赤芍成分组成,在颈动脉粥样硬化兔模型中可抑制促炎因子水平,进而干预兔斑块形成,达到治疗兔颈动脉粥样硬化目的[3],但活血通脉颗粒在 AMI 大鼠中发挥的作用尚不清楚。本研究建立大鼠AMI 模型,发现大鼠心肌细胞死亡,细胞膜碎裂,细胞质染色较深,一些细胞细胞核消失,细胞因缺氧被破坏,但对心肌细胞的具体功能的影响尚不明确。活血通脉颗粒处理大鼠后,随着剂量的增加,缺氧处理的大鼠症状逐渐减轻,细胞死亡症状逐渐减轻,细胞质染色变浅、细胞间充质水肿现象缓解,提示活血通脉颗粒可缓解 AMI 造成的心肌细胞坏死、心肌梗死等症状。
IL-1β 是 IL-1 的主要分泌形式,可促进炎症反应,在炎症疾病中高表达会诱发炎症机制,加重病情[13],在 AMI 患者中高表达可加重 AMI 进程[14]。TNF-α 是炎症反应中出现最早、最重要的炎症介质、是炎性肠病中肠炎症的中枢介质[15],在 AMI 患者中高表达破坏 AMI 生理过程,会使不良预后比例上升[16]。IL-1β 和 TNF-α 可反映 AMI 机体炎症程度。本研究发现,与空白对照组相比,AMI 组心肌组织中IL-1β、TNF-α 表达升高,提示 AMI 组心肌组织中IL-1β、TNF-α 表达升高可诱发炎症机制、加重 AMI 进程。与AMI 组相比,活血通脉颗粒低剂量组心肌组织中IL-1β、TNF-α 的变化不明显,提示较低的药物剂量可能对 AMI 的影响较小;但随着活血通脉颗粒剂量的增加,心肌组织中IL-1β、TNF-α 的表达量逐渐降低,提示活血通脉颗粒可降低 AMI 引起的IL-1β、TNF-α 升高现象,并且随着剂量的增加对 IL-1β、TNF-α 作用越强。
NLRP3 存在于细胞质中,是机体固有免疫系统的重要成员,是 NLRs 家族成员之一,过度激活与 AMI 严重程度有关[17]。受损细胞释放三磷酸腺苷和透明胶质、斑块β 淀粉样蛋白纤维等多种因素均可激活NLRP3 炎症体[18-20]。激活后的 NLRP3促进 ASC 募集并激活 caspase-1,活化的 caspase-1促进机体分泌IL-1β 和 TNF-α,进而诱导炎症介质、炎症细胞等在患病处堆积,导致机体发生炎症并诱导细胞损伤严重时细胞坏死[21]。本研究发现与空白对照组相比,AMI 组心肌组织中NLRP3、ASC、caspase-1 mRNA 和蛋白、pro-caspase-1蛋白表达量升高,提示 AMI 心肌组织中 NLRP3 炎症体被激活从而促进 ASC 募集并激活 caspase-1,活化的 caspase-1 促进相关炎症因子的分泌进而损坏心肌组织,加重 AMI 进程。随着活血通脉颗粒剂量的增加,AMI 大鼠心肌组织中NLRP3、caspase-1 mRNA 和蛋白、pro-caspase-1 蛋白表达量逐渐降低,呈剂量依赖性。提示活血通脉颗粒可能抑制AMI 心肌组织中 NLRP3 炎症体激活,减少机体炎症从而保护心肌细胞。
以人心肌细胞为模型进一步研究,发现缺氧处理 H9C2 心肌细胞,阳性药物对照,活血通脉颗粒低、中、高剂量组后细胞活力降低;添加活血通脉颗粒,随着药物时间的延长细胞活力逐渐增强。在药物处理 6 h 时,AMI 组细胞壁皱缩,死亡严重;随着活血通脉颗粒剂量的增加,细胞形态逐渐改善,且细胞中IL-1β、TNF-α 水平与大鼠模型有类似结果。提示大鼠和人心肌细胞模型中,缺氧都会破坏心肌细胞,加重心肌细胞中炎症因子水平,活血通脉颗粒剂量可减缓由缺氧造成的心肌细胞损伤状态,同时减弱炎症因子水平。
综上所述,活血通脉颗粒通过抑制炎症小体NLRP3/ASC/caspase-1 通路、降低IL-1β、TNF-α 炎症因子水平进而抑制心肌组织炎症反应,减轻心肌组织炎症损伤,实现对AMI 大鼠的心肌组织保护作用。
[1] Zhang L, Wang Z, Wang D, et al. CD8+CD28+T cells might mediate injury of cardiomyocytes in acute myocardial infarction. Mol Immunol, 2018, 101:74-79.
[2] Fu YJ, Liu ZN, Song YX. Clinical trial of metoprolol tartrate tablet in combination with simvastatin tablet in the treatment of coronary heart disease with angina pectoris. Chin J Clin Pharmacol, 2018, 34(8):922- 925. (in Chinese)
付盈菊, 刘志宁, 宋玉新. 酒石酸美托洛尔片联合辛伐他汀片治疗冠心病心绞痛的临床研究. 中国临床药理学杂志, 2018, 34(8):922- 925.
[3] Xie J, Shen C, Tong XY, et al. Effects of Huoxue Tongmai granules on TLR4 signaling pathways and relevant inflammatory factor mrna expression of rabbits with atherosclerosis. Chin J Inf Traditional Chin Med, 2016, 23(3):47-50. (in Chinese)
谢健, 沈超, 童晓云, 等. 活血通脉颗粒对颈动脉粥样硬化兔TLR4信号通路及相关炎症因子mRNA表达的影响. 中国中医药信息杂志, 2016, 23(3):47-50.
[4] Zang FJ, Wang SQ, Wang ND, et al. Effect of Huoxue Tongmai granule on K value in thromboelastogram in patients with polycythemia vera. J Anhui Univ Chin Med, 2017, 36(2):22-25. (in Chinese)
臧奉娇, 王树庆, 王念德, 等. 活血通脉颗粒对真性红细胞增多症患者血栓弹力图K值的影响. 安徽中医药大学学报, 2017, 36(2): 22-25.
[5] Yu W, Jin G, Zhang J, et al. Selective activation of cannabinoid receptor 2 attenuates myocardial infarction via suppressing NLRP3 inflammasome. Inflammation, 2019, 42(3):904-914.
[6] Ke F, Zuo KK, Gu N. Effects of "GuanXin V" preparation on rats ventricular remodeling and inflammatory factors with acute myocardial infarction. J Basic Chin Med, 2016, 22(1):50-53. (in Chinese)
柯峰, 左可可, 顾宁. “冠心V号”制剂对急性心肌梗死模型大鼠心室重构及炎症因子的影响. 中国中医基础医学杂志, 2016, 22(1): 50-53.
[7] Dong GJ, Zhang QX, Liu JG, et al. Effects of component compatibility of Huoxue Jiedu herbs on inflammation level after acute myocardial infarction in different periods. Global Traditional Chin Med, 2018, 11(12):1857-1861. (in Chinese)
董国菊, 张庆祥, 刘剑刚, 等. 活血解毒中药配伍对大鼠急性心肌梗死后不同时段炎症水平的影响. 环球中医药, 2018, 11(12):1857- 1861.
[8] Guan L, Yang GL, Zhang Z, et al. Study on main pharmacodynamics related to functions of Hexue Tongmai particles. Chin Arch Traditional Chin Med, 2014, 32(1):47-50. (in Chinese)
关乐, 杨关林, 张哲, 等. 和血通脉颗粒与功能主治有关的主要药效学实验研究. 中华中医药学刊, 2014, 32(1):47-50.
[9] Lei SP, Long ZJ, Shi H, et al. Protection of Polygonatum sibiricum polysaccharides on H9c2 myocardial cells injury induced by hypoxia-reoxygenation. Pharmacol Clin Chin Mater Med, 2017, 33(1): 102-106. (in Chinese)
雷升萍, 龙子江, 施慧, 等. 黄精多糖对缺氧复氧诱导H9c2心肌细胞损伤的保护作用. 中药药理与临床, 2017, 33(1):102-106.
[10] Feng XZ, Diao J, Fang T, et al. Effects of traditional Chinese medicine on myocardial reperfusion and cardiac function in patients with myocardial infarction treated by interventional therapy. Chin Arch Traditional Chin Med, 2018, 36(11):2760-2763. (in Chinese)
冯小智, 刁杰, 方婷, 等. 中医辨证治疗对行介入疗法的急性心肌梗死患者心肌再灌注和心功能的改善作用. 中华中医药学刊, 2018, 36(11):2760-2763.
[11] Jiang JH, Deng QH, Gao YY. Effects of ginkgolide B on the ventricular wall motion of patients with acute myocardial infarction after revascularization. Chin Traditional Patent Med, 2018, 40(2):294- 299. (in Chinese)
江家华, 邓庆华, 高于英. 银杏内酯B对急性心肌梗死患者血运重建后心室壁运动的影响. 中成药, 2018, 40(2):294-299.
[12] Wu JN, Guo SW, Qi X, et al. Effects of Yiqi Huoxue Formula on capillary morphology and VEGFR-2 and HIF-1α expression in ischemic myocardium in myocardial infarction rats model. ChinaJ Traditional Chin Med Pharm, 2018, 33(5):1886-1890. (in Chinese)
吴佳妮, 郭书文, 齐欣, 等. 益气活血方对心肌梗死大鼠心肌毛细血管形态及VEGFR-2和HIF-1α的影响. 中华中医药杂志, 2018, 33(5):1886-1890.
[13] Ma T, Liu X, Cen Z, et al. MicroRNA-302b negatively regulates IL-1β production in response to MSU crystals by targeting IRAK4 and EphA2. Arthritis Res Ther, 2018, 20(1):34.
[14] Yu Y, Jin L, Zhuang Y, et al. Cardioprotective effect of rosuvastatin against isoproterenol-induced myocardial infarction injury in rats. Int J Mol Med, 2018, 41(6):3509-3516.
[15] Maolake A, Izumi K, Natsagdorj A, et al.Tumor necrosis factor-α induces prostate cancer cell migration in lymphatic metastasis through CCR7 upregulation. Cancer Sci, 2018, 109(5):1524-1531.
[16] Wang YX, Lu YP. IL-8, IL-1, the role of TNF alpha in AMI and significance. Med Front, 2015, 5(2):7-8. (in Chinese)
王禹雪, 陆永萍. 白介素-8、白介素-1、TNF-α在AMI中的作用及意义. 医药前沿, 2015, 5(2):7-8.
[17] Westerterp M, Fotakis P, Ouimet M, et al. Cholesterol efflux pathways suppress inflammasome activation, NETosis and atherogenesis. Circulation, 2018, 138(9):898-912.
[18] Li R, Wang J, Li R, et al. ATP/P2X7-NLRP3 axis of dendritic cells participates in the regulation of airway inflammation and hyper-responsiveness in asthma by mediating HMGB1 expression and secretion. Exp Cell Res, 2018, 366(1):1-15.
[19] Christ A, Günther P, Mar L, et al. Western diet triggers NLRP3-dependent innate immune reprogramming. Cell, 2018, 172(1-2):162-175, e14.
[20] Fekete C, Vastagh C, Dénes Á, et al. Chronic amyloid β oligomer infusion evokes sustained inflammation and microglial changes in the rat hippocampus via NLRP3. Neuroscience, 2019, 405:35-46.
[21] Xu F, Ji Q, Zhang J, et al. AlCl3 inhibits LPS-induced NLRP3 inflammasome activation and IL-1β production through suppressing NF-κB signaling pathway in murine peritoneal macrophages. Chemosphere, 2018, 209:972-980.
Intervention effect of Huoxue Tongmai Granule on immune inflammation disorders in acute myocardial infarction rats based on NLRP3 signaling pathway
HAN Yu-ze, TIAN Zheng, ZHONG Lei
Author Affiliations: Department of Cardiology, Dalian Friendship Hospital, Liaoning 116001, China (HAN Yu-ze); Department of Cardiology, Affiliated Zhongshan Hospital of Dalian University, Liaoning 116001, China (TIAN Zheng); Department of Cardiology, The First Affiliated Hospital of Dalian Meidcal University, Liaoning 116001, China (ZHONG Lei)
To investigate the effect of Huoxue Tongmai Granule (HXTMG) on immune inflammation disorders in rats with acute myocardial infarction (AMI).
Six from forty-two rats were randomly selected as blank control group, and the rest thirty-six rats were made as models by AMI. Thirty surviving rats were randomly divided into five groups: positive drug control group, AMI group, low, middle and high-dose HXTMG groups, with six rats in each group. The blank control group and the AMI group were given normal saline daily for intragastric administration. The positive drug control group was given 184 mg/(kg·d) of simvastatin for intragastric administration, and the low, medium and high-dose HXTMG groups were given 2.7, 5.4, 10.8 g/(kg·d) of crude drug, respectively, once a day for 28 days. Human hypoxia model of H9C2 cardiomyocytes was established, and treated with hypoxia for 21 h, followed by treatment with drugs. HE staining was used to observe the histomorphological changes of myocardium. MTS was used to detect changes in myocardial cell viability. The levels of IL-1β and TNF-α in myocardium were detected by ELISA. Quantitative RT-PCR was used to detect the levels of nucleotide-binding oligomerization domain-like receptor protein 3 (NLRP3), apoptosis-associated speck-like proteincontain a caspase activation and recruitment domain (ASC), and cysteinyl aspartate specific proteinase 1 (caspase-1) mRNA in myocardium. The levels of NLRP3, ASC, cysteine-containing aspartate-specific-1 protease (pro-caspase-1) and caspase-1 proteins in myocardium were detected by Western blot.
In the rat and cardiomyocyte models, the AMI group was severely damaged, with significant morphological and structural damages. With the increase of dose of HXTMG, the necrosis of myocardial cells is weakened and the morphology is gradually restored. In the rat model, expressions of IL-1β, TNF-α, NLRP3, ASC, caspase-1 mRNA and protein along with pro-caspase-1 protein in the myocardium of AMI group was increased as compared with the blank control group, (< 0.05). Compared with the AMI group, expressions of ASC, pro-caspase-1 and caspase-1 protein in the myocardium of low-dose HXTMG group was decreased. Also, expressions of IL-1β, NLRP3, ASC, caspase-1 mRNA and protein, and pro-caspase-1 protein in the myocardium of middle-dose HXTMG group was decreased. In addition to the changes similar as middle-dose HXTMG group, the expressions TNF-α mRNA and protein were further decreased in the high-dose HXTMG group (< 0.05). With the increase of HXTMG dose, the expressions of above stated pro-inflammatory factors changed in a dose-dependent manner (< 0.05). The changes of IL-1β and TNF-α in the human cardiomyocytes were similar as those in the rat model at 6 h.
Huoxue Tongmai Granule may protect AMI injury by attenuating the NLRP3 signaling pathway and inhibit the expression of pro-inflammatory cytokines.
Myocardial infarction; Huoxue Tongmai Granule; Immune inflammation; Nucleotide-binding oligomerization domain-like receptor protein 3 signaling pathway
HAN Yu-ze, Email: hzr523326@sina.com
10.3969/j.issn.1673-713X.2019.05.008
韩玉泽,Email:hzr523326@sina.com
2019-03-26

