脆性X综合征外周血淋巴细胞永生化细胞系的建立与验证
高飞,胡泽斌,孙楠,段然慧,游延军,左甜甜,夏昆,黄杰
脆性X综合征外周血淋巴细胞永生化细胞系的建立与验证
高飞*,胡泽斌*,孙楠,段然慧,游延军,左甜甜,夏昆,黄杰
100050 北京,中国食品药品检定研究院体外诊断试剂所非传染病诊断试剂室(高飞、胡泽斌、孙楠、黄杰),中药民族药检定所天然药物室(左甜甜);410078 长沙,中南大学生命科学学院医学遗传学研究中心(段然慧、夏昆);611731 成都,四川省食品药品检验检测院(游延军)
脆性 X 综合征(fragile X syndrome,FXS)是一种 X 连锁不完全外显性遗传病,是引起遗传性智力低下和孤独症谱系障碍最常见的单基因病[1],因细胞中 X 染色体末端在特殊培养基中经诱变剂作用后可显示如同断裂的脆性部位而得名。男性患者多见且症状较重,表现为智力低下、巨睾、特殊面容、语言行为障碍等;女性携带者约 1/3 表现出智力低下或其他症状。95% ~ 99% 的 FXS 患者是由1基因 5'UTR CGG 重复扩增的动态突变和异常甲基化导致1 基因转录沉默、FMRP 蛋白合成减少或丢失所致。正常人群中 CGG 重复数目在 5 ~ 44 之间,最常见的重复数目为 29 或 30;CGG 重复数目在 45 ~ 54 之间时称为灰区(中间型),该等位基因亦属正常范围;传递过程中可发生小尺寸的重复数目增加或减少,一代内不会扩增至全突变,但可在更远的世代传递中扩增为全突变,从而导致发病。前突变(premutation,PM)CGG 重复数目在 55 ~ 200 之间,无FXS 患病表现;全突变(full mutation,FM)CGG 重复扩增至 200 以上,部分重复数目达几百甚至上千,FXS 特征表现明显[2]。具体的1基因突变类型与发病关系如图 1 所示。

图 1 FMR1基因型与发病关系[3]
1995 年至今,我国共对 12 676 例智力低下患儿进行了脆性 X 综合征的筛查,查出患儿共计 804 例,以此计算出脆性 X 综合征在我国智力低下患儿中的患病率约为 6.3%[4]。鉴于该遗传病患者生活不能自理、发病率较高且样本获得困难的特点,对临床样本的永生化细胞系的转化和有效检测方法的建立至关重要,可以为脆性 X 遗传病和分子生物学研究提供长期稳定的遗传资源。目前国内相关的研究,特别是脆性 X 综合征永生化细胞系建立的报道较少。本研究的验证方法采用荧光 PCR-毛细管电泳法和 Southern blot 法,Southern 印迹杂交是目前最主要的脆性 X 确诊方法[5],可诊断出全突变患者和 CGG 异常扩增次数较多的前突变携带者,但对扩增次数较少的前突变携带者或嵌合体携带者可能存在漏检。因此采用荧光 PCR-毛细管电泳法和Southern blot 法相结合的检测方法可保证验证结果的全面及准确。
1 材料与方法
1.1 材料
1.1.1 样本来源 取经在中南大学家辉遗传医院确诊患者的外周血 5 ml。患者均签署知情同意书。样本信息详见表 1。

表 1 10 例样本信息
1.1.2 试剂和耗材 核酸提取试剂盒为宝生物工程(大连)有限公司产品;永生化细胞系建立所需试剂购自美国 Gibco 公司;参考品验证所需试剂盒购自广州市达瑞生物技术股份有限公司和北京贝瑞和康生物技术有限公司;NanoDrop 核酸蛋白测定仪为安捷伦公司产品。
1.2 方法
1.2.1 EBV 病毒液的制备 利用饥饿后的病毒细胞准备新鲜病毒液,RPMI1640 + 1× 双抗,复苏 1 株 B95-8 细胞株,接种于5 ml 20% FBS 和 80% RPMI1640 的培养基中,每隔 2 ~ 3 天补液一次,逐渐增加培养液到所需的用量,饥饿细胞 4 ~ 7 d 后,收集细胞在液氮及 37 ℃条件下反复冻融 3 次,2000 r/min 离心 10 min。取上清液用 0.2 μm 滤膜过滤后短暂放置于 4 ℃冰箱,最终于–70 ℃超低温冰箱保存备用。
1.2.2 脆性 X 综合征患者淋巴细胞的分离 使用肝素抗凝管盛装患者及亲属的外周静脉全血 5 ml,将血液转移到 Corning 离心管后加入 4 ml Ficoll 淋巴细胞分离液,加入等体积的含有青霉素及链霉素的 RPMI1640 培养液,2500 r/min 离心 30 min 后移取白色絮状淋巴细胞至另一试管中,加入8 ml RPMI1640 洗涤 2 次,800 r/min 离心 10 min 备用。
1.2.3 脆性 X 综合征患者淋巴细胞的永生化转化 将分离出的细胞用 8 ml RPMI1640 培养基洗涤 2 次后,在800 r/min 条件下离心10 min 去上清,加入 EBV病毒液1.5 ml,环孢菌素 A 0.4 ml(200 μg/ml 母液,最终作用浓度 2 μg/ml),混匀后等份转入 2 个 10 ml 培养瓶中,置于 37 ℃ 5% CO2培养箱中,培养 24 ~ 48 h 后,使用倒置显微镜观察细胞转化情况并拍照,根据细胞转化和聚集情况进行加液或半量换液,当细胞数达到(3 ~ 6)× 106个/ml 时将细胞吹匀,1500 r/min 离心 5 min 后用冻存液重悬并置于冻存管中冻存。
1.2.4 脆性 X 综合征患者永生化细胞系的冻存 在细胞株冻存前 24 h 换液;将细胞培养物收集至 10 ml 离心管中,1200 r/min 离心 10 min,弃上清,根据细胞的数量加入一定量的冻存液(30% 胎牛血清、70% RPMI1640、10% 二甲基亚砜,过滤灭菌,–20 ℃避光保存),分装在冻存管中,每管1 ml 冻存液,置–20 ℃ 2 h 后置于–70 ℃,2 h 后放入液氮中保存。
1.2.5 脆性 X 综合征患者永生化细胞系的分子生物学检验 将脆性 X 综合征患者永生化细胞系取出复苏后进行 DNA 提取,再进行荧光 PCR-毛细管电泳法和 Southern blot 法的验证检验。
2 结果
2.1 脆性 X 综合征患者淋巴细胞的永生化转化显微镜验证结果
10 份细胞株样本在复苏并培养 7 d 时,在倒置显微镜下可观察到光滑透亮的淋巴细胞明显发生增大、聚团,且细胞周边有较多的胞质突出(图 2);30 d 时,显微镜下可观察到淋巴细胞生长形成密集的细胞团且外壁有不规则毛刺状突起(图 3),表明细胞转化为淋巴母细胞样 B 细胞,表明转化成功。
2.2 脆性 X 综合征患者永生化细胞系分子生物学验证结果
将 10 份永生化细胞株样本用核酸提取试剂盒进行 DNA 抽提,提取的 DNA 用NanoDrop 核酸蛋白测定仪测定260/280和260/230值并用琼脂糖凝胶电泳胶检验 DNA 的完整性,NanoDropTMOne 对 DNA 进行精确定量;对 DNA 样本进行荧光 PCR-毛细管电泳法及Southern blot 法检验分析,分析结果显示全部阳性样本的碱基序列与样本 CGG 重复数一致。检测结果见表 2、图 4、图 5。
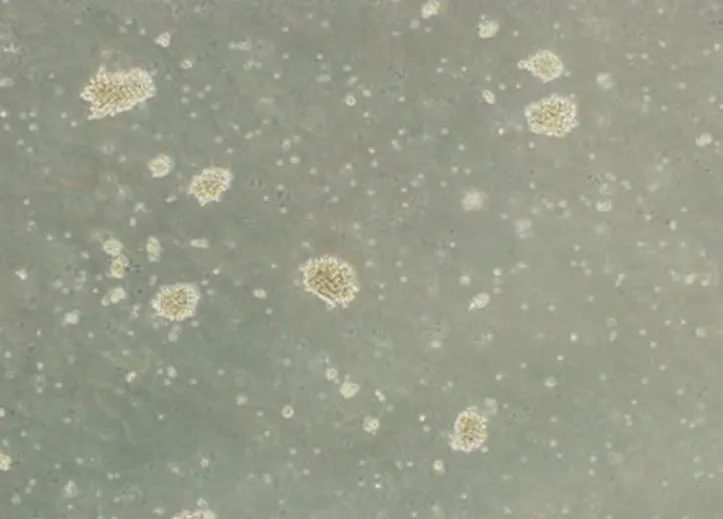
图 2 永生化细胞系转化第 7 天结果(40 ×)
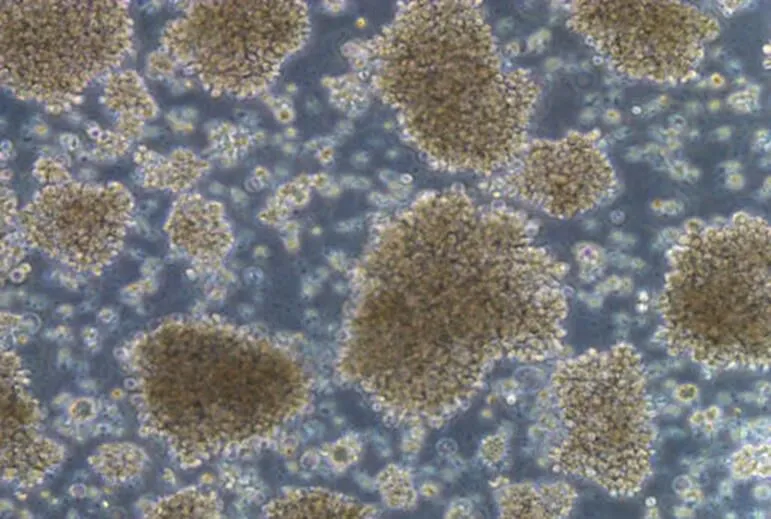
图 3 永生化细胞系转化第 30 天结果(100 ×)

表 2 10 份脆性 X 样本永生化细胞系验证结果
注:该 10 份脆性 X 永生化细胞系样本为建系成功后液氮冻存的样本。
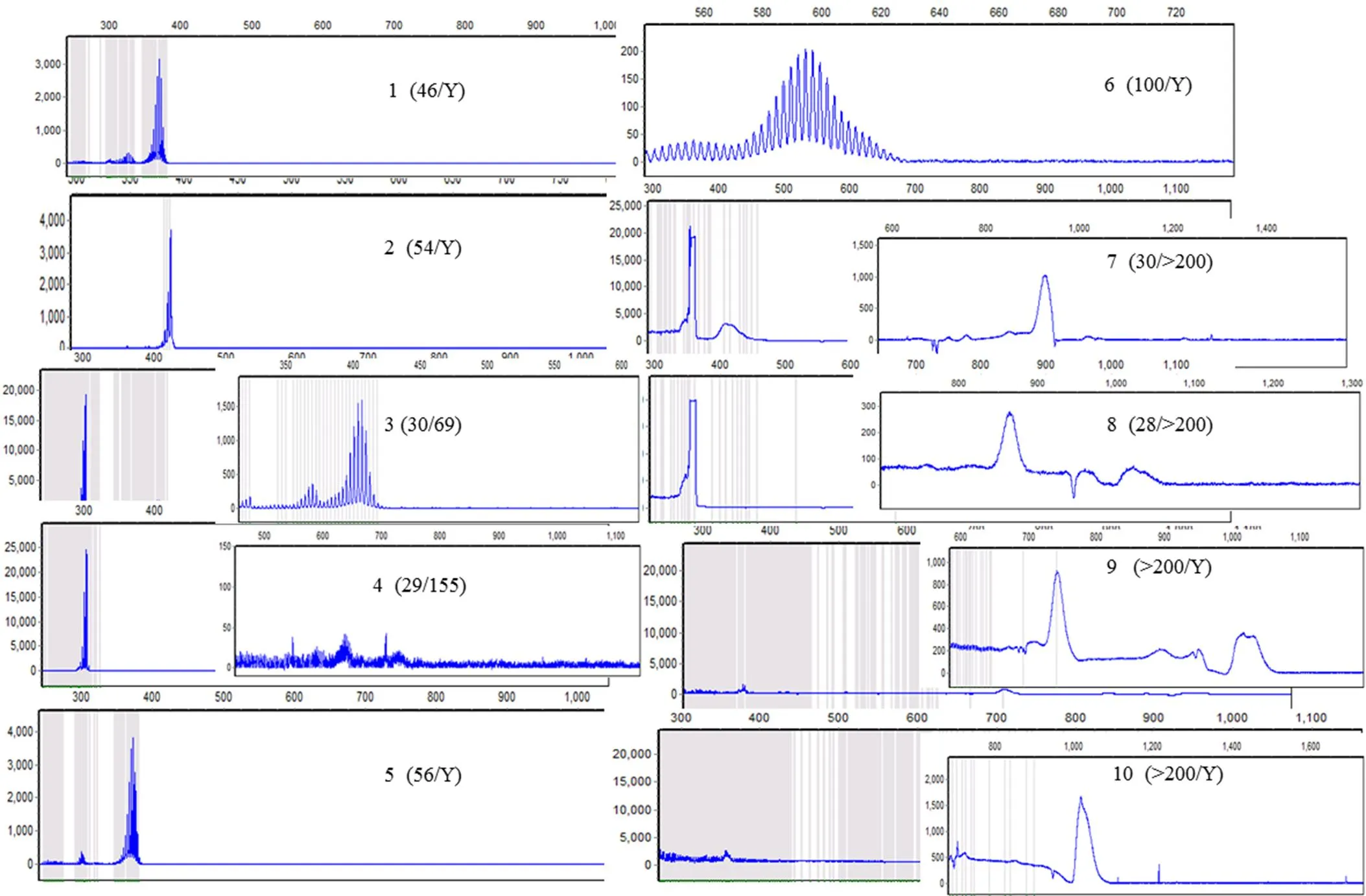
图 4 10 份脆性 X 样本永生化细胞系荧光 PCR-毛细管电泳法结果

图 5 10 份脆性 X 样本永生化细胞系 Southern blot 法结果
3 讨论
建立具有人类全基因组的永生化淋巴细胞系,是人类重要疾病遗传资源保存与收集的主要技术手段和首选方法[6]。目前世界上具有较大影响力的基因细胞遗传资源存储机构包括英国生物样本库(The UK Biobank)、美国国立卫生研究院(National Institutes of Health,NIH)和美国国家人类基因细胞库(The NIGMS Human Genetic Cell Repository),它们均是以永生化淋巴细胞系作为最主要的技术方法保存细胞遗传资源[7]。建立永生化淋巴细胞系的优点明显:样本用量较少,由 EBV 转化外周血 B 淋巴细胞建立永生细胞株的方法规范[8];连续培养传代过程中染色体稳定;细胞建系和培养成本较低;重要的是可获得取之不尽的细胞遗传资源用于遗传性疾病的研究[9]。
本研究采用经肝素抗凝的脆性 X 综合征各突变类型的外周全血样本,通过反复研究采用了(1 ~ 5)× 105个/ml 低密度接种转化细胞,减少了 T、B 细胞的接触机会;加入环孢素 A(终浓度 1 μg/ml)抑制了 T 细胞活性,最终成功建立了脆性 X 综合征各类型样本的外周血永生化细胞系,且成功进行了传代、冻存和复苏。同时对建系成功的永生化细胞株进行了可精确读取 CGG 重复数量的荧光 PCR-毛细管电泳和脆性 X 检测经典方法的 Southern blot 法验证,结果表明脆性 X 基因组 DNA 遗传稳定,可作为宝贵的样本资源,为检测试剂盒生产企业和科研机构相关标准物质的研制及后续的脆性 X 综合征临床检验与疾病控制奠定坚实的基础。
[1] Garber KB, Visootsak J, Warren ST. Fragile X syndrome. Eur J Hum Genet, 2008, 16(6):666-672.
[2] Monaghan KG, Lyon E, Spector EB, et al. ACMG Standards and Guidelines for fragile X testing: a revision to the disease-specific supplements to the Standards and Guidelines for Clinical Genetics Laboratories of the American College of Medical Genetics and Genomics. Genet Med, 2013, 15(7):575-586.
[3] Li Y, Jin P. RNA-mediated neurodegeneration in fragile X-associated tremor/ataxia syndrome. Brain Res, 2012, 1462:112-117.
[4] Yu L, Duan RH. Screening for fragile X syndrome in people with mental retardation and autism. Chin J Med Genet, 2015, 32(4):593- 596. (in Chinese)
于莉, 段然惠. 智力低下和孤独症等人群中脆性X综合征的筛查. 中华医学遗传学杂志, 2015, 32(4):593-596.
[5] Huang W, Luo S, Ou J, et al. Correlation between FMR1 expression and and clinical phenotype in discordant discordant dichorionic-diamniotic monozygotic twin sisters with the fragile X mutation. J Med Genet, 2014, 51(3):159-164.
[6] Wang DJ, Li ND, Han RF. Establishment of immortalized cell lines for genetic eye diseases. Recent Adv Ophthalmol, 2014, 34(12): 1114-1117. (in Chinese)
王冬杰, 李宁东, 韩瑞芳. 遗传眼病永生化细胞系建立方法. 眼科新进展, 2014, 34(12):1114-1117.
[7] Zhao XH, Qian YM. Biobank -- the foundation of personalized medicine. Translational Med J, 2014, 3(2):69-73, 83. (in Chinese)
赵晓航, 钱阳明. 生物样本库——个体化医学的基础. 转化医学杂志, 2014, 3(2):69-73, 83.
[8] Hagerman R, Hoem G, Hagerman P. Fragile X and autism: intertwined at the molecular level leading to targeted treatments. Mol Autism, 2010, 1(1):12.
[9] Chen DP, Zeng SF, Zhang SZ. Study on X chromosome fragile site and FMR1 gene mutation in children with metal retardation. Chin J Birth Health Hered, 2014, 22(1):32, 132. (in Chinese)
陈冬萍, 曾素芬, 张素贞. 智力低下儿童X染色体脆性位点及FMR1基因突变的研究. 中国优生与遗传杂志, 2014, 22(1):32, 132.
*同为第一作者
10.3969/j.issn.1673-713X.2019.05.015
中国食品药品检定研究院中青年发展研究基金(2017C1)
黄杰,Email:jhuang5522@126.com;夏昆,Email:xiakun@ sklmg.edu.cn
2019-08-13

