冷冻保存时长对卵裂期胚胎组蛋白表观遗传修饰的影响
马家璇,蔡 炳,徐艳文,周灿权
(中山大学附属第一医院生殖医学中心,广东 广州 510080)
胚胎冷冻保存技术从上世纪80年代开始迅速发展,成为辅助生殖技术的一个重要组成部分。胚胎冷冻可以给新鲜周期移植失败的以及因各种原因不能进行新鲜胚胎移植的不孕患者或因医学原因需要进行生育力保存者提供技术保证。病人经过新鲜周期移植后有剩余的优质胚胎可以冷冻保存,从一次促排卵治疗周期中获得了多次胚胎移植机会,从而减少了患者促排药物的使用及取卵手术的次数,提高了人卵母细胞和胚胎的利用率[1]。然而,对于胚胎冷冻保存的安全性一直存在争议[2-3]。如 Mozdarani[4]发现小鼠的胚胎经过6个月冷冻后活力下降且出现染色体异常。有的研究[5]则提出相反意见,显示慢速冷冻保存时长对胚胎复苏率和妊娠率没有影响。考虑到胚胎早期发育时期正是表观遗传调控的关键时期,且目前已有多篇研究报道将体外胚胎发育受到的干扰与表观遗传学的影响进行了相关性研究[6-7],有线索提示胚胎冷冻保存时其所处环境的剧烈变化有可能导致表观遗传修饰出现异常[8],我们非常关注不同胚胎冷冻保存时长是否会影响到其表观遗传修饰。尽管我国胚胎冷冻保存技术已有20多年的历史,既往也以使用慢速冷冻技术为主,然而仍未见针对慢速冷冻时长对人类正常胚胎的单细胞表观遗传影响的研究资料。随着生育需求的普遍增加,大批冷冻时长在10年以上的胚胎逐渐被解冻移植[9],从技术的安全性出发,我们认为有必要开展对保存时长的潜在影响加以研究。本研究使用本生殖中心患者捐献的不同冷冻保存时长的人类卵裂期胚胎,旨在探讨慢速冷冻保存时长对表观遗传修饰调控中几种具有代表性的核心修饰酶的蛋白和mRNA水平的影响,填补该研究领域的空白。
1 材料与方法
1.1 实验对象
本研究通过中山大学附属第一医院伦理委员会审核(批件号:伦审[2018]030号),患者签署了捐献卵裂期胚胎作为科学研究的知情同意书。本研究采用的胚胎冷冻保存时长分别为6、9和12年,以新鲜胚胎为对照组,共4组,每组选取来自3位患者、每患者2枚胚胎,即每组共6枚胚胎,每组组内胚胎冷冻保存时间相差小于2个月,所有胚胎冻融前后经形态学评估均为优质胚胎(8细胞,细胞均匀,排列紧密,碎片少于20%),胚胎解冻后卵裂球全部存活。研究中涉及的患者的年龄在28到35岁之间,女方不存在单纯输卵管或盆腔因素以外的不孕原因且均为接受卵胞浆内单精子显微注射技术的患者。
1.2 主要材料
蔗糖Sucrose(美国SIGMA-ALDRICH公司),1%BSA的PBS液(美国GIBCO公司),Triton X-100(美国SIGMA-ALDRICH公司),抗组蛋白[Anti-Histone H3(acetyl K9)antibody]H3K9Ac抗 体(1∶100;英国Abcam公司)、抗去乙酰化酶(Antideacetylase HDAC 1antibody)HDAC1抗体(1∶200;英国Abcam公司)、抗组蛋白[Anti-Histone H3(tri methyl K9)antibody]H3K9me3抗体(1∶200;英国Abcam公司)、抗组蛋白[Anti-Histone∶H3(tri methyl K4)antibody]H3K4me3抗体(1∶200;英国Abcam公司),抗兔二抗Alexa Fluor 488(美国Thermo Fisher公司),甲基化酶SUV39H1Taqman引物探针(美国ABI公司),甲基化酶SETDB1 Taqman引物探针(美国ABI公司),去甲基化酶KDM5ATaqman引物探针(美国ABI公司),内参基因GADPH的Taqman引物探针(美国ABI公司),1×TE Buffer(美国ABI公司),单细胞qPCR试剂盒TaqMan Gene Expression Single Cell-to-CT(美国life technology公司)。
1.3 实验方法
1.3.1 慢速冷冻胚胎解冻胚胎的冷冻方法 使用程序化冷冻仪进行慢速冷冻,参照本中心既往发表的文章中的方法学描述[10]。解冻时从液氮中取出冷冻胚胎麦管,25℃静置30 s后,将麦管迅速放入30℃水浴中30 s后取出,剪开麦管,用拉细的巴氏管在体视显微镜下迅速找到胚胎,放入胚胎系列解冻液0.5 mol/L Sucrose10 min,0.2 mol/L Sucrose 10 min,0.1 mol/L Sucrose 10 min,HEPES缓冲液10 min,后转移至vitrolife G系列培养液的囊胚胚胎液G2,置于COOK三气培养箱培养(体积分数为5%氧气、6%二氧化碳、37℃),培养2 h后进行胚胎质量形态学评分。每组随机选择3个胚胎用于免疫荧光染色,另外3个用于实时荧光定量PCR。
1.3.2 免疫荧光染色观察解冻后的胚胎 使用定量移液枪在胚胎培养皿(Falcon,3002)上制备50 μL左右的试剂微滴,用管口直径200 μm左右的巴斯德吸管在各滴间进行胚胎转移。首先将胚胎用含10 g/L BSA的PBS液洗涤3次,每次3 min,0.2%Triton X-100室温通透 20~30 min,含 1%BSA 的PBS液洗涤3次,每次3 min,使用山羊血清作为封闭液室温封闭1 h,用10%山羊血清液稀释的抗组蛋白H3K9ac抗体(1∶100)、抗去乙酰化酶HDAC1抗体(1∶200)、抗组蛋白H3K9me3抗体(1∶200)、抗组蛋白H3K4me3抗体(1∶200),4℃孵育过夜,第2天用含1%BSA的PBS洗涤标本3次,每次3 min,用10%山羊血清液稀释的二抗Alexa Fluor 488(1∶1 000)室温避光孵育1 h,用含1%BSA的PBS洗涤3次,每次5 min,最后将洗涤完的标本转移至载玻片上并使用盖玻片和中性树脂封片。在莱卡DMI8荧光显微镜下观察结果并完成拍照,并用OLYMPUS FLUOVIEW 1.7 Viewer图像处理软件进行图像分析。结果以每一种特异性抗体蛋白(H3K9ac、HDAC1、H3K4me3、H3K9me3)的荧光强度除以细胞核DNA的DAPI荧光强度的百分比来表示。使用3pn异常受精胚胎作为阴性对照:将封闭液代替一抗孵育过夜,其他染色步骤相同。
1.3.3 单细胞RT-qPCR检测 取200 μL的无酶EP管里加入TaqMan Gene Expression Single Cellto-CT Kit中的9 μL Single Cell Lysis Solution,置于冰上。使用巴斯德吸管将收集到的新鲜胚胎、解冻的6、9和12年的胚胎转入EP管里,后加入1 μL Single Cell DNase I,室温孵育5 min。最后加入1 μL Stop Solution,在室温孵育2 min。
逆转录及预扩增过程:把TaqMan Gene Expression Single Cell-to-CT Kit中的Single Cell VILO RT Mix 3.0 μL与Single Cell SuperScript RT 1.5 μL和细胞裂解液11 μL混匀,得到15.5 μL反应体系,在基因扩增仪上反应25℃10 min,在42℃60 min,在85 ℃ 5 min。预扩增反应用1×TE Buffer,pH 8.0稀释目标引物,直到浓度为0.2X。加入TaqMan Gene Expression Single Cell-to-CT Kit中的11 μL 的 PreAmp Mix/pooled TaqManassays,进行热循环。1个热循环条件如下:在95℃中加热10 min,然后60℃加热4 min,最后99℃加热10 min,后面两步重复14个循环。
单细胞qPCR过程:把反应体系在ABI 7500定量PCR仪上行PCR。扩增条件如下:50℃中反应2 min,然后95 ℃ 10 min,60 ℃ 1 min,最后两步进行40个循环。记录各组标本CT值,导出各组在不同目的基因的相对定量数据,统计方差大小,在Excel中绘制柱形图。
1.4 统计学处理
应用SPSS 20.0软件进行统计分析。计量资料用均数±标准差(X±S)或中位数P50(P25~P75)描述,对实验数据进行正态性检验和方差齐性检验,当数据不符合正态分布及方差齐性时,则多组计量资料的比较采用完全随机设计多个样本比较的秩和检验即Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
2 结果
2.1 免疫荧光检测不同冷冻时长胚胎H3K9ac、HDAC1、H3K9me3和H3K4me3的差异
在平行实验条件下,用免疫荧光法检测不同慢速冷冻时长卵裂期胚胎的组蛋白H3K9ac、去乙酰化酶HDAC1、组蛋白H3K9me3和组蛋白H3K4me3表达情况。用Image J分析H3K9ac、HDAC1、H3K9me3和H3K4me3在4组之间的灰度,结果提示没有显著差异(图1~4)。
2.2 不同冷冻时长胚胎的SUV39H1、SETDB1和KDM5AmRNA表达量的差异

图1 新鲜胚胎、慢速冷冻6、9和12年胚胎组蛋白H3K9ac水平Fig.1 The intensity of immunofluorescence of H3K9ac in fresh group,6,9 and 12-year groups

图2 新鲜胚胎、慢速冷冻6、9和12年胚胎去乙酰化酶HDAC1水平Fig.2 The intensity of immunofluorescence of HDAC1 in fresh group,6,9 and 12-year groups
在平行实验条件下,用单细胞RT-qPCR技术检测不同慢速冷冻时长卵裂期胚胎的甲基化酶SUV39H1、甲基化酶SETDB1和去甲基化酶KDM5A的表达情况(图5)。甲基化酶SUV39H1对应mRNA的表达量:新鲜组为0.96(0.70~1.49),6年组为 0.54(0.51~0.94),9年组为 0.22(0.14~0.92),12年组为1.40(0.71~1.65),4组之间比较没有统计学差异(H=5.462,P>0.05)。甲基化酶SETDB1对应mRNA的表达量:新鲜组为1.01(0.88~1.13),6年组为0.77(0.42~4.64),9年组为 4.18(0.71~5.42),12年组为 4.69(1.16~6.19),4组之间比较没有统计学差异(H=3.974,P>0.05)。去甲基化酶KDM5A对应mRNA的表达量:新鲜组为0.84(0.76~1.58),6年组为1.03(0.02~3.40),9年组为7.67(2.75~9.65),12年组为9.88(8.00~10.45),4组之间比较有统计差异(H=8.282,P<0.05),去甲基化酶KDM5A表达水平在4组之间呈递增趋势。
3 讨论
过往有理论模型推测胚胎在-196℃的冷冻状态下是非常稳定的,但现实中会有一些人为因素导致储存条件出现变动,如多年来反复打开液氮罐取胚胎会影起液氮含量的波动,冷冻时间越长越可能经历更多的温度波动。有针对冷冻时长对人卵细胞的影响的基础研究[11-12],认为冷冻时长对卵子和卵子形成的胚胎无不利影响。其研究样本为卵子而非胚胎,因此本研究观察了不同的冷冻保存时长对人类卵裂期胚胎的组蛋白表观遗传修饰的影响。

图3 新鲜胚胎、慢速冷冻6、9和12年胚胎组蛋白H3K9me3水平Fig.3 The intensity of immunofluorescence of H3K9me3 in fresh group,6,9 and 12-year groups
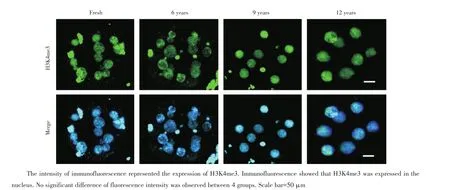
图4 新鲜胚胎、慢速冷冻6、9和12年胚胎组蛋白H3K4me3水平Fig.4 The intensity of immunofluorescence of H3K4me3 in fresh group,6,9 and 12-year groups
组蛋白H3K9和H3K4的甲基化程度由甲基化酶和去甲基化酶调节,胚胎植入前阶段的甲基化修饰对外界各种影响因素敏感。尽管过去研究曾对组蛋白H3K4me3、组蛋白H3K9me3的功能和调控进行了研究,但目前没有研究说明长期慢速冷冻保存对人胚胎组蛋白H3K4me3、组蛋白H3K9me3模式的影响。本研究通过免疫荧光技术比较了核心组蛋白H3K4me3和H3K9me3在不同慢速冷冻时长卵裂期胚胎的表达量,结果显示无统计学差异。

图5 冷冻保存时长对卵裂期胚胎甲基化酶、去甲基化酶KDM5A的影响Fig.5 The effect of long-time slow-frozen storage on methylase,demethylase KDM5A in cleavage-stage embryos
SETDB1是常染色质主要的组蛋白H3K9甲基转移酶,在常染色质区催化组蛋白H3K9的单甲基化(H3K9me)、双甲基化(H3K9me2),而组蛋白H3K9甲基化与基因沉默有关[13],因此甲基化酶SETDB1起到抑制转录的作用。有学者[14]对牛胚胎早期发育过程的甲基化酶SETDB1进行抑制,导致组蛋白H3K9me和组蛋白H3K9me2减少,转录增强子被激活。因此组蛋白H3K9me3被认为是形成异染色质的主要决定因素,而SUV39家族被认为是催化组蛋白H3K9三甲基化(H3K9me3)形成异染色质的主要决定因素,因此SUV39家族起到抑制转录的作用[15]。本研究中甲基化酶SETDB1的mRNA水平在4组之间虽然没有统计学差异,但是仍可看出随着冷冻时间增加有上升的趋势。SETDB1是H3K9的甲基化酶,其增加会导致组蛋白H3K9me1、组蛋白H3K9me2的增加,起到抑制转录作用[16]。由于6、9和12年冷冻时长组中甲基化酶SETDB1有增高趋势,因此H3K9甲基化可能也随着冷冻时长增加而积累更多,造成胚胎发育效率低下。
具有JmjC结构域的组蛋白去甲基化酶家族则可催化组蛋白赖氨酸三甲基(me3)发生去甲基化修饰,KDM5A即是其中一员,是组蛋白H3K4me3的去甲基化酶,由于组蛋白H3K4me3被认为是活性转录的标记,通常富集在启动子,它在转录重编程中起着重要的作用[17],而去甲基化酶KDM5A可以使组蛋白H3K4me1、组蛋白H3K4me2、组蛋白H3K4me3去甲基化,因此去甲基化酶KDM5A也起到抑制转录作用[18]。KDM5A的表达水平随着冷冻时间增加而增加。这与一些学者观察到慢速冷冻后的胚胎组蛋白H3K4me3等转录激活基因表达下降,而一些起抑制作用的组蛋白如H3K27、H3K9me3等则增加的研究结果相符[19]。因此本研究结果提示随着冷冻时间增加,胚胎的转录抑制作用增加,可能阻碍胚胎的早期发育。
本研究采用免疫荧光的方法检测了新鲜组、慢速冷冻6、9和12年组的组蛋白H3K9ac与去乙酰化酶HDAC1。组蛋白H3K9ac大量存在于一些大的启动子附近,可以通过募集或者激活相关染色体修饰的复合体从而激活基因转录。HDAC1是主要的去乙酰化酶,可以使组蛋白H3K9ac去乙酰化,从而导致转录抑制状态[20]。使用Image J分析4组之间免疫荧光的灰度没有显著差异。同时我们用qPCR测4组各自去乙酰化酶HDAC1对应的mRNA表达量,得出结果4组去乙酰化酶HDAC1对应的mRNA表达量无显著差异,这个结果提示慢速冷冻胚胎解冻后与新鲜胚胎相比,去乙酰化酶HDAC1以及组蛋白H3K9ac没有受到影响。该结果与另外一些学者得出的研究结果不同[21],这有可能是由于研究的胚胎来源物种不同,以及解冻的方法或者冷冻操作过程与其不一样导致。实验结果还显示冷冻时长6、9和12年这3个实验组之间的结果也相近,提示慢速冷冻时长在成功复苏的优质胚胎的组蛋白乙酰化修饰上的影响并不显著。
总之,去甲基化酶KDM5A表达水平在3个冷冻时长组中随着冷冻时间增加而增加,明显起到抑制转录作用。因此本研究结果提示随着冷冻时间增加,胚胎的转录抑制作用增加,可能阻碍胚胎早期发育。同时甲基化酶SETDB1也是随着冷冻时间增加,虽然没有统计学差异,但仍可看出有上升趋势,甲基化酶SETDB1可以使组蛋白H3K9me3积累,这个也可能会造成胚胎发育效率受到影响。本研究结果提示我们需要重视胚胎长时间冷冻保存可能存在的问题,因此临床上利用过长时间保存的胚胎时应特别重视其安全性以及子代的健康。但是由于本研究的样本量较少,其结论仍需要更多研究证据进一步加以证实,进一步的深入研究是很有必要的。

