脊髓CCL2在瑞芬太尼诱导的大鼠痛觉过敏中的作用机制
王晓娥,李 琪,肖 力,李紫霖,崔 宇,陈 元,陈 宇
(中山大学1.附属第一医院麻醉科,2.中山医学院神经生物研究中心,广东广州510080)
瑞芬太尼作为一种强效的阿片类受体激动剂,由于其起效和消除作用迅速,几乎无术后恢复延迟和呼吸抑制的风险,现已广泛应用于全身麻醉的诱导和维持。然而,大量的临床观察发现,瑞芬太尼和其他阿片类药物一样,在发挥其强大镇痛作用的同时也可产生痛觉过敏(remifentanilinduced hyperalgesia,RIH),通常指瑞芬太尼给药后观察到的疼痛刺激超敏现象[1]。虽然近几十年来,人们对阿片类药物诱发的痛觉过敏(opioidinduced hyperalgesia,OIH)机制的研究取得了一系列新的进展,但瑞芬太尼诱导的痛觉过敏的具体机制仍不清楚[2]。趋化因子配体2(C-C motif chemokine ligand 2,CCL2),也称为单核细胞趋化蛋白 1(monocyte chemotactic protein-1,MCP-1)[3-4],是趋化因子家族中的一员,在正常神经组织表达极少[5],而在机体发生炎症反应或神经损伤时被激活,有招募巨噬细胞和小胶质细胞的作用[6]。CCL2激活小胶质细胞参与紫杉醇诱发的痛觉过敏[7]以及骨癌痛的病理生理过程[8]。然而 CCL2是否通过招募和激活小胶质细胞参与瑞芬太尼诱导的痛觉过敏尚未见报道。本研究拟观察瑞芬太尼诱导的痛觉过敏大鼠脊髓CCL2的表达变化,并通过预先鞘内注射特异性CCL2中和抗体,观察其对瑞芬太尼导致的痛觉过敏大鼠脊髓小胶质细胞激活的影响和行为学的改变,明确CCL2在瑞芬太尼诱发的痛觉过敏中的作用。
1 材料与方法
1.1 实验动物和分组
成年雄性SD大鼠,体质量200~280 g,由中山大学北校区实验动物中心(国家级动物实验中心)提供。于12 h光照-黑暗循环、安静环境下单笼饲养,自由饮水摄食。室温(22.0±0.5)℃,湿度55%±10%。所有实验操作均符合中山大学动物实验中心动物伦理要求并按照实验动物使用原则进行。36只实验大鼠随机分成6组,每组6只,生理盐水对照组(S),瑞芬太尼组(R),生理盐水+鞘内注射磷酸盐缓冲液(phosphate buffer saline,PBS)组(S+V),瑞芬太尼+鞘内注射PBS组(R+V),生理盐水+鞘内注射CCL2中和抗体组(S+anti-CCL2),瑞芬太尼+鞘内注射CCL2中和抗体组(R+anti-CCL2)。S组:经尾静脉持续输注生理盐水2 h。R组:经尾静脉持续输注瑞芬太尼4 μg/(kg·min)2 h。S+V组:单次鞘内注射PBS 10 μL,30 min后经尾静脉持续输注生理盐水2 h。R+V组:单次鞘内注射PBS 10 μL,30 min后经尾静脉持续输注瑞芬太尼4 μg/(kg·min)2 h。S+anti-CCL2组:单次鞘内注射CCL2中和抗体5 μg/10 μL,30 min后经尾静脉持续输注生理盐水2 h。R+anti-CCL2组:单次鞘内注射CCL2中和抗体5 μg/10 μL,30 min后经尾静脉持续输注瑞芬太尼4 μg/(kg·min)2 h。
1.2 建立瑞芬太尼痛觉过敏模型
用生理盐水稀释瑞芬太尼(宜昌人福药业有限责任公司,中国)到终浓度40 μg/mL备用。大鼠吸入七氟烷(丸石制药株式会社,日本)入睡后,尾静脉穿刺置入24 G静脉留置针,连接电子注射泵(ALARIS Asena PK,英国),按分组持续泵注瑞芬太尼4 μg/(kg·min)2 h,生理盐水组以相同速率泵注生理盐水。术中大鼠面罩给氧,维持自主呼吸。
1.3 鞘内注射
S+V组、R+V组、S+anti-CCL2组和R+anti-CCL2 组大鼠吸入七氟烷麻醉后,参照 Mestre[9]描述的方法将大鼠俯卧,定位脊柱L4-L5间隙,备皮,消毒,以微量注射器从椎间隙垂直缓慢进针,尾巴突然出现颤动或甩动,标志成功穿入鞘内,此时保持穿刺针位置不变并缓慢注入PBS或CCL2中和抗体。
1.4 行为学测试
实验前于行为学实验室分笼放置大鼠3 d,每天2 h,以适应测试环境。药物输注前1 d测试大鼠基础痛阈值,输注结束后第6小时和第1、3、5天为行为学测试时间点。采用电子von Frey测痛仪(Almemo 2450,Anesthesiometer IITC)行机械性疼痛阈值(paw withdrawal mechanical threshold,PWMT,以g为单位)测试[10-11]。大鼠在测试环境中适应30 min,处于安静状态,用尖端直径约0.2 mm的圆柱形聚乙烯(PE)小针,对大鼠右后足底正中部垂直进行机械性刺激,并逐渐增加机械性刺激的压力,如大鼠出现快速撤足反应或舔舐刺激右足则为阳性反应,记录引起撤足时的压力值。每只大鼠测试3次,每次间隔5 min,取3次平均值为该实验点的机械痛阈值。为避免对动物造成机械性伤害,最大机械刺激压力设置为60 g。使用热辐射刺激仪(SERIES 8 Model 390G IITC Life Science,美国)进行热痛阈值(paw withdrawal thermal latency,PWTL,以s为单位)测试。设置热辐射仪参数:光强为30 V,基础光强为5 V,自动断电时间为15 s。大鼠在测试环境中适应30 min,处于安静状态,以热辐射源照射大鼠右侧后足底正中处,记录从热辐射刺激开始至大鼠出现反射性撤足的时间。每只大鼠重复测量3次,每次间隔5 min,取3次平均值为该实验点的热痛阈值。
1.5 免疫荧光实验
各组大鼠分别于瑞芬太尼输注后第6小时和1、3、5天腹腔注射水合氯醛溶液(1 g/10 mL)深度麻醉,迅速行升主动脉插管并剪开右心耳,快速灌注冷生理盐水约200 mL,待右心耳流出的液体由红色转为无色透明时,改用4℃多聚甲醛溶液(40 g/L)400 mL灌注固定。取出L4-L5腰膨大部位脊髓段置于预冷的多聚甲醛溶液中后固定4 h,转入4℃蔗糖溶液(30 g/100 mL)中脱水72 h,放置沉底。组织用OCT包埋后行冰冻切片,片厚25 μm,收集于0.01 mol/L PBS内。组织切片用PBS清洗3次,每次5 min。室温下用山羊血清封闭1 h后加入混合一抗:抗CCL2兔多克隆抗体(1∶200,abcam,美国)和抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)小鼠单克隆抗体(astrocyte marker,1∶400,Cell Signaling Technology,美国)、抗神经元核抗原(neuronal nuclear antigen,NeuN)小鼠单克隆抗体(neuronal marker,1∶800,abcam,美国)、抗Ⅲ型补体受体(OX-42)小鼠单克隆抗体(microglia marker,1∶400,Millipore,美国),4℃孵育过夜。次日用PBS洗涤3遍后,用相应青色素荧光染料(Cy3)标记IgG和异硫氰酸荧光素(FITC)标记 IgG(1∶200,Jackson ImmunoResearch,美国)二抗于室温下避光孵育1 h,再次用PBS清洗3遍。随机挑选切片贴于载玻片上,于荧光显微镜(OLYMPUS BX51WI)下观察并拍照。采用Image J软件分析免疫荧光图像,求得CCL2平均荧光密度。
1.6 Western blot实验
各组大鼠分别于瑞芬太尼输注后第6小时和1、3、5天腹腔注射水合氯醛溶液(1 g/10 mL)深度麻醉,迅速取大鼠L4-L5腰膨大部位脊髓段置于液氮中保存备用。取脊髓组织称重,每100 mg组织加入1 mL蛋白裂解液(凯基,中国),低温匀浆,超声破碎,4℃ 12 000 r/min离心30 min(r=5 cm),吸取上清液即为组织蛋白溶液。取10 μL蛋白样品采用BCA蛋白质浓度测定试剂盒测定标本蛋白浓度。吸取等量蛋白样品加入上样缓冲液100℃煮样10 min。用聚丙烯酰胺凝胶电泳分离目的蛋白并转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。PVDF膜在5%脱脂奶粉溶液中,室温下封闭1 h之后,用抗CCL2兔多克隆抗体(1∶1 000,abcam,美国)或抗离子钙结合接头分子1(ionized calcium binding adapter molecule 1,Iba1)兔多克隆抗体(microglia marker,1∶400,abcam,美国),4℃下孵育过夜。次日TBST缓冲液清洗3次后用羊抗兔辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶5 000,Cell Signaling Technology,美国)室温孵育2 h。TBST缓冲液再次清洗3次后至暗房曝光,滴加ECL发光液(Thermo,美国),使用化学发光成像系统LAS-4000(GE公司,美国)曝光。结果使用Image J软件对图像进行灰度分析,以目标蛋白条带灰度值与甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)条带灰度值的比值反应指标蛋白的表达水平。
1.7 统计学分析
使用SPSS 22.0统计分析软件进行统计分析,实验结果以均数±标准差表示。行为学检测结果痛阈值比较采用连续性重复测量方差分析,若组别和时间存在交互效应,进一步检验组间和时间点的单独效应,差异有统计学意义时均采用Bonferroni法进行多重比较。各组大鼠CCL2平均荧光密度和蛋白印迹相对灰度的结果以单因素方差分析比较。P<0.05表示差异有统计学意义。
2 结果
2.1 静脉输注瑞芬太尼诱导大鼠痛觉过敏
瑞芬太尼组与生理盐水组大鼠的行为学结果进行重复测量方差分析显示:热痛阈值和机械痛阈值数据均满足球形分布(χ2=3.3,P=0.92;χ2=13.42,P=0.15),各组间差异有统计学意义(F=84.60,P < 0.001;F=87.76,P < 0.001),各组时间点差异有统计学意义(F=15.69,P<0.001;F=16.44,P<0.001),且分组和时间点有交互效应(F=15.33,P < 0.001;F=10.89,P < 0.001)。采用多重比较方差分析比较各组相同时间点机械痛阈值和热痛阈值的差异,结果表明各组基础痛觉阈值无统计学差异(F=0.89,P=0.37),而静脉注射瑞芬太尼后,大鼠的热痛觉阈值和机械痛觉阈值均显著下降,并在第1天达到最低[PWTL=(5.48±0.35)s,F=81.44,P <0.001 vs.生理盐水组;PWMT=(33.70± 1.62)g,F=69.73,P < 0.001 vs.生理盐水组],且于第5天恢复至对照水平(P>0.05,图1)。

图1 静脉输注瑞芬太尼降低大鼠热痛阈值和机械痛阈值Fig.1 Intravenous infusion of remifentanil reduces PWTL and PWMT in rats
2.2 静脉输注瑞芬太尼导致脊髓背角神经元以及小胶质细胞CCL2表达增加
我们进一步探究静脉输注瑞芬太尼对大鼠脊髓CCL2蛋白表达水平的影响。对各组CCL2蛋白印迹相对灰度值(RD)进行单因素方差分析结果显示差异有统计学意义(F=11.32,P <0.001),多重比较结果显示瑞芬太尼输注后1 d大鼠脊髓CCL2蛋白表达最高(RD=0.66±0.07,P<0.001 vs.生理盐水组),5 d基本恢复至对照水平(P=0.77,图2)。与蛋白印迹结果一致的是,各组CCL2免疫荧光平均光密度(ID)的单因素方差分析结果显示差异有统计学意义(F=29.33,P<0.001),静脉输注瑞芬太尼后导致脊髓背角CCL2免疫荧光密度显著增强,1 d达到峰值(ID=0.170±0.009,P<0.001 vs.生理盐水组),5 d基本恢复至盐水组水平(P=0.24,图3 A-F)。免疫荧光双染结果显示,CCL2主要与神经元共染,还有一小部分与小胶质细胞共染(图3 G)。以上结果表明,瑞芬太尼可诱导脊髓背角神经元以及小胶质细胞中CCL2的表达增加。
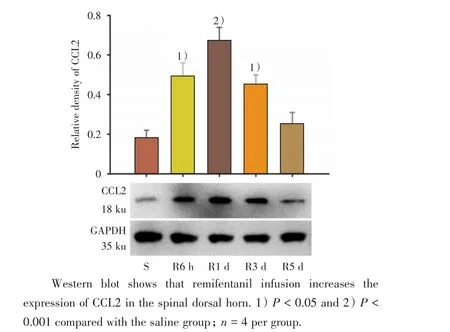
图2 静脉输注瑞芬太尼增加大鼠脊髓CCL2的表达Fig.2 Remifentanil infusion increases the expression of CCL2 in the spinal cord

图3 静脉输注瑞芬太尼增强脊髓背角神经元以及小胶质细胞CCL2的免疫活性Fig.3 Remifentanil infusion increases CCL2 immunoreactivity of neuron and microglia in spinal dorsal horn
2.3 鞘内注射CCL2中和抗体减轻瑞芬太尼诱导的痛觉过敏
S+V组、S+anti-CCL2组、R+V组和R+anti-CCL2组大鼠行为学结果进行重复测量方差分析,热痛阈值和机械痛阈值数据均满足球形分布(χ2=14.70,P=0.10;χ2=11.10,P=0.27),各组间差异有统计学意义(F=58.83,P<0.001;F=63.54,P<0.001),各组时间点差异有统计学意义(F=23.80,P < 0.001;F=13.78,P < 0.001),且分组和时间点有交互效应(F=12.54,P<0.001;F=5.43,P<0.001)。鞘内注射CCL2中和抗体或PBS不影响静脉注射生理盐水大鼠的基础痛阈值(P >0.05),然而,相比R+V组,R+anti-CCL2组大鼠热痛和机械痛过敏被显著抑制,分别在6 h[PWTL=(9.59±0.35)s,P=0.014 vs.R+V组;PWMT=(45.15 ± 0.34)g,P=0.036 vs.R+V组],1 d[PWTL=(8.44 ± 0.41)s,P=0.008 vs.R+V组;PWMT=(42.31± 1.10)g,P < 0.001 vs.R+V组],3 d[PWTL=(9.49 ± 0.25)s,P=0.002 vs.R+V组;PWMT=(46.82 ± 2.84)g,P=0.046 vs.R+V组]差异有统计学意义(图4 A和B)。

图4 CCL2中和抗体预处理减轻瑞芬太尼诱导的大鼠痛觉过敏Fig.4 Pretreatment of CCL2 neutralizing antibody attenuates hyperalgesia induced by Remifentanil in rats
2.4 鞘内注射CCL2中和抗体抑制瑞芬太尼诱导的小胶质细胞激活。
瑞芬太尼输注后第1天,分别对S+V组、R+V组、R+anti-CCL2组和S+anti-CCL2组大鼠脊髓Iba1的荧光密度进行单因素方差分析结果显示差异有统计学意义(F=45.64,P <0.001):R+V组大鼠脊髓Iba1的平均荧光密度增强(R+V组:ID=0.059±0.005,P<0.001 vs.S+V组),说明瑞芬太尼输注激活大鼠脊髓小胶质细胞,免疫荧光表现为Iba1阳性细胞数量增多,突起减少,胞体增大。鞘内给予CCL2中和抗体可以抑制瑞芬太尼诱导的小胶质细胞激活(R+anti-CCL2组:ID=0.039±0.004,P<0.001 vs.R+V组,图5 A-E)。各组蛋白印迹灰度的单因素方差分析结果也显示差异有统计学意义(F=51.24,P <0.001),且CCL2中和抗体预处理能显著抑制瑞芬太尼所致的Iba1表达增加(R+V组:RD=2.06±0.15,P<0.001 vs.S+V组;R+anti-CCL2组:RD=0.62±0.12,P<0.001 vs.R+V组,图5 F)。
3 讨论
本课题组前期研究证实:连续静脉输注瑞芬太尼可诱发大鼠痛觉过敏[12],且脊髓活性氧(reactive oxygen species,ROS)通过激活小胶质细胞和N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体介导瑞芬太尼诱导的痛觉过敏[11,13]。本实验进一步显示瑞芬太尼的输注可以诱导大鼠脊髓CCL2的表达增加,而且预先鞘内注射CCL2中和抗体不仅可以明显抑制小胶质细胞的激活,且缓解瑞芬太尼诱导的机械痛和热痛觉敏感。本实验研究结果说明瑞芬太尼可通过诱导脊髓神经元和小胶质细胞释放CCL2,激活小胶质细胞诱发痛觉过敏。

图5 CCL2中和抗体预处理抑制瑞芬太尼诱导的脊髓背角小胶质细胞的激活Fig.5 Pretreatment of CCL2 neutralizing antibody prevents the activation of microglia in spinal dorsal horn
阿片类药物是目前临床治疗疼痛最为常用且有效的药物,但是阿片类药物的使用常伴随着痛觉过敏,表现为痛阈下降、痛觉异常敏感甚至出现接触痛[14]。瑞芬太尼作为一种人工合成强效μ阿片受体激动剂,因其起效快,作用时间短,长期输注无蓄积等优点而被广泛应用于临床全麻镇痛,但是近年来临床研究发现瑞芬太尼较其他阿片类药物更易诱发痛觉过敏[15-16]。RIH涉及的分子生物学机制复杂,目前已知瑞芬太尼可以通过μ阿片受体的变异、长时程增强(long-term potentiation,LTP)、NMDA受体的激活和脊髓胶质细胞的活化等介导痛觉过敏,且可能涉及离子通道、信号通路、细胞因子等多方面[17]。本课题组前期的研究建立了静脉输注瑞芬太尼导致大鼠痛觉过敏的模型,发现活化的小胶质细胞在RIH中发挥了重要作用,且瑞芬太尼通过脊髓神经元释放ROS激活NMDA受体导致痛觉过敏[13]。但我们对瑞芬太尼导致痛觉过敏的具体机制仍不清楚。
我们本次研究发现,CCL2是激活瑞芬太尼痛觉过敏大鼠脊髓小胶质细胞的重要因素。CCL2是最早被发现的单核细胞和巨噬细胞趋化因子,通过与趋化因子受体2(C-C motif chemokine receptor 2,CCR2)结合参与机体免疫反应[18]。近年来大量研究发现,CCL2参与中枢神经系统炎症反应和免疫应答[19]。最近的研究表明,脊髓CCL2在神经损伤引起的疼痛中发挥了重要作用,且预先鞘内注射CCL2中和抗体可增强吗啡的镇痛作用[20]。本研究通过免疫荧光和蛋白印迹发现瑞芬太尼诱发的痛觉过敏大鼠脊髓CCL2表达增加,且变化趋势与大鼠行为学痛觉过敏时程变化相吻合。预先鞘内注射特异性CCL2中和抗体后,脊髓CCL2被中和,瑞芬太尼导致的痛觉过敏也明显被抑制。免疫荧光共染结果显示脊髓CCL2主要表达在神经元,少量表达在小胶质细胞,未发现CCL2与星形胶质细胞明显共染。与我们的研究结果不同的是在小鼠神经损伤引起的疼痛模型中,脊髓CCL2在星形胶质细胞[21]或小胶质细胞[22]表达增加,然而在吗啡耐受大鼠脊髓中神经元表达CCL2显著增加[20]。以上研究结果表明,不同的刺激条件可能会导致完全不同的细胞类型表达CCL2,进而通过不同的机制参与神经免疫。例如,在炎性疼痛大鼠模型中发现,CCL2通过激活脊髓神经元CCR2,增强NMDA诱发电流,从而导致痛觉过敏形成[23]。而我们的研究发现预先鞘内注射CCL2中和抗体可明显抑制痛敏大鼠脊髓小胶质细胞的激活,提示CCL2通过激活小胶质细胞介导瑞芬太尼痛觉过敏的过程,且在痛觉过敏中CCL2可能是神经元和小胶质细胞相互作用的媒介。最近的研究显示,在骨肿瘤诱导的疼痛动物模型中,脊髓CCL2通过激活小胶质细胞促进其产生和释放促炎因子如肿瘤坏死因子(tumor necrosis factor-α,TNF-α)[22],而后者已被证实在多种炎症及神经病理性疼痛中发挥着重要作用[24]。因此,脊髓水平的CCL2在瑞芬太尼引起的痛敏中的具体作用和机制有待进一步研究。
综上所述,本研究结果表明脊髓CCL2通过激活小胶质细胞介导瑞芬太尼诱导的痛觉过敏,本研究的结果为RIH的发生机制提供了新的理论基础,同时也为RIH的防治提供了新的科学依据。

