84例阿帕替尼治疗晚期非小细胞肺癌的临床研究
常戈鋆,师文静,陈慧莉,姜飞,董宏伟,古艳婷
航空总医院,北京 100012
肺癌属于一种严重威胁患者生命健康以及生命情况的恶性肿瘤,其发病率和死亡率均位于首位,其中非小细胞肺癌在肺癌中占比高达85%[1]。随着肺癌发病率的升高和治疗后复发,越来越多的患者位于肺癌晚期。靶向治疗和化疗是晚期肺癌的首选治疗,但治疗失败后如何进行二、三线治疗,显得愈发棘手和重要。甲磺酸阿帕替尼(mesylate apatinib,阿帕替尼,艾坦)是我国自主研发的一种新型小分子抗血管生成口服制剂,它通过高度选择性地抑制VEGFR-2酪氨酸激酶的活性,阻断VEGF与其受体结合的信号传导,从而强效抑制肿瘤血管生成,控制肿瘤细胞的生长和转移,促进肿瘤细胞的凋亡。阿帕替尼的Ⅱ期和Ⅲ期临床研究证实了它治疗化疗失败晚期胃癌的显著有效性[2,3],后续研究发现阿帕替尼在治疗肝癌、乳腺癌等恶性实体瘤亦取得了一定的临床获益[4,5]。抗肿瘤血管生成药物贝伐珠单抗和恩度已被证实是治疗肺癌的安全有效药物[6,7]。本文旨在研究阿帕替尼二线及以上治疗晚期非小细胞肺癌的疗效和安全性,并和晚期肺癌的传统化疗方案紫杉醇联合铂类进行对比。
1 资料和方法
1.1 临床资料进行本次研究的是2015年1月至2018年9月在我院住院治疗的84例一线及以上治疗失败的晚期非小细胞肺癌患者。通过随机数字表方法,分为观察组与对照组,每组42例患者。观察组中男性20例,女性22例,平均年龄(56.14±7.21)岁;对照组中男性23例,女性19例,平均年龄(55.17±7.11)岁。两组患者的年龄、性别、ECOG评分和肿瘤类型等均无统计学差异(P>0.05),见表1。入选标准:①病理诊断确诊非小细胞肺癌,按2010年版美国癌症联合委员会(the American joint committee on cancer,AJCC)TNM分期,临床分期IV期;至少有一个可评价病灶。②一线及以上治疗失败,既往未接受过VEGFR-TKI治疗。③无糖尿病史及重要心、肝、肾、骨髓等器官功能障碍,ECOG评分0~2分。④预计生存期>3个月。排除标准:存在其他部位原发恶性肿瘤;对研究药物过敏;妊娠或哺乳期女性。
1.2 方法观察组的42例患者接受甲磺酸阿帕替尼片(艾坦,江苏恒瑞医药股份有限公司产品)500mg口服治疗,每日1次,每28天为1个周期,共四个周期,每2个周期评价疗效。病情进展或患者不能耐受则停用。对照组的42例患者接受紫杉醇联合铂类化疗:紫杉醇(135~175mg/m2,静脉滴注,第1天) ,顺铂(30mg/m2,静脉滴注,第2~4天)或卡铂(300mg/m2,静脉滴注,第2天),21d为1周期,共进行4周期,每2周期评价疗效,病情进展或不能耐受则停用。两组患者不良反应均给予常规对症支持处理。
1.3 观察指标
1.3.1 疗效评价 治疗结束后两组患者均进行影像学复查,按RECIST评价标准进行疗效评价。①完全缓解(complete response,CR):病灶完全消失。②部分缓解(partial response,PR):病灶较前缩小>30%,同时未出现新的肿瘤病灶。③稳定(stable disease,SD):病灶较前缩小<30%或增大<20%,同时未出现新的肿瘤病灶。④进展(progress disease,PD):病灶较前增大>20%或者有新的肿瘤病灶出现。疾病控制率(disease control rate,DCR)为(CR+PR+SD)例数/总患者例数×100%。
1.3.2 毒副作用 根据NCI.CTC4.0版本,对治疗后毒性反应进行分级记录。
1.4 统计学方法采用SPSS 18.0对数据进行统计分析,计量资料以均数±标准差(±S)表示,采用t检验;计数资料以百分率(%)表示,采用χ2/Fisher检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较4周期治疗后,两组患者均无CR患者,观察组PR为19%,SD为47.6%,对照组PR为14.3%,SD为28.6%。观察组的DCR为66.7%,显著高于观察组的40.5%, P<0.05,见表2。

表1 两组患者临床资料的比较(n=82)Tab1 Comparison of clinical data in two groups (n=82)

表2 两组患者临床疗效对比(例/%)Tab2 Comparison of efficiency in two groups (cases/%)
2.2 两组患者的不良反应对比4周期治疗后,观察组未见Ⅳ度不良反应,对照组出现2例IV度骨髓抑制及1例Ⅳ度恶心呕吐,治疗后均好转。观察组的蛋白尿发生率显著高于对照组,除高血压外其他不良反应均低于对照组,其中骨髓抑制、恶心呕吐及高血糖的发生率有显著差异,详情见表3。
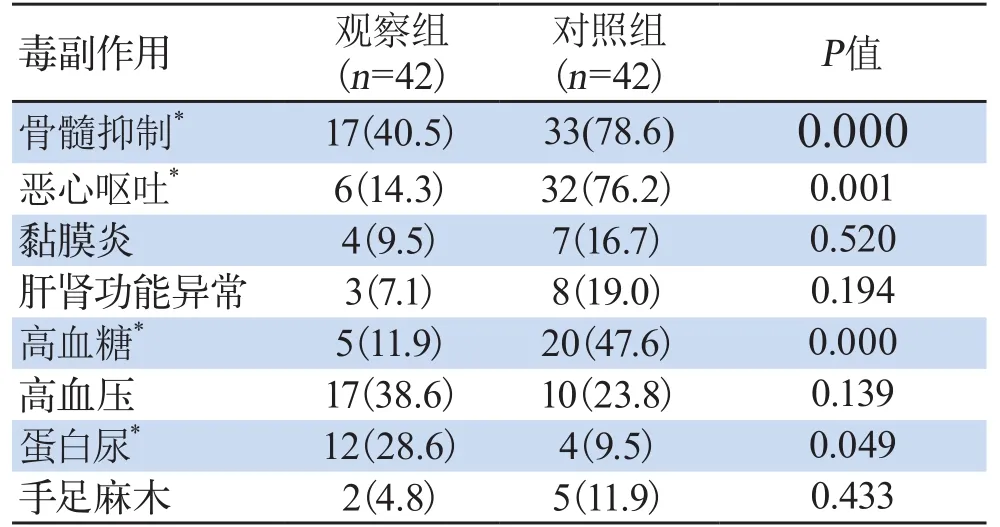
表3 两组患者的不良反应对比(例/%)Tab3 Comparison of adverse reactions in two groups(cases/%)
3 讨论
肺癌在我国的发生率逐年升高,它在男性肿瘤患者的发病率以及死亡率位居第一,女性患者中位居第二[1]。但一二线治疗失败后的安全有效治疗是临床亟待解决的难题。紫杉醇联合铂类是治疗晚期NSCLC的传统有效化疗方案,有效率可高达46.67%[8],但其不良反应如骨髓抑制、恶心呕吐、肝肾毒性、手足麻木等发生率较高,并且紫杉醇可引起过敏反应,如呼吸困难、荨麻疹、低血压等,严重者可出现过敏性休克,治疗前需使用地塞米松预处理。阿帕替尼是一种口服抗肿瘤血管生成药物,2014年被国家食品药品监督管理总局(China Food and Drug Administration,CFDA)批准用于三线及三线以上晚期胃癌或胃食管结合部腺癌的治疗,具有良好的疗效和安全性。后续临床研究发现,阿帕替尼在肝癌和乳腺癌等其他恶性肿瘤的治疗中亦取得了良好的疗效,DCR48.57%~66.7%,中位无进展生存期4~4.2个月[6,7]。对于晚期肺癌患者,一项多中心Ⅱ期临床试验入组了135例化疗及TKI抑制剂治疗失败后的晚期NSCLC患者[9],使用阿帕替尼750mg/d和安慰剂进行对比研究,结果显示,阿帕替尼组的DCR和无进展生存期(PFS)分别为68.9%和4.7个月,显著高于观察组的DCR24.4%和PFS1.9个月,其常见不良反应为高血压和蛋白尿等,但均可耐受。
本次研究中,使用阿帕替尼单药和紫杉醇联合铂类治疗一线以上治疗失败的晚期NSCLC患者,阿帕替尼组的DCR为66.7%,和文献相符,显著高于紫杉醇组的DCR40.5%,并且常见不良反应如骨髓抑制、恶心呕吐、黏膜炎、肝肾功能异常等的发生率均低于对照组,其中骨髓抑制、恶心呕吐、高血糖等的发生率有显著差异。而观察组的高血压和蛋白尿的发生率高于对照组,考虑和阿帕替尼药物本身相关。高血压和蛋白尿是阿帕替尼的常见不良反应,原因考虑和抗血管生成药物抑制一氧化氮(nitric oxide,NO)释放引起血管收缩[10]及增加肾小球滤过膜通透性[11]有关,但均为轻中度,患者可耐受,且研究表明,蛋白尿的发生是疗效良好的预测指标[11]。对照组中高血糖的发生率显著高于观察组,考虑和紫杉醇引发糖代谢障碍[12]及使用地塞米松相关。
综上所述,和紫杉醇联合铂类化疗相比,阿帕替尼是挽救一线以上治疗失败的晚期非小细胞肺癌的有效治疗方案,不良反应发生率低,患者耐受性好,适宜临床推广使用。但本研究还存在不足之处,样本来源单一,样本量小,可能会存在结果偏移,可进一步扩大样本量,延长随访时间,得到更为科学完整的结果。

