芪蝎活血通络汤对大鼠局灶性脑缺血再灌注损伤的神经保护作用及SIRT1、PGC-1表达的影响∗
马 瑞 刘王波 周 平
(湖北省十堰市太和医院,湖北医药学院附属医院,湖北 十堰 442000)
中风是世界上第二大常见死亡原因和导致残疾的主要原因,缺血性卒中的治疗方法仍然是当前脑血管研究的关键领域之一[1-3]。在缺血后的一段时间内,再灌注对缺血性脑造成严重损害,导致严重的脑微循环障碍甚至神经元损伤,这与缺血性卒中后的残疾和死亡率密切相关[4-6]。沉默交配型信息调节2同源物1(SIRT1)是NAD+依赖性酶的Sirtuin家族的关键成员,其与氧化应激反应有关,SIRT1可直接通过磷酸化和去乙酰化的活性影响过氧化物酶体增殖物激活受体-c共激活剂-1(PGC-1)[7-8]。上调PGC-1α可通过减轻氧化应激来减少神经元死亡。多项研究表明,SIRT1、PGC-1信号通路的激活可发挥抗脑局灶性脑缺血再灌注损伤的作用,SIRT1、PGC-1可通过磷酸化后灭活促凋亡蛋白[9]。芪蝎活血通络汤具有活络除湿、化瘀止痛的功效[10],本研究拟探讨芪蝎活血通络汤对大鼠局灶性脑缺血再灌注损伤的神经保护作用及SIRT1、PGC-1表达的影响,为局灶性脑缺血再灌注损伤的治疗提供理论及临床依据。
1 材料与方法
1.1 实验动物 清洁级SD大鼠100只,8周龄;体质量280~300 g;河北省实验动物中心(证书号907048)提供,大鼠圈养在环境控制的繁殖室(温度22~24℃;湿度50%~55%;12 h黑暗/12 h光照循环)中,自由获取标准实验室食物和水。
1.2 试药与仪器 芪蝎活血通络汤组方为:黄芪120 g,全蝎20 g,川芎、当归、赤芍、桃仁及地龙各15 g,鸡血藤及丹参各30 g,红花及甘草各10 g。水煎300 mL,浓缩至50 mL。根据成人与大鼠剂量公式换算,以10.0 mL/kg体质量灌胃,将药液配制成为10.0 g/mL。TRIzol Reagent(Invitrogen,Carlsbad,CA,USA);大鼠 SIRT1(#Rn00567167_mL),大鼠PGC-1(#Rn00492539_mL),大鼠甘油醛-3-磷酸脱氢酶(GAPDH)(#Rn01775763_g1)的TaqMan基因表达分析购自Applied Biosystems(Foster City,CA,USA)。兔多克隆抗 SIRT1、PGC-1抗体(抗 SIRT1;目录号BA0565-1;抗PGC-1;目录号BA0890;1∶50,来自武汉博士特生物技术有限公司);多克隆山羊抗兔IgG/链霉抗生物素蛋白抗体;Ori-Gene Technologies,Inc,Beijing,China;SIRT1、PGC-13试剂盒(SIRT1目录号SXM026、PGC-13目录号SX01165,上海森雄生物科技产业有限公司);二氨基联苯胺试剂盒(DAB,目录号AR1022,武汉博士德生物技术有限公司)。分光光度计SmartSpec 3000(Bio-Rad,Hercules,CA,USA)。
1.3 造模与分组 根据体质量随机分成5组:对照组、模型组、芪蝎活血通络汤低剂量组(2.0 mg/kg)、芪蝎活血通络汤中剂量组(4.0 mg/kg)、芪蝎活血通络汤高剂量组(8.0 mg/kg),每组20只,雌雄各半。模型组、芪蝎活血通络汤各剂量组腔注射戊巴比妥腹麻醉后,通过颈中线切口分离左颈总动脉(CCA)和颈内动脉(ICA)。将预先涂有硅橡胶(外径0.26 mm)的尼龙单丝插入CCA并进入ICA至左侧CCA分叉处约19~20 mm以闭塞大脑中动脉。然后,在诱导缺血后2 h,缓慢取出皮肤并将动物放回笼中再灌注22 h。对照组的大鼠只切开皮肤和分离血管,不进行阻塞血流。在整个外科手术过程中,使用红外灯将大鼠体温维持在37℃。术后给予20万U青霉素肌肉注射,连续使用3 d。
1.4 给药方法 芪蝎活血通络汤各剂量组术后第1天开始腹腔给予相应剂量药物,对照组和模型组给予等体积0.9%氯化钠溶液,持续给予4周。
1.5 神经功能缺损评分 以盲控方式记录缺血性损伤后7、14 d每只大鼠的神经功能缺损评分。
1.6 贴纸去除及平衡木行走实验[11-12]采用2片10 mm的正方形黏性纸粘住大鼠2个前肢掌面,记录大鼠去除两侧纸片的总时间为双侧贴纸去除时间。105 cm×4 cm×3 cm的平衡木离地80 cm,起始点为陡峭平台,终点为一平台,记录大鼠通过整个平衡木的时间为平衡木过杆时间。
1.7 大鼠海马组织中SIRT1、PGC-1 mRNA水平测定 取大鼠海马组织于1 mL TRIzol Reagent中匀浆。加入0.2 mL氯仿后,将混合物在4℃下以12000 g离心15 min。将水相转移到新管中,加入0.5 mL异丙醇。在4℃下以10000 g离心10 min后,用1 mL 75%乙醇洗涤RNA沉淀物,并在4℃下以7500 g离心5 min。然后将RNA沉淀物风干并溶解在不含RNase的水中。为了测定RNA浓度,使用分光光度计SmartSpec 3000测量260 nm处的吸光度。使用TaqMan RNA-to-CT 1-Step Kit和StepOnePlus实时PCR系统进行RTPCR。
1.8 SIRT1、PGC-1蛋白在大鼠海马组织的表达水平测定 取大鼠海马组织石蜡包埋切片用于检测SIRT1、PGC-1的表达。将切片脱蜡,用分级的醇系列再水化并用PBS洗涤。然后将切片在室温下在3%H2O2中温育10 min以淬灭内源性过氧化物酶活性并在PBS中漂洗。将切片与兔多克隆抗SIRT1、PGC-1抗体一起孵育。然后在PBS中在37℃下保持2 h。然后将切片与生物素标记的二抗在37℃下孵育30 min。在两个高倍显微镜下评估每个切片中皮质和海马SIRT1、PGC-1的表达水平。ELISA测定大鼠海马组织中SIRT1、PGC-1蛋白水平。
1.9 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,采用单因素方差分析或t检验比较,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经运动功能评分比较 见表1。与对照组比较,模型组缺血损伤后7、14 d神经功能缺损评分明显升高(P<0.05);与模型组比较,芪蝎活血通络汤各剂量组7、14 d神经功能缺损评分降低(P<0.05)。
表1 各组大鼠神经运动功能评分比较(分,±s)

表1 各组大鼠神经运动功能评分比较(分,±s)
与对照组比较,∗P<0.05;与模型组比较,△P<0.05。下同
组别对照组模型组芪蝎活血通络汤低剂量组芪蝎活血通络汤中剂量组芪蝎活血通络汤高剂量组n 20202020207 d 0±010.66±0.47*8.14±0.34*△6.23±0.23*△5.35±0.16*△14 d 0±08.75±0.37*5.35±0.31*△4.91±0.26*△3.51±0.30*△
2.2 各组大鼠双侧贴纸去除时间、平衡木过杆时间比较 见表2。与对照组比较,模型组双侧贴纸去除时间、平衡木过杆时间明显升高(P<0.05);与模型组比较,芪蝎活血通络汤各剂量组双侧贴纸去除时间、平衡木过杆时间降低(P<0.05)。
表2 各组大鼠双侧贴纸去除时间、平衡木过杆时间比较(s,±s)
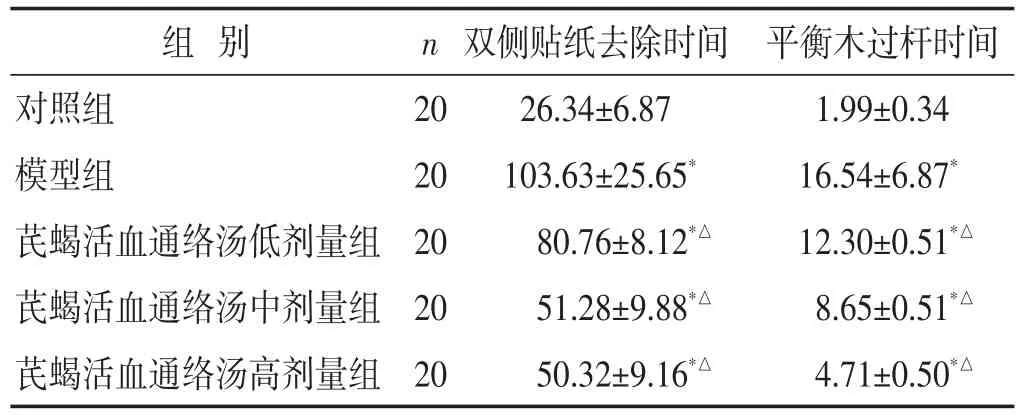
表2 各组大鼠双侧贴纸去除时间、平衡木过杆时间比较(s,±s)
组别对照组模型组芪蝎活血通络汤低剂量组芪蝎活血通络汤中剂量组芪蝎活血通络汤高剂量组n 2020202020双侧贴纸去除时间26.34±6.87103.63±25.65*80.76±8.12*△51.28±9.88*△50.32±9.16*△平衡木过杆时间1.99±0.3416.54±6.87*12.30±0.51*△8.65±0.51*△4.71±0.50*△
2.3 各组大鼠海马神经元结构的影响 见图1。对照组海马区神经元细胞完整,结构正常,染色清晰,核呈卵圆形位于中央。模型组海马区可见大量坏死神经元,且细胞脱失现象明显,细胞核固缩。芪蝎活血通络汤高剂量组海马区见少量坏死神经元细胞,且神经元细胞结构较为完整,神经元细胞核呈卵圆形位于中央,分布均匀。芪蝎活血通络汤中、低剂量组较模型组而言,坏死神经元细胞减少,但神经元细胞疏松紊乱,细胞核固缩,脱失现象明显,具有明显的剂量依赖效应。
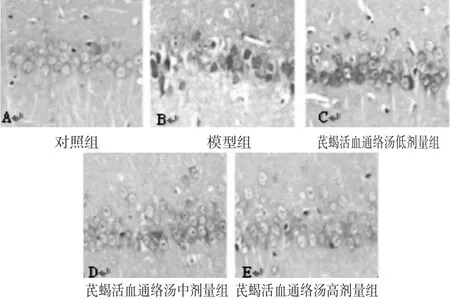
图1 各组大鼠海马神经元结构(HE染色,400倍)
2.4 各组大鼠SIRT1、PGC-1 mRNA表达水平比较见表3。与对照组比较,模型组SIRT1、PGC-1 mRNA水平降低(P<0.05);与模型组比较,芪蝎活血通络汤各剂量组SIRT1、PGC-1 mRNA水平升高(P<0.05)。
表3 各组大鼠SIRT1、PGC-1 mRNA表达水平比较(±s)
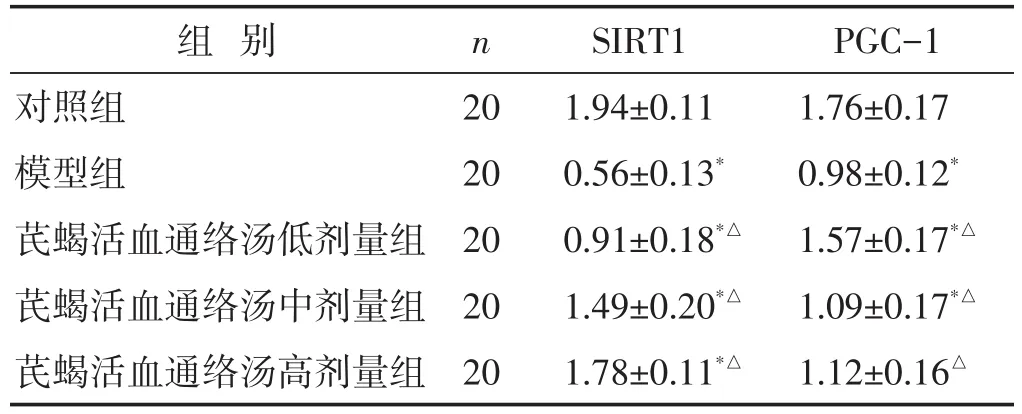
表3 各组大鼠SIRT1、PGC-1 mRNA表达水平比较(±s)
组别对照组模型组芪蝎活血通络汤低剂量组芪蝎活血通络汤中剂量组芪蝎活血通络汤高剂量组n 2020202020 SIRT11.94±0.110.56±0.13*0.91±0.18*△1.49±0.20*△1.78±0.11*△PGC-11.76±0.170.98±0.12*1.57±0.17*△1.09±0.17*△1.12±0.16△
2.5 各组大鼠SIRT1、PGC-1蛋白表达水平比较 见表4,图2~图3。与对照组组比较,模型组SIRT1、PGC-1蛋白水平降低(P<0.05);与模型组比较,芪蝎活血通络汤各剂量组SIRT1、PGC-1蛋白水平升高(P<0.05)。免疫组化法下,SIRT1、PGC-1阳性表达为棕褐色,各组SIRT1、PGC-1阳性表达情况与各蛋白表达水平符合。

图2 各组大鼠脑缺血再灌注损伤SIRT1表达(DAB,400倍)
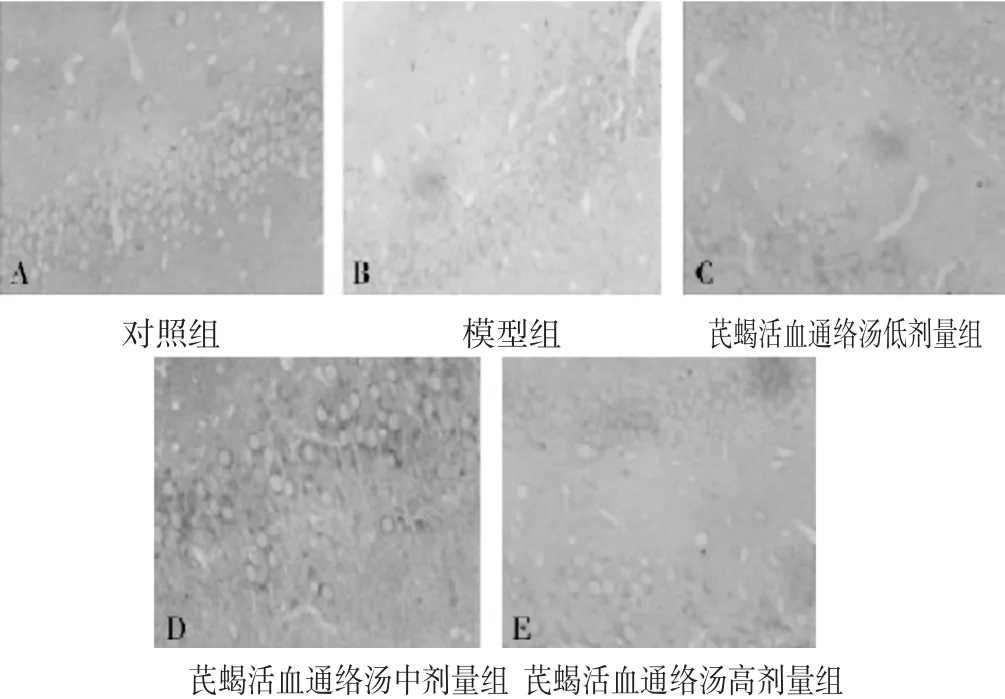
图3 各组大鼠脑缺血再灌注损伤PGC-1表达(DAB,400倍)
3 讨 论
芪蝎活血通络汤具有多重生物活性,包括镇痛,扩张血管,降低血浆黏度,抑制血小板聚集,抗血栓和增强抗缺氧能力等。研究证明,芪蝎活血通络汤含有黄酮类化合物,其具有抗脑缺血的神经保护作用[13]。研究结果显示,芪蝎活血通络汤各剂量组7、14 d神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间降低,且随着芪蝎活血通络汤给药剂量的增加,7、14 d神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间逐渐降低,结合病理学结果芪蝎活血通络汤高剂量组海马区见少量坏死神经元细胞,且神经元细胞结构较为完整,神经元细胞核呈卵圆形位于中央,分布均匀;芪蝎活血通络汤中、低剂量组较模型组而言,坏死神经元细胞减少,但经元疏松紊乱,细胞核固缩,脱失现象明显,具有明显的剂量依赖效应。这说明,芪蝎活血通络汤能明显减轻局灶性脑缺血再灌注损伤程度,具有神经保护作用。
表4 各组大鼠SIRT1、PGC-1蛋白表达水平比较(ng/g,±s)
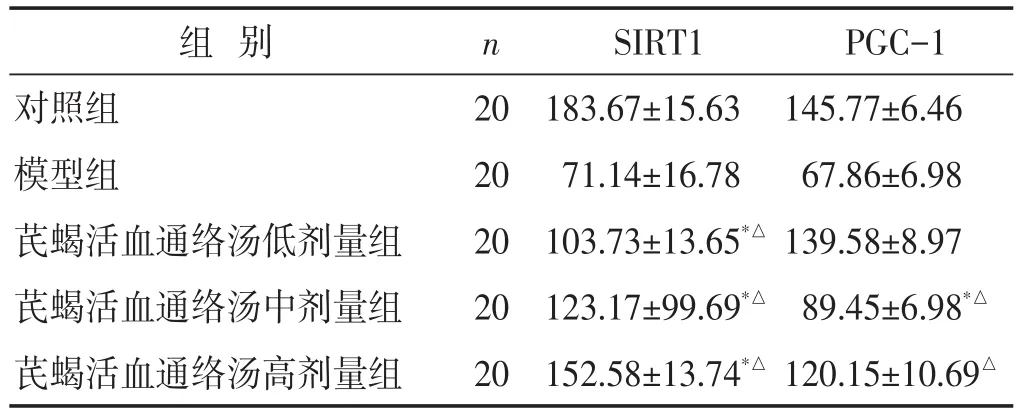
表4 各组大鼠SIRT1、PGC-1蛋白表达水平比较(ng/g,±s)
组别对照组模型组芪蝎活血通络汤低剂量组芪蝎活血通络汤中剂量组芪蝎活血通络汤高剂量组n 2020202020 SIRT1183.67±15.6371.14±16.78103.73±13.65*△123.17±99.69*△152.58±13.74*△PGC-1145.77±6.4667.86±6.98139.58±8.9789.45±6.98*△120.15±10.69△
SIRT1最近被发现是一类烟酰胺腺嘌呤二核苷酸依赖性的去乙酰化蛋白酶,其在长寿和应激反应中起关键作用[14]。在缺血再灌注神经损伤中,SIRT1活性的抑制与脑缺血和再灌注诱导的神经元死亡有关。然而,改善SIRT1活性有助于缺血性脑的抗细胞凋亡和神经保护作用。研究已经证实Akt的乙酰化(Ser473)是SIRT1完全启动其激活所必需的[15]。通过激酶和PH结构域之间的分子内相互作用,SIRT1通常维持在无活性状态,而Akt的PH结构域和3种乙酰基肌苷之间的相互作用使得乙酰经历重要的构象变化,这使得激活物能够接近激活环并且乙酰化Akt中Thr308的位点[16]。疏水基序中Ser473的乙酰化是Akt最大活化的先决条件。SIRT1的过表达激活了PGC-1对细胞存活以及线粒体活性的转录活性。SIRT1直接使蛋白质的不同结构域中的PGC-1去乙酰化,形成控制代谢基因表达的转录复合物。以这种方式,产生更多的能量。近期研究表明,PGC-1是调节内网应激效应介导的细胞凋亡的保护主要因素。PGC-1位于内质网的细胞质中,能被内网应激效应激活,此外过量的Ca2+水平以及内质网中大量蛋白沉淀均可激活PGC-1,PGC-1可直接抑制Caspasc-3和Caspasc-7的活性,来阻断各种刺激诱导的细胞凋亡过程;此外,PGC-1也可通过P21间接抑制Caspase;PGC-1与细胞周期调控因子CDK4结合,导致CDK2/cyclin-E激活和核糖体(Rb)磷酸化,Rb磷酸化后启动细胞进入周期,加快G1/S期的转换进而阻断凋亡信号转导通路[17-19]。本次研究结果显示,与对照组比较,模型组SIRT1、PGC-1 mRNA及蛋白水平降低;与模型组比较,芪蝎活血通络汤各剂量组SIRT1、PGC-1 mRNA及蛋白水平升高。这提示芪蝎活血通络汤能促进SIRT1、PGC-1 mRNA及蛋白的表达,进而对神经元细胞产生保护作用。
综上所述,芪蝎活血通络汤能明显减轻局灶性脑缺血再灌注损伤程度,具有神经保护作用;其机制与蝎活血通络汤能促进SIRT1、PGC-1 mRNA及蛋白的表达有关。

