叶绿素荧光分析技术在实验教学中的应用
班宜辉,徐舟影,李 静,李 媛,陈碧峰,李俊丽,谢 浩
叶绿素荧光分析技术在实验教学中的应用
班宜辉1,徐舟影2,李 静1,李 媛1,陈碧峰1,李俊丽1,谢 浩1
(1. 武汉理工大学 化学化工与生命科学学院,湖北 武汉 430070;2. 武汉理工大学 土木工程与建筑学院,湖北 武汉 430070)
植物光合作用是植物生理学及相关课程的重要研究内容,而叶绿素荧光分析技术是快速、准确探测植物生理状况的重要技术手段。该文设计了综合性设计性实验项目“利用叶绿素荧光分析技术研究不同温度和水分条件对植物光合作用的影响”,研究不同温度和水分胁迫对植物光合特性的影响。该实验项目的实施,能够使学生熟悉调制叶绿素荧光仪的工作原理,掌握叶绿素荧光分析技术,从而提高学生独立开展科研项目的能力以及创新意识和创新能力。
叶绿素荧光分析技术;光合作用;温度胁迫;水分胁迫
光合作用是全球碳循环的驱动因子,是地球上绝大部分生命得以维系的物质来源,是植物重要的生理过程。光合作用相关参数测定和分析,一直是植物生理学相关实验课程的重点内容[1]。叶绿素荧光与植物光合作用关系密切,是植物叶绿素吸收能量后释放的一种长波信号,包含了十分丰富的光合作用信息,使用特定的荧光参数可估算线性电子传递速率、同化速率以及光合系统热耗散的变化[2-4]。因此,作为体外快速无损害检验光合作用的探针,叶绿素荧光常常被用于监测植物光合器官运转情况,可以通过对体内叶绿素荧光参数的测定来反映多种逆境因子对植物光合作用的影响[5-6]。温度和水分胁迫是最常见的植物胁迫因子,不适的温度条件势必会影响植物的光合效率,更易发生光抑制现象[7-8],水分胁迫则可抑制光合作用光反应中的光能转换、电子传递、光合磷酸化和光合作用暗反应等一系列过程, 导致光合速率下降,破坏光合作用进程[9]。
虽然叶绿素荧光被广泛应用于光合作用监测,叶绿素荧光参数也很容易测得,但叶绿素荧光分析技术大多用于科研领域,学生在实验教学环节很少有机会接触和掌握这一技术。为使学生了解并掌握这项在植物生理学研究中广泛应用的先进技术,设计了“利用叶绿素荧光分析技术研究不同温度和水分条件对植物光合作用的影响”综合实验,采用以学生自我训练为主的教学模式,培养学生数据分析和处理能力,提高学生创新思维,为探究影响光合作用强度的因素提供更多的实证数据。
1 实验材料与仪器
1.1 植物材料
植物材料为玉米(L.),品种为郑单958。选取大小一致的种子,用1%次氯酸钠表面消毒5 min,无菌水冲洗3遍,放入无菌培养皿中于25 ℃培养箱中催芽,挑取发芽一致的种子备用。
1.2 主要仪器
便携式调制叶绿素荧光仪(德国Walz,MiniPAM)、高压蒸汽灭菌器(日本TOMY,SX-500)、人工气候箱(上海精宏,RQH-250)。
2 实验设计与方法
2.1 实验设计
实验采用室内盆栽培养方法,培养基质为蛭石,在121 ℃下高压蒸汽灭菌1 h。冷却后装盆,塑料盆直径20 cm,高15 cm,每盆装0.8 kg。移栽大小一致的玉米幼苗,放置在光照培养箱内培养,培养条件为25 ℃(昼)/18 ℃(夜)、光照强度500 μmol/(m2∙s)、每天光照时数10 h。每周浇 Hoagland's 营养液[10],每盆100 mL,配方为10 μmol/L H3BO3、6 mmol/L KNO3、8 mmol/L Ca(NO3)2、1 mmol/L NH4H2PO4、2.6 mmol/L MgSO4、0.5 μmol/L CuSO4、1.0 μmol/L ZnSO4、1.6 μmol/L MnSO4和(NH4)Mo2PO4及2 μmol/L Fe-EDTA,用1 mol/L HCl调节pH为6.5。培养15天后,开始进行水分胁迫和温度胁迫。
实验设置6 ℃为低温胁迫(low temperature stress,LTS)、36 ℃为高温胁迫(high temperature stress,HTS)及对照(CK,25 ℃)等3种温度处理。设置3种水分条件,设定基质含水量占田间持水量的80%为对照(CK),60%为轻度胁迫(light water stress,LWS),30%为重度胁迫(severewater stress,SWS),采用称重法控制基质水分。所有处理均重复5次。胁迫进行1周后测定叶绿素荧光参数。
以上实验设计为教师在示范教学时采用的胁迫梯度及标准,学生在分组实验时可自行设定温度和水分的胁迫浓度,并可自主选择胁迫时间,以充分调动学生积极性、锻炼自主科研能力,各小组还能在数据处理时进行对比分析,从而得出准确、可靠的实验结论。
2.2 叶绿素荧光参数的测定
使用便携式调制叶绿素荧光仪(Mini PAM)于上午9:00–10:00测量玉米幼苗完全展开的第2片叶的叶绿素荧光参数。测定前先将玉米幼苗放在黑暗环境中暗适应20 min左右,测试时记录初始荧光(0)、暗适应的最大荧光(m)、稳态荧光(t)、作用光关闭时的原初荧光(0ʹ)、作用光打开时的最大荧光(ʹm)。测量时,首先用测量光(<0.1 μmol/(m2∙s))激发叶绿素的本底荧光测定0,再打开一次饱和脉冲光(光子通量密度PFD为8000 μmol/(m2∙s),频率为20 kHz,1个脉冲时间为0.8 s),测定m以及v/m,然后打开作用光(PFD约为336 μmol/(m2∙s),白光)测定光下稳态荧光Ft,再打一次饱和脉冲光测定Fʹm,关闭作用光,继以一次远红外光(PFD约为5 mol/(m2∙s),3 s)测定0ʹ[11]。最小荧光、最大荧光、实时荧光测定各处重复5次。根据以下公式计算相关参数:
(1)PSII最大量子产量v/m=(m−0)/m;
(2)PSII实际光化学量子产量(II)=(ʹm−t)/ʹm;
(3)光化学荧光淬灭系数qP=(ʹm−t)/(ʹm−0);
(4)非光化学荧光淬灭NPQ=(m−m)/ʹm;
2.3 数据处理和统计学分析
采用Excel 2016和SPSS 19.0软件进行数据的统计分析,采用SigmaPlot 12.0进行图形制作。数据为5次重复的平均值±标准偏差(SD),组间比较采用方差分析检验,以<0.05为差异有统计学意义。
3 结果与分析
3.1 不同温度对玉米叶绿素荧光参数的影响
3种温度下玉米叶绿素荧光参数v/m、(II)、qP、NPQ的变化见图1。v/m、(II)、qP等3个参数在25 ℃条件(CK)下数值最高,其次是高温胁迫(HTS),低温胁迫(LTS)下数值最低,且不同条件下的差异均达到了显著性(<0.05)。三种温度条件下的NPQ的数据显示,低温条件下玉米NPQ值达到2.33,分别是对照和高温胁迫下的1.87和1.29倍,差异显著(<0.05)。实验数据表明,高温或低温胁迫均会对玉米光合系统造成显著性影响,电子传递速率降低,光能利用率下降。与高温胁迫相比,低温条件对玉米光合作用效率的抑制作用更加显著。
3.2 不同水分条件对玉米叶绿素荧光参数的影响
不同程度水分胁迫下玉米叶绿素荧光参数v/m、(II)、qP、NPQ的变化如图2所示。3种水分条件下v/m、(II)、qP等3个参数的数值变化表现为,正常水分(CK)>轻度胁迫(LWS)>重度胁迫(SWS),且差异均达到了显著水平(<0.05)。重度水分胁迫对(II)和qP的影响更为明显,与对照相比,在重度胁迫下(II)和qP的数值分别下降了51.8%和51.0%。3种水分条件下的玉米NPQ的数据显示,轻度水分胁迫增加了热能的损耗,与对照相比提高了17.8%,但二者差异不显著(>0.05),重度水分胁迫下NPQ值是对照的1.5倍,差异显著(<0.05)。由实验数据可知,轻度或重度水分胁迫均会抑制玉米光合作用活性,且重度胁迫显著增加了热耗散,降低了植物的光化学效率,对光合作用的抑制更为显著。
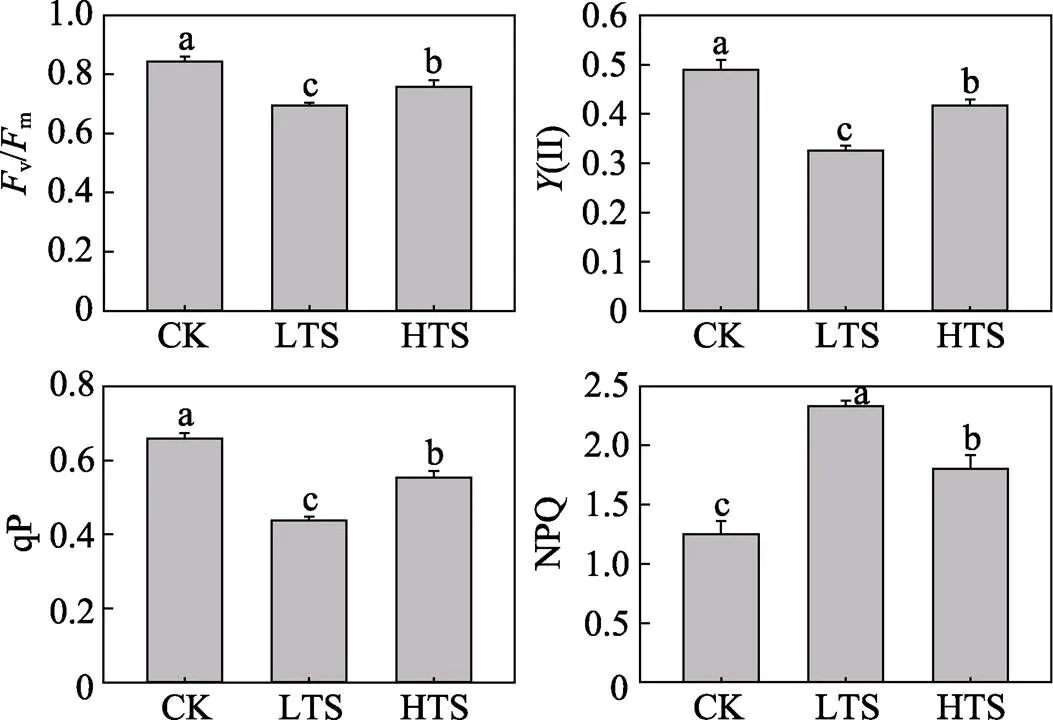
图1 温度胁迫对玉米叶绿素荧光参数的影响
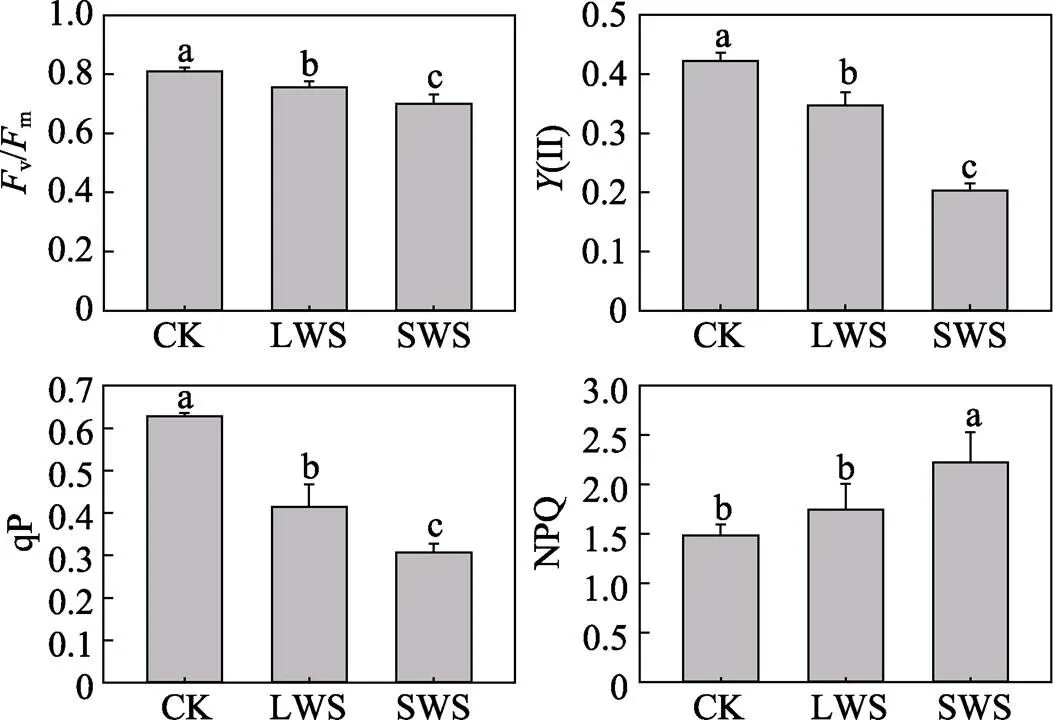
图2 水分胁迫对玉米叶绿素荧光参数的影响
4 实验教学探讨
4.1 教学效果评价
在植物生理学相关课程中,对植物光合作用的常规测定主要包括测定植物叶面积、叶绿素含量、Mg2+含量等,这些很难准确、快速地反映植物光合特性,更无法依此评价环境因素对植物光合作用的影响。叶绿素荧光分析具有测量快速、准确可靠、原位测量等优点,可以在不破坏叶片的前提下了解叶片内部光合作用过程的变化,判断植物光合特性、受胁迫状态、光保护能力等[12]。
(1)便携式调制叶绿素荧光仪可以实时监测叶绿素荧光参数的变化,从实验开始直至实验完成都在采集荧光数据,且一直处于动态变化过程中。学生可以根据图谱变化实时了解植物光合作用状态,教师可以根据实验数据的变化,随时提出问题,引导学生进行分析和讨论。学生在此过程中既能了解仪器的工作原理和操作方法,也能通过分析参数的变化,理解不同参数与植物光合活性的关系。
(2)叶绿素荧光仪在植物光合作用测定中的应用,增加了实验过程的“可视性”。借助于荧光仪将“不可视”的荧光信号的变化转换为“可视”的实验数据,并以动态曲线的方式呈现在计算机上,实验结果更加清晰明了,给学生以直观的印象,更能加深学生对植物光合作用过程的理解,并明确叶绿素荧光在植物光合作用中的作用及意义。
(3)叶绿素荧光仪对荧光信号的采集非常灵敏,在动态检测光合作用过程中对微小量的变化都可以检测出来,实现了实验变量的定量检测,增强了实验结果的准确度。与以往光合作用测定方法相比,数据可信度更高。
(4)以往对植物光合作用的测定过程比较繁琐,需要配制相应的试剂,测定过程耗时较长。叶绿素荧光参数的测定过程可以在短时间内完成,实时收集 数据,大大缩短了实验学时,而实验教学质量却明显提高。
4.2 叶绿素荧光参数的选择
由于叶绿素荧光反应的过程是光合电子传递链中能量平衡的过程,对操作环境及植物生长状态十分敏感,因此在应用这些叶绿素荧光参数来诊断胁迫因素对植物光合作用的影响时,容易受到许多潜在干扰因素的影响,必须谨慎使用不同的叶绿素荧光参数组合[13]。
在诸多叶绿素荧光参数中,Fv/Fm、Y(II)、qP和NPQ是最为常用的参数组合,能够综合反映胁迫下植物光合特性的变化。Fv/Fm的大小表示PSII受伤害的程度;Y(II)反映了光合链上电子传递的速率;qP表示叶绿素吸收的光能用于光化学反应的大小,也可表示PSII将光能转变为电势能的能力;NPQ是非光化学荧光淬灭系数,它的大小表示叶绿体吸收来的光能以热能形式散去的部分,在强光下它对保护PSII的结构有重要作用[14]。
4.3 实验注意事项
(1)植物种类的选择及植物幼苗的均一性。调制叶绿素荧光仪的叶夹是固定植物叶片的装置,上下两部分打开后可以夹住叶片,夹子上面部分提供了一个直径为1 cm的圆形测量孔。因此,为了达到较好的实验效果,实验教学用的植物材料应选择叶片较大、生长较快的植物,以保证荧光信号的采集不受影响。另外,为了保证植物材料的均一性,应选择育苗时间相同、大小一致的植物幼苗进行后续实验,以减小植物个体差异对实验数据的影响。
(2)叶片的选择。许多研究表明,植物不同叶位叶片及同一叶片不同部位的光合速率存在很大的差异,而且不同叶片的着生角度(平展和直立)或取向也对叶片的光合速率有影响。因此,实验中在作对比测定时一定要充分注意所测植物叶片的叶位、叶取向和叶部位等叶片诸多因素的一致性和可比性[15]。由于完全展开的叶片的光合活力最高,因此本实验项目以玉米幼苗完全展开的第2片叶作为样品叶。如果忽略叶片在光合速率上的差异性,会引起较大的实验误差。
(3)植物培养过程中要考虑“边缘效应”的影响。本实验中,植物材料的培养在光照培养箱中进行,不同位置(中央位置与周边部分)植物所受的光照强度、温度、湿度等因素略有差异。为了尽量避免其他因素对实验结果的影响,提高实验的准确度,植物培养过程要适时调整植物幼苗在光照培养箱中的位置,消除“边缘效应”的影响。
(4)叶绿素荧光参数测定的时间要求。叶绿素荧光参数的测定要充分考虑植物光合作用的规律,在植物光合作用活性较高的上午9:00–11:00时测定的荧光参数,才能最准确地反映植物光合作用效率。
5 结语
叶绿素荧光作为光合作用的探针,得到了广泛的研究和应用。植物光合作用的所有变化过程均可通过叶绿素荧光参数的变化反映出来,而叶绿素荧光分析技术采取原位测定的方法,不破坏植物体完整性,不损伤细胞。因此,通过研究叶绿素荧光来间接研究光合作用的变化是一种简便、快捷、准确的方法。
本文利用叶绿素荧光仪的上述特点,结合植物生理学等课程的实验要求,设计了“利用叶绿素荧光分析技术研究不同温度和水分条件对植物光合作用的影响”综合实验。通过该实验项目的实施,既能够使学生熟练掌握叶绿素荧光分析技术,了解不同环境条件对叶绿素荧光的作用效果,又能够实现以学生自我训练为主的教学模式,培养学生的创新思维能力、科学探究能力和实践创新能力,充分调动学生学习的主动性、积极性和创造性,为今后自主开展科学研究工作打下坚实的基础。本实验利用数字化的实验设备,通过简单的方法或技术,在短时间内能够获得精确的实验结果。在整个实验及分析和整理数据的过程中,教师与学生形成互动,现场解决疑难问题,能够节省课堂学时,更好地阐述实验原理,提高课堂教学效率,是信息技术与生命科学实验教学整合的新途径。
[1] 许大全.光合作用学[M].北京:科学出版社, 2013.
[2] 赵会杰,邹琦,于振文.叶绿素荧光分析技术及其在植物光合机理研究中的应用[J].河南农业大学学报,2000, 34(3): 248–251.
[3] 李鹏民,高辉远,STRASSER R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005, 31(6):559–566.
[4] 宋婷,张谧,高吉喜,等.快速叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].生物学杂志,2011, 28(6): 81–86.
[5] 李钦夫,李征明,纪建伟,等.叶绿素荧光动力学及在植物抗逆生理研究中的应用[J].湖北农业科学,2013, 52(22): 5399–5402.
[6] 胡丰姣,黄鑫浩,朱凡,等.叶绿素荧光动力学技术在胁迫环境下的研究进展[J].广西林业科学,2017, 46(1): 102–106.
[7] 黄艳花,杨锐,孙庆海.温度对裂片石莼生长及叶绿素荧光特性的影响[J].生物技术通报,2016, 32(7): 99–105.
[8] 程祥飞,王磊,聂林杰,等.低温胁迫下菊花叶片叶绿素荧光特性与抗氧化酶活性的变化[J].河南农业科学,2018, 47(4): 104–108.
[9] 刘雷震,武建军,周洪奎,等.叶绿素荧光及其在水分胁迫监测中的研究进展[J].光谱学与光谱分析,2017, 37(9): 2780–2787.
[10] HOAGLAND D R, ARNON D I. The water-culture method for growing plants without soil[J].California Agricultural ExperimentStation Circular, 1950, 347(2): 32.
[11] 林惠鸿,韦娇媚,朱积余,等.水分胁迫下柚木叶绿素荧光动力学特性[J].广西林业科学,2015, 44(3): 239–243.
[12] 刘雷震,武建军,周洪奎,等.叶绿素荧光及其在水分胁迫监测中的研究进展[J].光谱学与光谱分析,2017, 37(9): 2780–2787.
[13] 尤鑫,龚吉蕊.叶绿素荧光动力学参数的意义及实例辨析[J].西部林业科学,2012, 41(5):90–94.
[14] 莫亿伟,郭振飞,谢江辉.温度胁迫对柱花草叶绿素荧光参数和光合速率的影响[J].草业学报,2011, 20(1):96–101.
[15] 许大全.光合作用测定及研究中一些值得注意的问题[J].植物生理通讯,2006, 42(6): 1163–1167.
Application of chlorophyll fluorescence analysis technique in experimental teaching
BAN Yihui1, XU Zhouying2, LI Jing1, LI Yuan1, CHEN Bifeng1, LI Junli1, XIE Hao1
(1. School of Chemistry, Chemical Engineering and Life Sciences, Wuhan University of Technology, Wuhan 430070, China; 2. School of Civil Engineering and Architecture, Wuhan University of Technology, Wuhan 430070, China)
Plant photosynthesis is an important research content of plant physiology and related courses, and chlorophyll fluorescence analysis technology is an important technical means to quickly and accurately detect plant physiological status. In this paper, a comprehensive design experiment project was designed to study the effects of different temperature and water conditions on plant photosynthesis by chlorophyll fluorescence analysis technology, and to study the effect of different temperature and water stress on plant photosynthesis characteristics. The implementation of this experimental project can familiarize students with the working principle of the modulated chlorophyll fluorescence meter and grasp the chlorophyll fluorescence analysis technology, so as to improve students’ ability to independently carry out scientific research projects, as well as their innovative consciousness and innovative ability.
chlorophyll fluorescence analysis technique; photosynthesis; temperature stress; water stress
G642.0
A
1002-4956(2019)09-0172-04
2019-02-21
武汉理工大学教学改革研究项目(w2018113,w2019121,w2019084)
班宜辉(1985—),男,河南商丘,博士,助理研究员,主要研究方向为植物抗逆机制。
E-mail: banyihui@whut.edu.cn
徐舟影(1987—),女,安徽池州,博士,副教授,硕士生导师,主要研究方向为植物-微生物共生机制。
E-mail: zhouyingxu@126.com
10.16791/j.cnki.sjg.2019.09.044

