增加除菌级过滤器重复使用的可行性探讨
查文勇 徐静研 陈曌昀

摘 要 目的:增加除菌级过滤器重复使用次数,无疑可以降低企业的生产成本,但重复使用效果必须得到验证。方法:依据美国 ASTMF838标准要求,在模拟实际生产工艺条件下,對生产过程中已使用过3次的型号为AB05EKV7PH4(PALL)除菌级过滤器再使用3次做细菌截留能力进行验证。结果:每平方厘米有效过滤面积的微生物对数下降值( LRV)符合不小于 7的标准规定。结论:可以判断重复使用后的除菌级过滤器的截留能力是符合法规要求的。
关键词 除菌级过滤器 重复使用 验证
中图分类号:TQ460.82 文献标志码:A 文章编号:1006-1533(2019)15-0093-04
Study on the feasibility of increasing frequency of reuse of sterilization filters
CHA Wenyong 1*, XU Jingyan 2, CHEN Zhaoyun1
(1. SPH No.1 Biochemical & Pharmaceutical Co., Ltd., Shanghai 200240, China; 2. Shanghai Traditional Chinese Medicine Co., Ltd., Shanghai 200002, China)
ABSTRACT Objective: Increasing the frequency of reuse of sterilization filters will undoubtedly reduce the production cost of enterprises. But reuse must be verified. Methods: According to the ASTMF838 standard of the United States of American, verification of the bacterial retention rate was conducted by repeated use of filter for three times using AB05EKV7PH4(PALL)type of sterilization filters. Results: The logarithmic reduction value (LRV) of microorganisms per square centimeter of effective filtration area meets the standard of greater than 7. Conclusion: It can be proved that the bacterial retention rate of reused sterilization filters can meet the requirement of regulations.
KEy WORDS sterilization grade filter; reuse; validation
目前我公司冻干无菌制剂产品在生产过程中规定采用二道0.2 mm除菌过滤,其中第一道除菌采用AB05EKV7PH4(PALL)除菌级过滤器过滤,它采用的是直径5英寸的0.2 mm(聚醚砜滤芯)折叠式过滤器,同品种连续可使用3次。第二道除菌过滤采用0.2 mm(聚醚砜滤膜)平板式过滤器,滤膜每批进行更换。经统计我公司每年采购AB05EKV7PH4(PALL)滤芯的金额高达50万,这大大提高了冻干无菌制剂的生产成本,且第一道除菌级过滤器经3次使用后的完整性测试均是合格的,因此我们认为使用3次后的AB05EKV7PH4(PALL)除菌级过滤器理论上仍具备除菌的能力,可以开展重复使用的研究工作。
1 材料和方法
1.1 实验仪器设备
ZLD-Ⅲ细菌截留装置(上海中立德医药科技有限公司);Filguard-421全自动过滤器完整性测试仪(上海先维过滤设备厂);BSD振荡培养箱(上海博迅实业有限公司医疗设备厂);SW-CJ-2D净化工作台(苏州净化设备有限公司);HX-030低温恒温循环器(上海比朗仪器有限公司)。
1.2 实验材料
AB05EKV7PH4除菌级过滤器(滤芯,PALL公司,聚醚砜(PES)材料,孔径0.2 mm,批号为IA0972和IB6360);Membrane滤膜(GmbH公司,聚醚砜(PES)材料,孔径0.45 mm,批号为80041131806001);注射用二丁酰环磷腺苷钙(20180626)和注射用糜蛋白酶(20180914)均来自上海上药第一生化药业有限公司;缺陷假单胞菌(Brevundimonas diminuta)ATCC19146TM(American Type Culture Collection,ATCC);验证用缺陷假单胞菌菌液(编号F4:批号20180626);胰蛋白胨大豆琼脂培养基(TSA,批号20180419)购自国药集团化学试剂有限公司;其他常用试剂均为国产分析纯。
1.3 方法
将使用过3次的过滤装置和滤膜用纯化水清洗干净,于121℃湿热灭菌45 min,在无缺陷假单胞菌存在的情况下,第四次在模拟实际生产工艺条件下分别循环过滤4 000 ml注射用二丁酰环磷腺苷钙或注射用糜蛋白酶,过滤时压差为 0.10~0.12 MPa,流速为 200~400 L/h,过滤温度为15~25 ℃,过滤接触时间为 6 h,循环过滤的总体积 1 200~2 400 L;第五、第六次重复该操作。依据美国 ASTMF838标准[1]要求,在标准实验程序下[2-4]本次实验分为实验组、阴性对照组、阳性对照组及进行完整性测试方法确认。
1.3.1 实验组
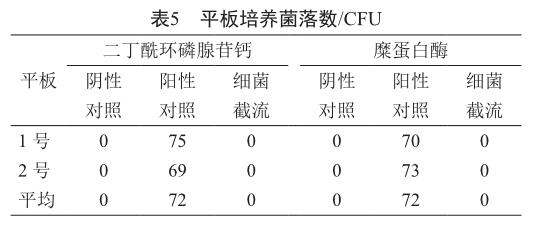
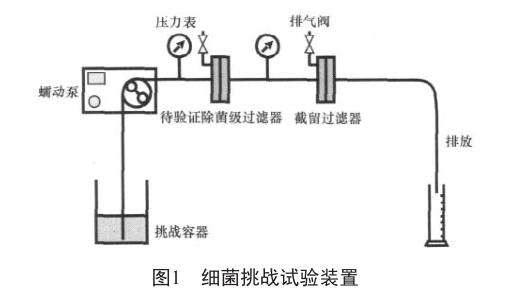
细菌截留实验[5-7]:分别将使用过3次的除菌级过滤器和滤膜用纯化水清洗干净,于121 ℃湿热灭菌45 min,按图1所示安装后,在室温条件下将缺陷假单胞菌悬于 4 000 ml纯化水中,使菌液濃度≥1.0×107 CFU/cm2的有效过滤面积。以 0.20~0.22 MPa的压力进行连续过滤。菌液过滤后,对下游管路抽真空后将实验组滤器组件移至生物安全柜。在无菌操作条件下,将滤膜转移至含 TSA培养基的培养皿内,(30±2)℃培养 48 h~7 d。观察并记录菌落数量。对菌落进行鉴别,验证是否为缺陷假单胞菌。
1.3.2 阴性对照实验
在进行细菌截留实验之前需进行阴性对照实验,目的是检验装置系统的灭菌效果。在截留装置中加入适量纯化水,使其通过待验证过滤器及其下游管道,再经过0.45 μm滤膜(阴性对照组滤器组件滤膜)收集后将滤器组件移至生物安全柜。以无菌操作方式将上述阴性对照膜转移至含 TSA培养基的培养皿内,(30±2)℃培养48 h~7 d。观察并记录菌落数量。
1.3.3 阳性对照实验
阳性对照实验主要证明细菌截留实验中所用的缺陷假单胞菌是否符合法规要求。步骤概括如下:将适量的缺陷假单胞菌悬浮液加入到截留装置中,并且满足菌液的浓度≥1.0 ×107 CFU/cm2有效过滤面积。将含有缺陷假单胞菌的悬浮液通过0.45 mm滤膜(阳性对照组滤器组件滤膜),收集过滤液用 0.9%氯化钠溶液作为缓冲液进行 10倍递次稀释,取各稀释级 1 ml菌液加入含 TSA培养基的培养皿中,于(30±2)℃下培养 72 h~7 d,观察并计数。
1.3.4 完整性测试
用完整性测试仪对型号为 AB05EKV7PH4的除菌级过滤器在分别用于两产品细菌截留实验前后进行完整性测试[8-9];实验中 0.45 mm阳性对照滤器组件滤膜也要进行完整性测试。检测前,过滤器必须用适当的润湿液完全润湿。检测所用设备应提前放置在室内,以达到室温。
2 结果
2.1 细菌截留验证结果
重复使用6次后AB05EKV7PH4除菌级过滤器的细菌截留能力实验结果表明全部符合要求,且每平方厘米有效过滤面积的缺陷假单胞菌对数下降值(LRV)全部符合 LRV不小于 7的标准规定[10](表1)。过滤过程中无菌保证与过滤液体的初始生物负荷及过滤器的对数下降值LRV(Log reduction value)有关。LRV系在规定的条件下,过滤器微生物截留水平(CFU/cm2)的常用对数。即:LRV=lg过滤器微生物截留水平。证明AB05EKV7PH4型除菌级过滤器重复使用6次后,仍然能够保证细菌截留能力,有效滤除微生物。
2.2 完整性测试结果
在实验室条件下采用AB05EKV7PH4除菌级过滤器模拟工艺流程对两个产品再重复使用 3次测定细菌截留后的泡点值,其泡点值可接受标准为 ≥3 655 mbar,测定的泡点值全部 ≥3 655 mbar,说明除菌级过滤器完整,符合要求(表2);0.45 mm滤膜泡点值可接受标准为≥2 400 mbar,测定的泡点值全部≥2 400 mbar(表3、表4),说明滤膜完整,符合要求。

2.3 阴性对照组、阳性对照组和实验组结果
从表5中可以看出中阴性对照组、阳性对照组和实验组全部符合要求,没有检测到缺陷假单胞菌的透过,说明AB05EKV7PH4型除菌级过滤器具备除菌能力。
3 讨论
除菌级过滤器验证过程是一个集技术、管理和法规于一体的要求很高的工作,要求相关人员严格按照规定程序进行,并需对验证的全过程进行完整详细的记录。对这些验证记录要有充分的分析与评估,同时在药品生产过程中应严格遵照已验证的工艺参数进行操作,不允许超过已验证工艺参数的上限,这正是验证的指导意义所在。在本次验证过程中,采用型号AB05EKV7PH4(PALL)的除菌级过滤器分别对两产品由除菌过滤3次增加至6次,其细菌截留后的滤液是无菌的,并且完整性测试符合规定,可以判断该除菌级过滤器的细菌截留能力是有效的。在整个验证过程中充分考虑了药品和工艺条件对挑战微生物及过滤器的影响,这使我们找到了一种增加除菌级过滤器重复使用次数验证的较科学的方法,通过增加滤芯过滤次数,达到降低滤芯使用成本的目的。除此之外,为了进一步降低除菌风险,可以考虑对药品中的原料药进行微生物数量的控制,从而降低药液总体的微生物污染水平,确保过滤后药液的无菌。
由于PALL公司的AB05EKV7PH4聚醚砜滤芯较市面上其他品牌滤芯较昂贵,从企业降本增效的角度出发,在确保产品质量及符合GMP法规要求的前提下,本实验仅是对第一道过滤(即粗滤)进行了增加重复过滤次数的研究,尚未在实际生产上进行运用,后续还有大量的研究及验证工作需要开展,譬如在正式生产线上采用产品标准批量进行6次重复过滤的工艺验证,并对验证批次的稳定性进行考察,在获得合格数据的基础上进行风险评估考虑是否启动相应的变更程序。
参考文献
[1] ASTM F838-05. Standard Test Method for determining Bacterial Retention of Membrane Filters Utilized for Liquid Filtration[EB/OL]. [2018-11-10]. https://www.astm.org/DATABASE.CART/HISTORICAL/F838-05.htm.
[2] 国家药品监督管理局关于发布除菌过滤技术及应用指南等3个指南的通告(2018年第85号)[EB/OL].(2018-07-31)[2018-11-10]. http://www.nmpa.gov.cn/WS04/ CL2050/330190.html.
[3] 谢婷, 唐燕, 董巍, 等. 除菌过滤器验证(二): 除菌效率验证[J]. 中国新药杂志, 2011, 20(13): 1161-1164.
[4] 刘晓伟, 杜琳琳, 卢晓旭, 等. 除菌过滤器的风险管理与验证: 除菌过滤器验证之细菌截留实验介绍[J]. 流程工业, 2012(24): 42-44.
[5] 中华人民共和国卫生部令第79号.《药品生产质量管理规范》(2010年修订)[EB/OL]. (2011-01-17)[2018-11-10]. http://www.gov.cn/gongbao/content/2011/content_1907093. htm.
[6] 许真玉. 注射剂过滤除菌工艺的讨论[J]. 首都医药, 2014, 21(14): 83-85.
[7] 靳文静, 韩天娇, 乔龙娟. 除菌过滤器在医药领域的应用[J]. 科协论坛(下半月), 2013(10): 95-96.
[8] 黄晓龙, 董巍, 唐燕, 等. 除菌过滤器验证(一): 法规要求概述[J]. 中国新药杂志, 2011, 20(10): 861-865.
[9] 关一鸣. 液体除菌过滤系统设计、灭菌及完整性检测[J].科技创新与应用, 2012(27): 19.
[10] 刘春燕, 吴清刚, 黎李, 等. 除菌过滤器微生物截留的试验分析[J]. 海南医学院学报, 2010, 16(2): 148-149; 173.

