卡托普利通过抑制氧化应激损伤和减轻炎症反应对冠脉微栓塞大鼠发挥心肌保护作用*
霍艳萍, 焦安德, 刘玉梅, 张孝丽
(1齐齐哈尔医学院附属第三医院心血管内科, 黑龙江 齐齐哈尔 161000; 2齐齐哈尔市第一医院心血管内科,黑龙江 齐齐哈尔 161000; 3齐齐哈尔医学院附属第三医院内分泌三科, 黑龙江 齐齐哈尔 161000)
冠状动脉粥样硬化心脏病是由于冠脉血管发生动脉粥样硬化病变导致血管的狭窄或阻塞,造成心肌细胞的缺血缺氧,甚至引起心肌细胞的坏死而导致的心脏病[1]。虽然近来对冠心病的诊治手段不断得到提高,但由于居民不良生活习惯和人口老年化,冠心病的患病率和致死率仍居高不下,因此该疾病备受关注[2-3]。虽然冠心病的发病机制复杂,但很多研究结果表明,炎症反应[4]、氧化应激[5]和钙超载[6]参与了该机制,并协同作用造成心肌细胞功能紊乱和凋亡的发生,从而导致心脏功能的损伤。因此需要进一步的研究来充分认识上述病理因素对心肌细胞的损伤机制,有助于寻找新的治疗策略。
细胞凋亡、炎症反应和氧化损伤在冠脉栓塞损伤中起着重要作用。心肌细胞缺血后,单核细胞、白细胞以及其它炎症细胞开始渗透到心肌组织损伤区域。然后活化后的巨噬细胞分泌多种炎症细胞因子,这些细胞因子能募集更多的中性粒细胞到心肌损伤区域,进一步加重心肌损伤[7]。结果表明,冠脉栓塞后的炎症反应促进心肌损伤[8]。此外,心肌细胞缺血缺氧后诱导氧自由基的产生,可进一步促进细胞凋亡[9]。因此,抑制心肌细胞的炎症反应,减少氧化损伤,可有效减轻冠脉栓塞引起的心脏损伤。
卡托普利(captopril,CAP)作为第1代的血管紧张素转化酶抑制剂,被应用在治疗高血压和某些类型的心力衰竭的治疗[10]。CAP通过改善心肌重构和降低炎症因子释放提高心肌梗死的疗效和改善患者心功能[11]。此外,有研究发现,CAP可通过增强抗氧化标志物的活性发挥抑制炎症反应的作用[12]。然而,CAP治疗冠脉栓塞的潜在机制仍不清楚。因此,本项工作利用冠脉微栓塞(coronary microembolization,CME)大鼠模型,探讨CAP对CME后损伤的心肌是否具有保护作用,并进一步对CAP介导的作用机制进行研究。
材 料 和 方 法
1 实验动物
SD大鼠(SPF级,雄性,220~250 g,6周龄,共18只)购自于齐齐哈尔医学院实验动物中心,许可证号为SCXK(黑)2016-001,饲养于齐齐哈尔医学院实验动物中心。大鼠在室温(23±2)℃、湿度(55±5)%的环境饲养。实验动物相关所有过程均得到伦理委员会的批准。
2 实验试剂
苏木精-伊红(hematoxylin and eosin,HE)染料、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒和过氧化氢酶试剂盒购自中国酶联科研公司;卡托普利原料药由东北制药公司馈赠;磷酸盐缓冲液(phosphate -buffered saline,PBS)、同型IgG、RIPA裂解液、BCA试剂盒和Triton X-100均购自Invitrogen;TUNEL细胞凋亡检测试剂盒和5%牛血清白蛋白购自Roche;抗cleaved caspase-3和Bax抗体及HRP标记的Ⅱ抗购自Cell Signaling Technology;二氢乙啶(dihydroethidium,DHE)染料购自Sigma。
3 方法
3.1动物模型的建立 6周龄SD大鼠进行适应饲养1周后,进行CME造模。用盐酸戊巴比妥(40 mg/kg)腹腔内注射麻醉后行气管插管,接呼吸机辅助呼吸。沿大鼠胸骨左缘第3和4肋间隙打开胸腔,分离升主动脉,用血管夹夹闭升主动脉20 s,用注射器从大鼠左心室心尖部向左心室注入0.2 mL的自身血栓微粒(粒径40 μm),观察大鼠心跳呼吸,待心跳呼吸平稳后关闭胸腔和拔除气管插管。术后予以160万单位的青霉素腹腔注射预防感染。对照组予以注射同量的生理盐水。
3.2实验分组 SD大鼠被随机分配到3个实验组,每个实验组有6只大鼠,分别是:(1)假手术对照(sham)组;(2)CME组;(3)CME+CAP(40 mg/kg)组:大鼠在术前7 d,每天口服喂养含有卡托普利的生理盐水(每日1次)。对照组和CME组同时给予等量的生理盐水。
3.3心肌组织病理分析 处死各实验组的大鼠并取出心脏,把心肌组织固定在10%福尔马林溶液。心肌组织经过石蜡包埋后制成厚度约为4 μm的切片。选取梗死区心肌切片并进行HE染色。每张HE染色切片在BX51型倒置显微镜(Olympus)下观察,并随机选取6个视野进行拍照。利用ImageJ软件分析心肌细胞直径和炎症细胞侵润。
3.4免疫组化 按照TUNEL细胞凋亡检测试剂盒说明书步骤对心肌组织切片行染色处理:心肌组织依次置于二甲苯中脱蜡和梯度乙醇水化;用蛋白酶K工作液在室温下处理切片15 min,用PBS洗涤3次;加入配好的TUNEL反应工作液室温孵育1 h;甲醇溶液室温处理10 min,PBS洗涤3次;过氧化物酶溶液37 ℃孵育30 min,PBS洗涤3次;加入二氨基联苯胺显色,PBS洗涤3次,用苏木素复染细胞核,再次脱水;封片并在BX51型倒置显微镜(Olympus)下观察并拍照。选取梗死区域进行TUNEL阳性细胞数占总细胞数的百分比计数。
3.5免疫荧光 各组大鼠梗死区的心肌组织用丙酮固定并制成厚度约10 μm的冰冻切片。切片用0.3%的Triton X-100在PBS中浸泡,然后再室温下用5%牛血清白蛋白封闭30 min。利用cleaved caspase-3抗体与样品进行4℃过夜孵育。孵育后用PBS反复清洗3次。用同型IgG再次孵育样品1 h。DAPI用于细胞核染色。最后在FV3000型荧光共聚焦显微镜(Olympus)下对样品进行观察,并用ImageJ软件分析相对荧光强度。
3.6Western blot检测蛋白表达水平 把各组梗死区的的心肌组织利用组织RIPA裂解液萃取蛋白。采用BCA法将各组蛋白样品定量至相同浓度后,取20 μg样品蛋白进行SDS-PAGE。电泳结束后,通过湿转法将蛋白质转移至甲醇预活化的PVDF膜,转膜条件为恒压100 V,时间为2 h。之后利用5%脱脂牛奶室温下封闭1 h并分别以1 ∶1 000的稀释比例孵育Ⅰ抗(cleaved caspase-3和Bax抗体), 4 ℃过夜。次日,以TBST洗涤后室温孵育相应的HRP标记的Ⅱ抗1 h,最后以TBST洗涤后利用化学发光成像仪显影。以β-actin为内参照,利用ImageJ软件分析目的蛋白相对灰度值。
经过 NSGA-II算法迭代50次后,由于备选设备库容量相对较小,出现部分解的重叠现象,最终得到27个Pareto最优解,如图4所示。以设备的总价格最低为标准,选型最优的4个点在图中用箭头标出。4个Pareto的最优解见表7。
3.7SOD和过氧化氢酶检测 利用SOD检测试剂盒和过氧化氢酶试剂盒按照实验说明书步骤通过酶标法对源自各组梗死区的心肌组织进行检测。采用ELx800型酶标仪(BioTek)检测450 nm波长处A值。样品的SOD和过氧化氢酶浓度分别按照预制的标准曲线进行计算。
3.8活性氧(reactive oxygen species,ROS)浓度检测 利用DHE染料对各组的大鼠梗死区心肌组织进行染色标记20 min,用PBS洗涤3次。在FV3000型荧光共聚焦显微镜(Olympus)下观察,并用ImageJ软件分析相对荧光强度。
4 统计学方法
本研究利用GraphPad Prism软件进行统计学分析。对于多组定量资料的两两比较,数据在满足正态分布和方差齐的条件下,实验数据采用均数±标准差(mean±SD)表示,利用单因素方差分析后续检验。当P<0.05时差异被认为具有统计学意义。
结 果
1 CAP减少冠脉栓塞导致的心肌细胞结构改变和炎症细胞浸润
通过HE染色评估CAP处理前后CME模型的心肌组织形态结果的变化。与对照组相比,CME组显示出心肌层结构紊乱,且少部分心肌细胞发生变性坏死(箭头处)和炎症细胞浸润(P<0.01);与CME组相比,用CAP预处理组炎症细胞浸润(P<0.01)和心肌细胞结构(P<0.05)改变减少,见图1。

Figure 1.CAP protected against the structural changes of the myocardium induced by CME. A: representative images of HE staining. B: quantification of inflammatory cell infiltration in each group; C: quantification of cross-sectional diameter of the cardiomyocytes in each group. Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsCME group.
图1 CAP减轻CME诱导的心肌结构改变
2 CAP减少CME心肌细胞的凋亡
利用TUNEL法检测CAP对CME后心肌细胞凋亡的影响。TUNEL染色后,凋亡细胞呈棕色。与对照组相比,CME组的凋亡心肌细胞数量显著增加(P<0.01);然而CAP处理后CME导致的凋亡细胞数量显著减少(P<0.01),见图2。
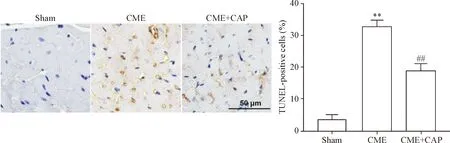
Figure 2.CAP reduced the cardiomyocyte apoptosis induced by CME. The scale bar=50 μm. Mean±SD.n=6.##P<0.01vssham group;**P<0.01vsCME group.
图2 CAP减少CME诱导的心肌细胞凋亡
3 CAP抑制心肌cleaved caspase-3和Bax表达
通过荧光共聚焦显微镜和Western blot分析评估了凋亡相关蛋白的表达。CME后cleaved caspase-3荧光强度较对照组升高,心肌的cleaved caspase-3和Bax蛋白表达水平显著上调(P<0.01),而CAP处理后cleaved caspase-3荧光强度降低,心肌组织中cleaved caspase-3和Bax蛋白水平下调(P<0.05),见图3。
4 CAP对抗氧化标志物的作用
5 CAP对ROS的影响
经CME造模鼠模型中提取的心肌内ROS荧光强度较对照组细胞显著增加(P<0.01);而予以CAP处理后CME的促ROS作用得到显著抑制(P<0.01),见图5。
讨 论
冠心病是世界上许多国家最严重危害人类身体健康的疾病之一,也是最常见的死亡原因。尽管已经开展了众多对于冠心病的研究并取得了一定的成果,但有效的治疗冠心病策略减轻和延缓心肌损伤药物还待进一步探索。已有研究报道CAP具有抗氧化、抑炎和改善心功能的作用[11-12]。然而,CAP治疗冠脉栓塞的潜在机制仍不清楚。考虑到不同影响因素造成冠心病的机制差异,因此,我们开展了CAP对CME后心肌细胞功能的有关病理机制的研究。
细胞凋亡是决定冠脉栓塞心肌损伤程度的特征性变化之一[13]。此外,心肌细胞凋亡程度严重影响冠心病治疗的有效性和患者的预后[14]。心肌细胞凋亡的减少已被研究证明能改善冠脉栓塞后的心肌功能,延缓心肌重塑过程[13]。据研究表明CAP可有效减少急性心肌梗死[11]、肝毒性[15]和肾功能不全[16]等疾病中的细胞凋亡。本研究结果也表明,CAP可显著抑制CME后心肌细胞凋亡,提示CAP对心肌细胞有一定的保护作用。
既往研究表明,细胞发生氧化应激反应后可产生大量的ROS,过量ROS发挥细胞毒性作用,促进细胞凋亡、坏死和炎症反应[17]。消除ROS的抗氧化物有SOD、过氧化氢酶、谷胱甘肽过氧化物酶等。增强抗氧化活性,消除过量ROS水平可在一定程度上减少细胞凋亡和炎症反应。本实验结果显示,CAP可以抑制CME诱导的ROS生成水平,促进SOD和过氧化氢酶的活性。这一结果提示,CAP可能通过抗过氧化应激来抑制心肌细胞凋亡和心肌炎症反应。但对于CAP如何降低ROS的相关机制需要我们将来深一步研究。另外,CME后ROS通过何种途径诱导的心肌细胞凋亡和心肌炎症反应;CAP是否可以通过参与这些途径发挥其抵抗CME诱导的心肌细胞凋亡和心肌炎症反应也值得进一步探讨。
综上所述,卡托普利在CME大鼠上具有抗氧化应激损伤和减轻炎症反应的作用,对CME后心肌起到保护作用。该研究结果为未来卡托普利治疗冠脉栓塞相关疾病的临床应用提供了参考资料。
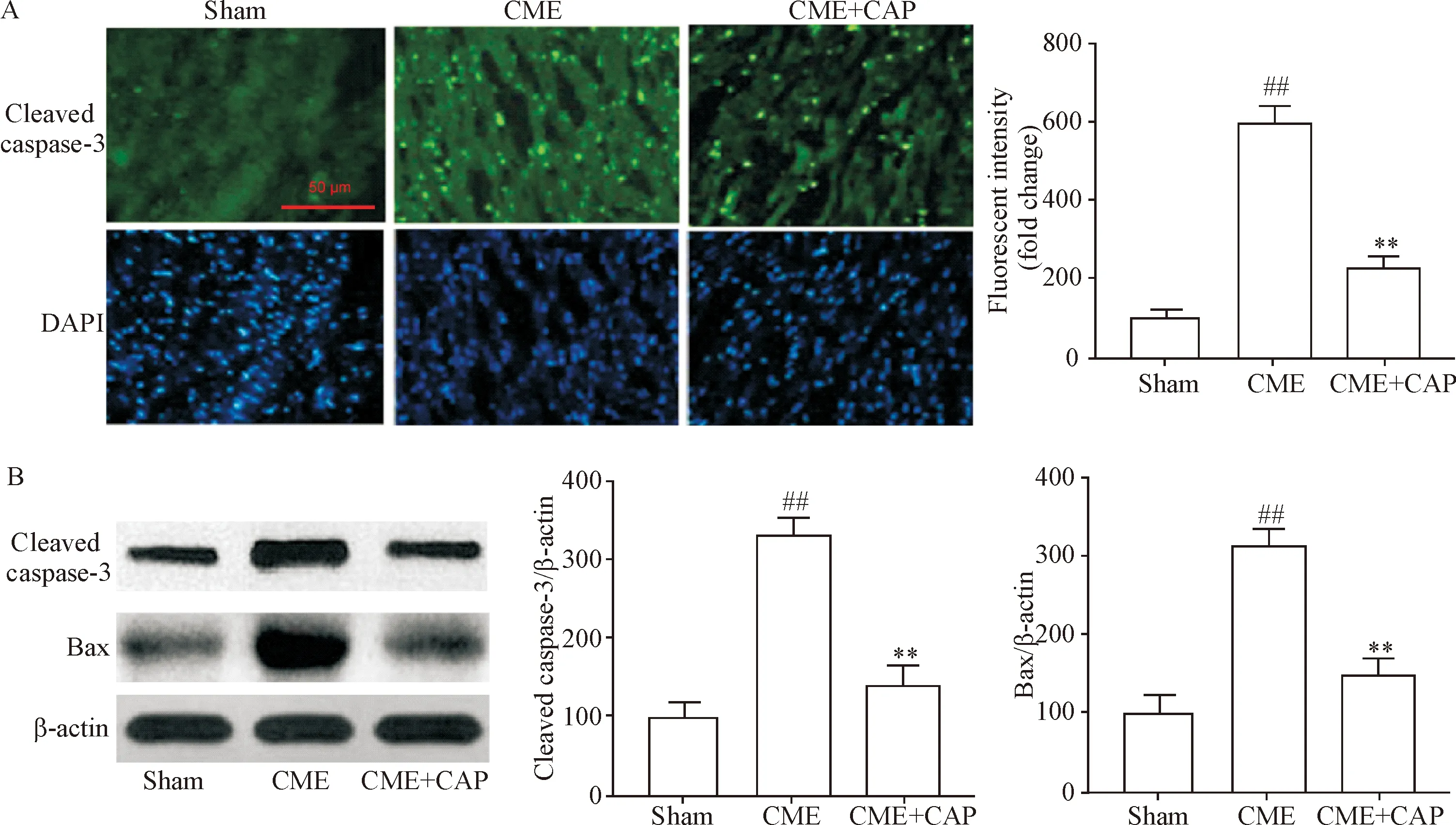
Figure 3.CAP inhibited the expression of cleaved caspase-3 and Bax induced by CME in myocardial tissue. A: representative immunofluorescence images and quantification of fluorescence intensity of cleaved caspase-3 in cardiomyocytes (scale bar=50 μm); B: representative Western blot images and quantification of protein levels of cleaved caspase-3 and Bax in different groups. Mean±SD.n=6.##P<0.01vssham group;**P<0.01vsCME group.
图3 CAP抑制CME诱导的心肌cleaved caspase-3和Bax蛋白表达
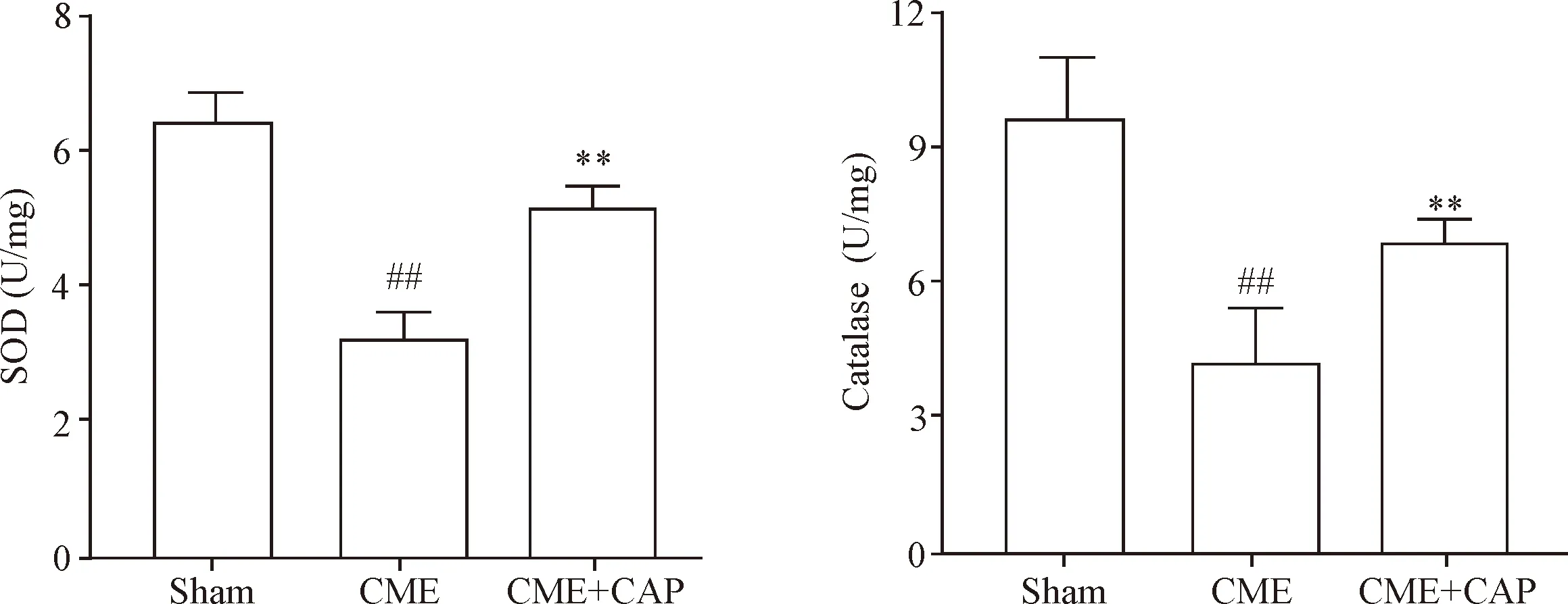
Figure 4.Effects of CAP on SOD and catalase activity in myocardial tissues under CME condition. Mean±SD.n=6.##P<0.01vssham group;**P<0.01vsCME group.
图4 CAP对冠脉微栓塞后心肌SOD和过氧化氢酶活性的影响
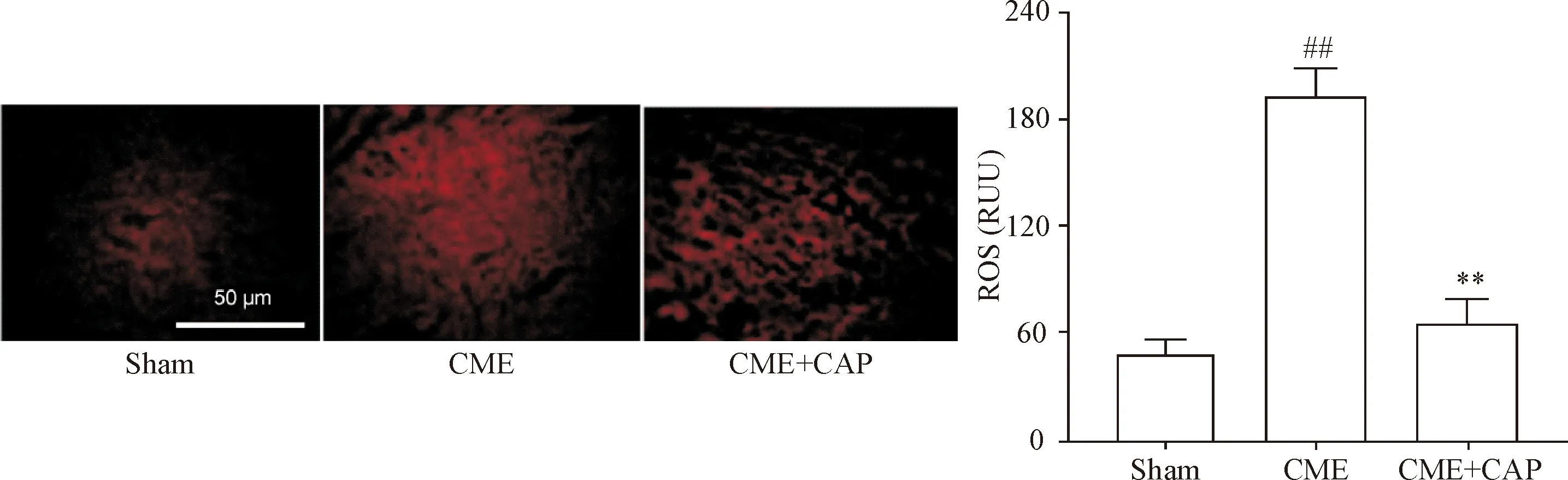
Figure 5.CAP inhibited the levels of ROS induced by CME in myocardial tissues. The scale bar=50 μm. Mean±SD.n=6.##P<0.01vssham group;**P<0.01vsCME group.
图5 CAP抑制CME诱导的心肌ROS水平

