浓香型酒曲贮存时间对白酒发酵的影响
□ 石永凌 唐胜春 方 辉 四川剑南春集团有限责任公司
制曲是白酒酿造工艺中的重要环节。无论是传统工艺发酵还是新工艺白酒生产,酒曲的质量都直接决定着发酵的好坏以及产品质量的优劣。随着现代检测设备的发展和检测手段的多样化,以及白酒酿造工艺水平的不断提高,对制曲工艺也提出了新的要求。目前行业内浓香型大曲的检测方法和检测标准还是具有一定的通用性,方法上分别通过感官辨别成品曲断面情况、菌丝分布形状、曲砖色泽香味,理化指标上分别通过曲砖水分、酸度、糖化力、液化力、发酵力酯化力等性能指标的检测来对酒曲的质量进行综合判定。从多年实际生产情况来看,目前这种传统经验与理化数据结合的辨别方法虽然已比较成熟,能够满足现阶段酿酒生产对成品酒曲质量检测的基本需要。但仍摆脱不了传统酿造白酒质量不够稳定、生产工艺调整难度较大的情况。因此,要相对稳定的酿造出玉液琼浆,单从现行的酿造工艺上讲,还需要进一步完善制曲工艺条件[1-3]。
俗话说“糟为酒体,曲为酒骨”,可见酒曲在白酒酿造中的重要作用。谈到酒曲就离不开制曲工艺,什么才是完善的制曲工艺?怎样才能生产出“优质酒曲”?对于这些问题,行业内已做过大量的研究报道。但具体存放多久的酒曲更有利于现代酿酒生产的使用?不同存放时间的酒曲对白酒发酵有哪些影响?对产品风味质量又有哪些影响?很多新老工艺员仅知道新曲入库后,必须要存放一段时间后才能使用,但往往缺乏系统性研究[2-3]。
本实验通过对模拟发酵程度和代谢产物的研究,逆向分析酒曲贮存时间对白酒生产发酵的影响,以及产品风格特征的变化规律。为何要通过模拟生产发酵进行逆向研究?因为浓香型酒曲在复杂的窖池环境中,影响因素较多,其发酵过程又相对缓慢,发酵周期长也是其特点之一。过去大量研究结果表明,单一对浓香型大曲进行研究,往往不具备生产实用性[4-7]。再则虽同为浓香型白酒生产企业,但由于原料配比、制曲工艺、白酒发酵工艺与产品风格特征等条件仍存在着差异,使得各白酒企业对成品曲的使用标准略有不同[8]。因此,通过发酵结果进行逆向研究,可以客观的反映不同贮存时间的浓香型酒曲在对整个发酵过程中的影响。该研究方法具有一定的通用性和参考价值。
1 材料与方法
1.1 材料
优质浓香型酒糟、同批次生产不同贮存时间的优质浓香型大曲。混合粮(即大米、糯米、玉米、高粱和小麦)。
1.2 试剂
稀硫酸(1 mol/L),氢氧化钠溶液(1 mol/L),氢氧化钠溶液(0.1mol/L),无水乙醇(AR)。
1.3 主要仪器
超低温冷冻箱;7890型气相色谱仪;液相色谱仪;高精密度密度计(测量酒精度);高压灭菌锅;生化培养箱;近红外分光光度计;无菌室(净化级别一万级);高精度电子天平;2 500 mL发酵瓶;发酵栓;温度计;可循环冷凝水系统;1 000 mL电热套;1 000 mL长颈蒸馏烧瓶;纱布;长颈玻沙漏斗(直径60 mm);橡皮塞若干以及玻璃弯管。
1.4 实验方法
1.4.1 超低温冷冻状态下酒曲样品的性能测试
取同一批酒曲样品分12份,每份3个平行样,抽真空放入-80 ℃超低温冷冻箱中保存。每月拿出1份进行曲药理化性能测试和微生物数量测试。
1.4.2 自然老熟酒曲样品的性能测试
取同批酒曲样品分12份,采用传统自然老熟方法贮存,每月取出一份,每份3个平行样,做曲药理化性能指标和微生物数量测试。
1.4.3 实验用酒曲样品的采集与保存
采集同一批次优质成品大曲,进行常温保存,从第一月开始,每月分别取其中一份抽真空-80 ℃低温保存,其余酒曲仍留在原有曲房常温贮存。先后12个月共取12个样品,备用。
1.4.4 模拟生产发酵实验
发酵瓶用高压湿热灭菌锅121 ℃下,灭菌15 min。发酵栓用75%的酒精浸泡2 h。风干,冷却备用。将发酵原料(发酵母糟分别和12份酒曲样品混合)装入发酵瓶中。装瓶时,需根据实验要求调整发酵原料松紧程度,要求每个样品除酒曲不同外,其他条件完全一致。用发酵栓将发酵瓶封口,插入温度计,并在发酵栓中添加2 mL浓H2SO4,隔绝空气。用石蜡将发酵栓再次密封。最后,将整个发酵装置放入生化培养箱中,根据实验要求控温培养。
1.4.5 实验室蒸馏
将实验所需的玻璃仪器用稀硫酸浸泡,然后再用氢氧化钠溶液浸泡,最后用纯净水洗净,并烘干;向1 000 mL蒸馏烧瓶中加入500 mL纯净水和若干沸石,放入电热套中。准确称取300 g发酵后的酒糟,混匀后均匀放入长颈玻沙漏斗中;然后将1 000 mL电热套、1 000 mL长颈蒸馏烧瓶、长颈玻沙漏斗(直径60 mm)、玻璃弯管、冷凝管(24 mm标口)、橡皮塞与可控温冷凝水循环系统接上;打开电热套蒸馏,开始时调节电热套电压为220 V,当蒸馏烧瓶中纯净水开始沸腾并出现水蒸气后,调整电热套电压为100 V;打开冷凝水循环开关,调节循环冷凝水温度为15 ℃,进行接酒。用50 mL量筒接50 mL酒样后停止蒸馏,对馏出酒样通过添加无水乙醇提高酒度进行色谱分析。
1.4.6 测定方法
对蒸馏样品进行气相色谱分析:Agilent6890GC,色谱柱为HPINNOWAX,检测器温度280 ℃,进样口温度260 ℃,分流比为20∶1,程序升温条件为40 ℃保持8 min,再以5 ℃/min的速度升至100 ℃,再以15 ℃/min的速度升至220 ℃,保持8 min;糟醅样品通过近红外分光光度计进行测定;酒精度通过精密密度计进行检测。
2 结果与分析
2.1 超低温冷冻保存酒曲和自然贮存酒曲的性能测试
2.1.1 低温干燥条件下贮存酒曲的理化性能指标和微生物数量
低温干燥条件下贮存酒曲在各个月份的理化性能指标和微生物数量见表1、图1。
如表1和图1所示,在低温干燥环境下的酒曲,各种理化性能变化不大,微生物数量也无明显的变化。
2.1.2 自然条件下贮存酒曲的理化性能指标和微生物数量
自然条件下贮存酒曲的理化性能指标和微生物数量见表2、图2。
如表2和图2所示,在曲房自然条件下贮存酒曲的各种理化性能和微生物数量,相对低温干燥密闭贮存条件下的变化比较明显。自然条件下贮存的酒曲,除水分、酸度会随着空气湿度、温度、细菌总数等因素的变化而波动外,其他各种理化性能指标和微生物数量,都会随着酒曲贮存时间的增加而降低。其中霉菌的数量会在4个月后大量减少,细菌总数在5、6个月后也会明显减少。酵母数在成品酒曲相对干燥的条件下略有降低,但总体趋于平稳。
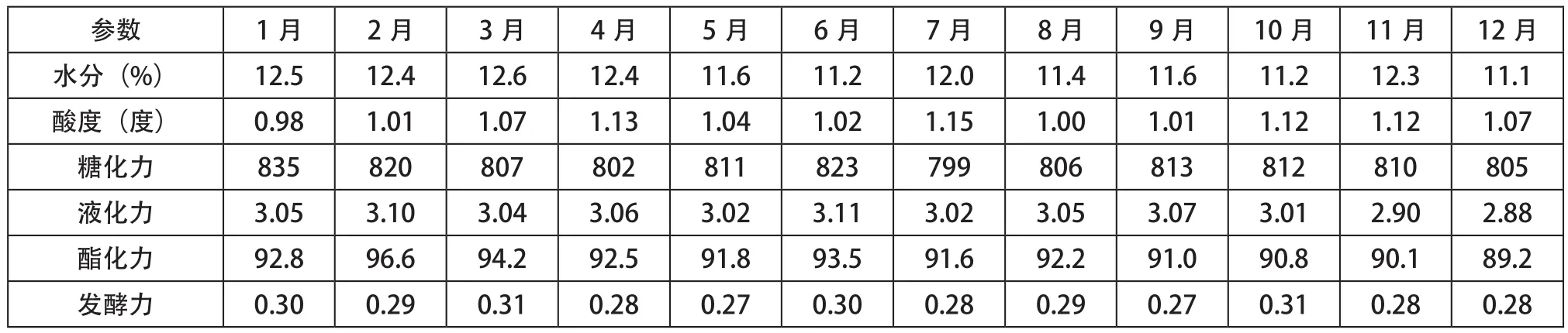
表1 低温干燥状态下酒曲各月份的理化性能指标

图1 低温干燥状态下酒曲微生物数量变化曲线
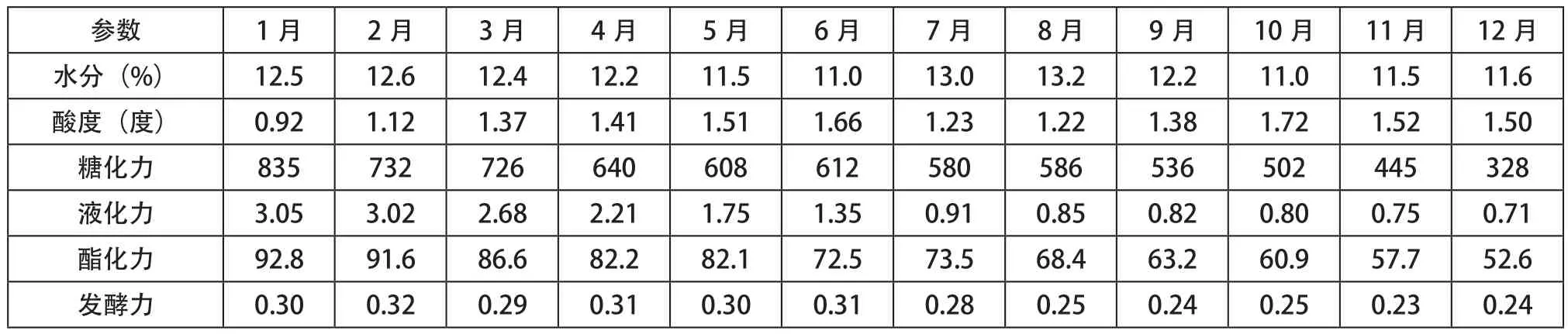
表2 自然条件下贮存酒曲各月份的理化性能指标

图2 自然条件下贮存酒曲微生物数量的变化曲线
2.1.3 酒曲同一性选择
由以上数据并根据实验同一性,想要采用不同贮存时间的同一酒曲,使用同一糟赔,又要同期发酵是不可能实现的。如果采用分批发酵的方法,由于间隔周期太长,发酵母糟的同一性又无法保障。但直接采用不同批次酒曲进行同期生产试验,往往导致实验结果不具备参考价值。因此,从以上实验结果可以看出,采用低温冷冻干燥贮存方法可保证曲药性能在较长时期内相对稳定,从而达到后续模拟生产发酵实验的同一性要求。
2.2 模拟生产发酵实验
模拟生产环境,分别采用不同贮存时间的酒曲进行同期发酵、蒸馏,并对蒸馏酒样中微量香味成分进行分析对比。由于微量香味物质种类繁多,以浓香型白酒中主要几种香味物质的变化为例,如表3。

表3 采用不同贮存时间酒曲发酵生成的微量香味成分
2.2.1 出酒率的变化规律
如图3所示,发酵母糟中的酒精含量,会随着酒曲贮存时间的不同而改变。酒曲贮存时间在2个月以上时,出酒率增加到最大值。酒曲贮存时间在7个月以上时,出酒率明显下降,但稳定在一个固定区间内。
2.2.2 微量香味物质的变化情况
使用不同贮存时间酒曲发酵的酒中,主要酯类物质含量变化如图4所示。酸类物质变化趋势如图5所示,醇类物质变化趋势见图6,醛、酮类物质含量变化见图7。
如图4所示,几种主要酯类物质的含量整体上会随酒曲贮存时间的增加而减少,其中乙酸乙酯的含量下降最快,前8个月下降最为明显,9个月以后稳定在一个固定区间。己酸乙酯的含量在酒曲贮存前3个月有上升趋势,3、4个月含量最高,后期缓慢降低。而乳酸乙酯和丁酸乙酯的下降较为缓慢。
如图5所示,乙酸的含量会随酒曲贮存时间的增加而降低,前7个月降低幅度较大,8、9个月后相对稳定。而己酸和丁酸会随酒曲贮存时间的增加而略微升高。
醇类物质的变化规律如图6,除正丙醇会随酒曲贮存时间先升高后降低外,异丁醇和异戊醇含量变化规律并不明显。
如图7所示,醛、酮类物质含量随酒曲贮存时间的改变变化较大。特别是乙缩醛和3-羟基-2-丁酮的含量在3,4个月后大量下降,7个月后相对稳定。乙醛含量3个月前略微升高,4,5个月后又略微降低。而其他酮类物质呈现略微上升趋势。

图3 不同贮存时间酒曲发酵的酒精含量变化趋势

图4 使用不同贮存时间酒曲发酵的几种主要酯类物质含量变化
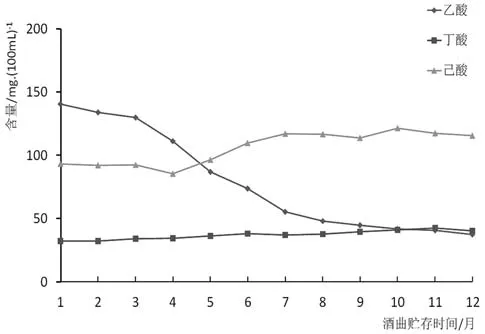
图5 使用不同贮存时间酒曲发酵几种主要酸类物质含量变化

图6 使用不同贮存时间酒曲发酵几种主要醇类物质含量变化
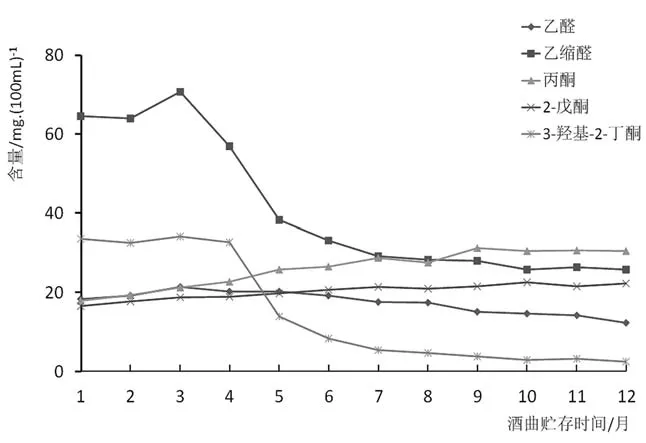
图7 使用不同贮存时间酒曲发酵几种主要醛、酮类物质含量变化
3 结论
通过模拟发酵实验结果可以看出,酒曲的贮存时间主要影响酒曲中各种群微生物的含量和比例,以及各种酿酒功能性酶的活性。
从各种微生物含量上看,在相对干燥的自然贮存过程中,酒曲中各种微生物含量均会随贮存时间的增加而减少。其中细菌和霉菌的变化较大,前6、7个月会大量减少,而7、8个月后数量下降相对缓慢。酵母数量在成曲入库后变化较小。
单从模拟发酵结果上看,各种群微生物含量比例的改变,直接影响出酒率和酒体的风格特征。使用贮存时间在3个月内的酒曲,因醋酸菌含量较高,不仅发酵初期升温较快,对酵母和霉菌的增殖具有抑制作用,导致白酒发酵不正常,出酒率较低,而且发酵初期代谢产物中乙酸含量较高,使得酒体中乙酸乙酯的含量大量增加,醛、酮类物质含量也高,严重影响高品质白酒的生产。使用贮存期在8个月以上的酒曲,由于酿酒功能性酶的活性逐渐减弱,出酒率和酯化能力也逐渐降低。同时贮存时间较长,带来的酒曲损耗也将增大,资金回收周期也相应的增加。在此特别需要注意的是,对模拟发酵结果的分析,仅代表的是一种研究方法和变化规律。因各白酒企业自身的工艺特点、贮存室条件、气候条件、季节变化和产品质量要求很难完全一致。在选择合适的酒曲贮存期时,不应固定在单一的数字上。例如,春季和夏季生产的酒曲,由于季节变化,在相同的贮存时间内,其各种群微生物含量和比例是不同的。又例如,机械制曲与人工制曲,尽管用相同的原料进行同批次发酵,成曲中各种群微生物含量和比例也可能不同。因此,建立酒曲微生物指标,并根据实际生产需要科学选择贮存时间,才是降低诸多客观因素对生产发酵的影响最行之有效的办法。
从产品质量要求上看,使用不同贮存时间的酒曲发酵,不仅可以从工艺上对发酵过程进行调整,还能从发酵源头对产品中各种香味成分的比例进行控制。根据各种性能指标和微生物指标,可单独使用达到生产使用标准的酒曲;也可将多批次不同贮存时间的酒曲按比例混合使用,从而实现除勾调以外,另一种可直接调整产品风格特征的工艺手段,丰富了现代企业发展对高品质产品的质量要求。
4 讨论
综上所述并结合生产实践进行讨论,对于采用“低温入窖,缓慢发酵”方法的浓香型白酒的生产,目前大多数酒企在酒曲的用量上是否过量?从实验结果来看,当酒曲的基本性能在企业标准范围内时,酒曲中酵母含量的多少和酿酒功能性酶活力的高低,在白酒生产发酵过程中对出酒率和酯化力的影响是较小的。但从酒曲的基本性能上看,却差异很大,因此本实验提出疑问,实际生产用曲量是否早已满足生产发酵的要求。另一方面,从微生物含量变化的结果上看,是否可以简单的将酒曲的贮存过程,直接看作是功能性菌群自然纯化的过程?就实际生产而言,对酒曲中各种微生物含量比例的控制,是否才是通过酒曲提升白酒优质品率的关键要素?因此,在现有酒曲标准的基础上,根据各企业制曲工艺特点,结合自身产品的风格特征,建立适合自身白酒发酵的微生物指标,可能会是最终确定酒曲贮存时间,完善酒曲质量标准的重要研究方向,为高品质白酒酿造提供技术方法与质量保障。

