不同阶段ApoE-/-小鼠动脉粥样硬化炎症差异基因表达的比较研究*
于永慧, 董瑞红, 2, 刘剑刚△, 张大武, 王承龙△
(1中国中医科学院西苑医院心血管病中心, 北京 100091; 2北京市门头沟区中医医院, 北京 102300)
以动脉粥样硬化(atherosclerosis,AS)为病理基础的心脑血管疾病已成为危害人类健康的主要原因之一。Satterthwaite等[1]对因冠状动脉狭窄而导致缺血性心脏病和扩张型心肌病患者的冠状动脉组织进行了基因芯片分析,发现包括白细胞介素(interleukin-1β,IL-1β)和IL-8在内的361个炎症基因存在差异表达,说明炎症反应在AS病理过程中扮演必不可少的角色。本课题组前期在ApoE-/-小鼠典型的AS病变部位发现了与脂质堆积、炎症反应和免疫应答等生物过程相关且随时间推移而衍化的病理学证据[2],即ApoE-/-小鼠在5~6周龄时单核细胞开始黏附于损伤的主动脉内皮,8~10周龄时脂质条纹逐渐形成,18~20周龄可见主动脉根部有富含泡沫细胞的AS纤维斑块出现。
抗炎症反应是目前防治AS的主要手段。但是以往的研究多集中在某个固定时段AS与炎症反应的关系,而AS的病理过程是处于不断变化中的,针对AS不同阶段的炎症病理特征制定个性化的防治策略将是更为妥当的疾病应对方式。故而本研究采用Agilent基因芯片技术对ApoE-/-小鼠AS不同时期炎症差异基因进行筛选和验证,同时探讨其在不同病理阶段的表达方式,以期为临床治疗以AS为病理基础的疾病提供阶段性靶向治疗的药理依据。
材 料 和 方 法
1 动物
雄性清洁级ApoE-/-小鼠60只,相同遗传背景C57BL/6J野生型小鼠20只,体重(18~20)g,由北京华阜康生物科技股份有限公司提供,合格证号为SCXK(京)2009-0004和SCXK(京)2009-0007。小鼠购置后在中国中医科学院西苑医院实验动物中心饲养。室内温度(23~25)℃、湿度(50~70)%、光照和通风条件均符合规定标准。ApoE-/-小鼠喂养高脂饲料(含脂肪21%和胆固醇0.15%),C57BL/6J野生型小鼠以普通饲料喂养。
2 实验仪器
G2505C型扫描仪、G2545A型杂交炉、G2939A型生物分析仪和2100型9600振荡器(Agilent);NanoDrop 2000型超微量分光光度仪(Thermo Electron);9700型实时荧光定量RT-PCR检测仪(Life Technologies ABI);5418型离心机和5301型浓缩仪(Eppendorf);XMTD-8222型电热恒温培养箱(上海精宏实验设备有限公司生产)。
3 实验试剂
单色低起始量快速扩增标记试剂盒(批号5190-2305)、基因表达杂交试剂盒(批号5188-5242)、基因表达清洗包(批号5188-5327)、RNA提取试剂盒(批号5188-5282)、基因芯片Package 20 backings,8 HD arrays per slide(G2534-60015)和基因芯片Package 20 backings,4 arrays per slide(G2534-60012)和QIAGEN RNeasy® Mini Kit(批号74106)购自安捷伦科技(中国)有限公司;反转录试剂(PrimeScriptTMRT Master Mix Perfect Real Time,批号 RR036A)由日本TaKaRa公司生产;荧光定量试剂(LightCycler® 480 SYBR Green I Master,批号 04887352001)购自Roche。
4 实验方法
4.1动物分组 将ApoE-/-小鼠随机分为初期AS组(10周龄)、早期AS组(15周龄)和后期AS组(25周龄)3组,每组20只。相同遗传背景相应周龄的C57BL/6J野生型小鼠20只作为空白对照(control)组。小鼠达到相应周龄后麻醉,打开腹腔及胸腔,沿脊柱确定主动脉位置,分离主动脉弓,液氮保存,每组选取5只用于基因筛选,剩余15只用于基因表达验证。
4.2芯片杂交 提取组织块中的总RNA,以合成的cDNA双链为模板合成cRNA,采用QIAGEN RNeasy® Mini Kit过柱纯化。cRNA质控采用分光光度计在260 nm和280 nm测定吸光度(A)值,以A260/A280接近2.0为较纯的cRNA。纯化后将每组样本的cRNA等量混合,采用Agilent表达谱芯片配套试剂盒对cRNA进行放大和标记,QIAGEN RNeasy® Mini Kit纯化。在滚动杂交炉中65 ℃,10 r/min杂交17 h。完成杂交的芯片进行洗片后,采用分辨率为5 μm的Agilent扫描仪以100%和10% PMT各扫描1次。最后利用Feature Extraction 软件(Version 10.7.1.1, Agilent Technologies)处理原始图像,提取原始数据,GeneSpring软件(Version 12.5,Agilent Technologies)进行标准化和后续处理。
4.3RT-qPCR 验证 对筛选出的差异表达基因经功能注释找出与炎症反应相关的基因,采用RT-qPCR对基因芯片结果进行验证。利用TRIzol提取总RNA,NanoDrop 2000分光光度计测定浓度及A260/A280,琼脂糖凝胶电泳检测RNA完整性。目标基因的引物及探针序列根据GenBank数据库,采用Roche LCPDS2 软件进行设计(上海捷瑞生物工程有限公司合成)。差异基因的引物序列见表1。利用LightCycler® 480 SYBR Green I Master 试剂盒在LightCycler® 480 Ⅱ型荧光定量PCR 仪上进行反应。荧光定量PCR循环条件为:95 ℃ 10 min;95 ℃ 10 s、60 ℃ 30 s,40个循环。循环结束后利用熔解曲线检测产物特异性:从60 ℃缓慢升温至97 ℃,每 ℃采集5次荧光信号。基因的相对表达量采用2-ΔΔCt法计算。

表1 不同周龄ApoE-/-小鼠差异基因验证的引物序列
5 统计学处理
芯片数据中差异基因的筛选标准为P≤0.05且fold change值≥2.0。RT-qPCR检测结果采用SPSS 18.0软件进行统计分析,数据资料以均数±标准差(mean±SD)表示,进行正态分布和方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA)或非参数检验,以P<0.05为差异有统计学意义。
结 果
1 RNA样品的质量鉴定
20个样本RNA质检结果合格。提取的总RNA经NanoDrop 2000型超微量分光光度仪测定显示,A260/A280在2.13±0.07之间,提示cRNA纯度良好。对样品进行变性琼脂糖凝胶电泳显示,18S和28S条带清晰可见。RNA完整性(RNA integrity number,RIN)检测显示,所有RNA样品条带清晰,RIN≥7且28S/18S≥0.7,表明RNA完整性良好,未被RNA酶降解,符合基因表达谱研究的实验要求,可用于下一步实验。
2 差异基因的筛选
采用Agilent小鼠全基因组表达谱芯片检测不同周龄ApoE-/-小鼠主动脉弓组织RNA表达,结果显示,芯片扫描图标记清晰、荧光分布致密均匀,杂交状况良好。将4组样本的芯片扫描图进行组间对照,计算t检验差异显著性P值和标准化信号的差异倍数fold change值。差异基因的筛选标准为P≤0.05且fold change≥2.0,进而得到不同周龄ApoE-/-小鼠的差异基因个数,见表2。对上述组间比较进行整合分析,计算组间共同或者特异表达的差异基因个数,结果显示,与对照组相比,ApoE-/-小鼠显著变化的差异基因为:10周龄895个,15周龄540个,25周龄591个。
表2 不同周龄ApoE-/-小鼠之间差异基因表达个数
Table 2.The numbers of differential expression genes in different weeks ofApoE-/-mice

No.ComparisonUp-regulatedDown-regulatedTotal110W vs 15W8934111 304210W vs 25W2 3791 8844 263310W vs control4 7383 5968 334415W vs 25W1 9751 9033 878515W vs control4 1453 0907 235625W vs control3 2221 6524 874
W: weeks.
采用火山图展示组间差异基因表达强度的分布情况,可见与对照组相比,不同周龄ApoE-/-组差异基因数量显著增多;10W与25W、15W与25W、10W与15W相比,前者显著差异基因表达量较少。
3 差异基因的生物信息学分析
3.1差异基因的GO分析 通过NCBI和UnitProt公共数据库查阅AS相关炎症基因信息,GO分析显示,10W与25W的差异基因数最多,为131个,10W与15W的差异基因为42个,15W与25W的差异基因为57个。各组差异基因GO分子功能主要涉及炎症因子活性、脂质代谢、基质金属蛋白酶、巨噬细胞清道夫受体等,见表3。
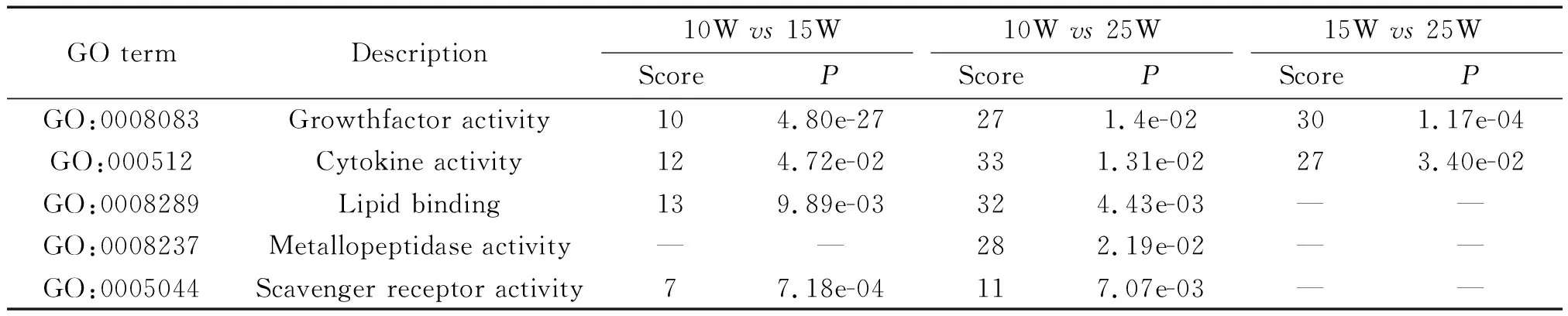
表3 不同周龄ApoE-/-小鼠主动脉弓组织差异表达基因的GO分子功能
W: weeks.
3.2炎症差异基因的筛选 对涉及GO分子功能的差异基因进行整理,剔除重复后共计筛选基因140个。去除目前无文献报道与AS炎症反应有关的基因后,依据其差异倍数排序,最终选定5个候选目标差异基因,见表4。

表4 不同周龄ApoE-/-小鼠主动脉弓组织炎症差异基因
4 RT-qPCR验证结果
通过RT-qPCR方法检测不同周龄ApoE-/-小鼠主动脉弓内IL-12a、IFN-γ、MMP12、GDF-15和IL-1β的mRNA表达量变化,结果显示,与对照组比较,10W和25W小鼠的IL-12a表达水平显著上(P<0.05),且10W IL-12a表达显著高于25W(P<0.01),而15W小鼠的IL-12a表达显著下降(P<0.05);15W和25W小鼠IFN-γ表达较对照组有所上升,但差异无统计学意义(P>0.05);各个周龄小鼠的MMP-12表达量较对照组均有上升,10W和25W有显著差异(P<0.05),其中25W MMP-12上调更为显著(P<0.01);15W和25W周龄小鼠GDF-15表达较对照组有所上升,差异有统计学意义,且25W GDF-15表达显著高于15W(P<0.01);各个周龄小鼠的IL-1β表达量较对照组均有下降,且10W和15W有显著差异(P<0.05),15W IL-1β下调更为显著(P<0.01),见图1。
另外以对照组为参考值,根据Mean Express计算ApoE-/-小鼠在10W、15W和25W时5个差异基因的变化情况,并作出趋势图。根据基因表达趋势的不同,可分为持续上升型(IFN-γ和GDF-15)和折线型(IL-12a、MMP-12和IL-1β)。10W、15W和25W 的IFN-γ和GDF-15表达量依次递增,因而其基因表达趋势呈持续上升型。而15W的IL-12a、IL-1β和MMP-12表达量较10W和25W低,处于基因表达趋势线的谷底,使IL-12a、IL-1β和MMP-12呈现折线型的基因表达趋势,IL-12a在10W和MMP-12在25W分别达到谷峰,见图2。
讨 论
在炎症因子随时间变化趋势的研究中,C反应蛋白(C-reactive protein,CRP)、IL-6、MCP-1、TNF-α和IL-1β等显示出随AS病变进展逐渐升高的趋势。李嵘娟等[3]利用超声生物显微镜检测ApoE-/-小鼠在8、16、24和32周龄的主动脉根部内中膜厚度(intima-media thickness,IMT)和CRP水平,发现IMT和CRP水平随着周龄而增加,与AS病变严重程度呈现正相关关系。孙婷婷等[4]发现12、14、16和18周龄

Figure 1.RT-qPCR was used to detect the mRNA expression of differential inflammatory genes in different weeks ofApoE-/-mice. Mean±SD.n=15.*P<0.05,**P<0.01vscontrol group.
图1 不同周龄ApoE-/-小鼠炎症差异基因mRNA表达的RT-qPCR定量

Figure 2.The differential expression tendency of the inflammatory genes in different weeks ofApoE-/-mice.
图2 不同周龄ApoE-/-小鼠炎症差异基因的表达趋势图
ApoE-/-小鼠IL-6、MCP-1和TNF-α表达均呈上升趋势,且周龄之间比较有统计学差异。荆文等[5]检测1、2、3月龄ApoE-/-小鼠主动脉中11个特定炎症相关基因的时序表达特点,发现ApoE-/-小鼠与同龄WT小鼠相比,1、2、3月龄时IL-1β的mRNA表达水平均显著上调,同时1月龄时VCAM-1、IкB-α、TGF-β和SOD1,2月龄时PDGF-α和CD36,3月龄时TNF-α和MMP-2的mRNA表达水平与同龄WT小鼠相比均显著上调。陈冰[6]等观察ApoE-/-小鼠外周血单核细胞Mo及其亚型Ly6chi在4、8、12和16周龄的比例变化,发现表达单核细胞趋化蛋白1受体CCR2,并分泌TNF-α、IL-6等炎症因子的炎症型Ly6chi表型仅在8周龄时升高,具有免疫保护功能的Mo表型在4周即高于同周龄C57BL/6J小鼠,8周龄开始有所下降并持续至16周。提示天然免疫系统可能在AS病变8周龄时开启炎症反应的高峰。徐芳[7]等观察不同周龄ApoE-/-小鼠血管外膜成纤维细胞的表型变化,发现10周龄和15周龄ApoE-/-小鼠的血管外膜成纤维细胞呈现vimentin阳性,部分α-SMA阳性,且15周龄α-SMA的表达高于10周龄,提示15周龄时ApoE-/-小鼠血管外膜成纤维细胞转化为肌成纤维细胞,导致血管外膜胶原沉积、管壁增厚等病变,促进AS病灶的形成和发展。
本研究发现在10W、15W和25W存在显著性变化的、既往研究中未曾报道的差异炎症因子,并最终选择表达量最高的5个炎症因子(IL-12a、IFN-γ、MMP12、GDF-15和IL-1β)进行了RT-qPCR验证,并根据其基因表达趋势的不同,分为持续上升型(IFN-γ和GDF-15)和折线型(MMP-12、IL-12a和IL-1β)。持续上升型表达的炎症因子IFN-γ和GDF-15参与的炎症反应促进AS中后期病程的进展,体现了AS炎症反应逐渐加重的特点。其中,IFN-γ属于II型干扰素,主要通过诱导促炎症因子如TNF-α、IL-6、氧自由基和MMPs的产生、促进CD4+T细胞抗原呈递等过程参与AS炎症反应,并且通过上调ACAT-1表达增强胆固醇酯的合成、激活STAT-1/ABC途径减少胆固醇的流出参与AS脂代谢调节。GDF-15是稳定性AS疾病的独立危险因素之一,GDF-15≥1200 ng/L的稳定性冠心病患者继发心血管事件和十年死亡率显著上升[8]。Bonaterra等[9]发现GDF-15可以通过诱导IL-6的表达水平来促进AS的进程。本研究显示,IFN-γ和GDF-15基因表达随着AS病程的进展而呈持续上升趋势,尤其是在15W和25W等AS中后期表达显著增高。这说明以IFN-γ和GDF-15为代表的持续上升型炎症因子促进和加剧了AS炎症反应和脂质代谢紊乱。
折线型表达的炎症因子参与AS其他病理特征,如IL-12a主要在早期AS过程中发挥炎症诱导作用,而MMP-12和IL-1β主要参与形成后期具有不稳定特点的AS斑块,体现了参与AS炎症因子的复杂性和多样性。其中,IL-12a在AS的早期阶段促进AS炎症反应中的Th1细胞免疫,并诱导分泌IFN-γ和TNF-α等多种炎症因子的表达。Davenport等[10]观察到在AS后期45周龄时敲除ApoE-/-小鼠IL-12a并不影响AS的进展。MMP-12则能够降解ECM成分,并激活其他MMPs(如MMP-2、MMP-3等)。Morgan等[11]发现MMP-12在破裂的AS斑块中含量显著増高,Johnson等[12]将ApoE-/-小鼠的MMP-12基因剔除或加用MMP-12抑制剂RXP470.1[13]后发现,头臂干AS斑块减少并呈现出相对稳定的形态。IL-1β主要刺激炎症细胞产生其他炎症因子及酶类,与TNF-ɑ和CD40-L共同降解纤维帽加强AS斑块不稳定性,并且活化血小板、抑制纤溶,促进破裂部位血栓的形成,影响溶栓效果。本研究发现,IL-12a在ApoE-/-小鼠10W的表达量显著升高,提示IL-12a在AS早期炎症反应中发挥促进和诱导作用。MMP-12和IL-1β在ApoE-/-小鼠15W表达下降,10W和25W表达升高,从侧面印证了AS病变斑块从早期不稳定到中期相对稳定,而到后期又变为不稳定的动态衍变过程。因此,抑制MMP-12和IL-1β等导致AS斑块不稳定的炎症基因,可能会使不稳定的AS病变趋于稳定。
ApoE-/-小鼠的动脉粥样硬化过程是一个随时间不断变化的动态病理结果,本研究在差异表达的基因中发现25WApoE-/-小鼠较10W和15W差异基因表达相对增多,体现了AS随时间进展而病理改变愈发复杂的倾向。包括IL-12a、IFN-γ、MMP-12、GDF-15和IL-1β在内的众多炎症因子参与其中,呈现或持续上升、或波动性的变化趋势,反映了AS过程中炎症因子相互作用、相互影响、相互制约的复杂网络关系,从而导致AS斑块的发生发展甚至出现不良心血管事件。

