发酵优化制备L-赖氨酸盐酸盐-13C6、15N2
侯静华,刘占峰,杜晓宁,宋明鸣
(上海化工研究院有限公司 上海稳定同位素工程技术研究中心,上海 200062)
近年来,随着稳定同位素示踪技术的发展及质谱等检测手段的不断完善,蛋白质组学、代谢组学、精准医疗等研究的需要以及其他相关科学的快速发展,13C标记、15N标记以及13C、15N双标记的氨基酸得到越来越广泛的应用。13C、15N稳定同位素标记的氨基酸在生物医学、定量蛋白质组学等研究如SILAC(stable isotope labeling with amino acids in cell culture)应用中具有高通量、同位素标记效率高、灵敏度高等优势,也用来示踪测定氨基酸代谢的各类动态参数、蛋白质的合成速率及结构等[1]。可见开发稳定同位素多标记氨基酸新品种势在必然。2018年第1期《Nature Protocols》报道,13C、15N双标记的L-赖氨酸等可进行复杂蛋白质组的分析[2],因此,开发13C、15N双标记的L-赖氨酸很有意义。
L-赖氨酸(lysine)的化学名称为2,6二氨基己酸,在医药、食品、饲料工业等方面有着广泛的应用。L-赖氨酸是人体和动物所不能合成的8种必需氨基酸中最重要的一种,最初从蛋白质水解物中分离得到,之后其制备方法又出现了化学合成法、酶法。1960年日本首先使用发酵法生产,我国于20世纪60年代中期开始进行赖氨酸菌株选育和发酵研究。目前,L-赖氨酸的工业化生产方法主要有蛋白水解法、化学合成法和微生物发酵法[3-5],世界约2/3的赖氨酸企业采用发酵法生产L-赖氨酸。而对于制备稳定同位素标记的L-赖氨酸,最适合的方法是微生物发酵法。
关于13C、15N双标记的L-赖氨酸盐酸盐的应用文献不少,但制备方面鲜有文献报道。本研究利用L-赖氨酸产生菌之北京棒杆菌(Corynebacteriumpekinense)以发酵法研制13C、15N双标记的L-赖氨酸盐酸盐,得到了高丰度的双标记产品,丰度及收率都较高,有望继续用以扩大制备。
1 实验材料
1.1 实验菌株
L-赖氨酸产生菌ZLD118(HS-、AECr),由北京棒杆菌(Corynebacteriumpekinense)As1.563选育而来,本实验室保藏。
1.2 培养基
斜面培养基:蛋白胨10 g/L,牛肉膏10 g/L,NaCl 5.0 g/L,葡萄糖5.0 g/L,琼脂20 g/L,pH 7.0~7.2,121 ℃灭菌20 min。
种子培养基:葡萄糖25 g/L,硫酸铵5 g/L,K2HPO41.0 g/L,MgSO40.25 g/L,玉米浆5~10 mL/L,pH 7.0~7.2,115 ℃灭菌20 min。
发酵培养基: 葡萄糖130 g/L,硫酸铵40 g/L,MgSO40.25 g/L, K2HPO41.0 g/L,生物素500 μg/L,盐酸硫胺500 μg/L,高丝氨酸0.20 g/L,玉米浆10 mL/L,MnSO4·4H2O 0.02 g/L,FeSO4·7H2O 0.02 g/L,CaCO330 g/L,pH 7.0~7.2,115 ℃灭菌 15 min。
1.3 主要试剂
D-葡萄糖-13C6,丰度99%,美国进口;(15NH4)2SO4,丰度99.14%,上海化工研究院有限公司出品。其他主要试剂为生化级或分析纯级,由国药集团上海化学试剂有限公司及上海凌峰化学试剂有限公司出品。
1.4 主要仪器
ZHWY-1112型恒温振荡器:上海智城分析仪器厂;RE-2000B型旋转蒸发仪:上海亚荣生化仪器厂; PB-21酸度计:赛多利斯公司;756MC型分光光度计:上海精密科学仪器有限公司;SBA-40C型生物传感仪:山东省科学院生物研究所;LCMS 2020液质联用仪:日本岛津公司;MAT-271型气体同位素质谱仪: 德国Finnigan公司。
2 实验方法
2.1 菌种的斜面培养
将菌种转接至活化斜面,32 ℃活化培养20~24 h。
2.2 种子培养
将新鲜活化后的斜面菌体一环接入装有20 mL种子培养基的250 mL三角瓶中, 32 ℃,200 r/min培养12~16 h。
2.3 发酵培养
将培养好的种子液接入发酵培养基,装液量为500 mL三角瓶装25 mL,32 ℃,200 r/min震荡培养96 h。
2.4 分析方法
1) pH测定:用精密pH试纸和pH计测定。
2) 葡萄糖测定:采用SBA-40C型生物传感仪。
3)L-赖氨酸测定:定性测定用纸层析法[6]。定量测定用酸性茚三酮比色法[7]:发酵液离心后取上清液0.1 mL稀释至100 mL, 吸取1 mL稀释液加入4 mL茚三酮试剂于试管中, 沸水浴加热20 min, 快速冷却后用756型分光光度计在478 nm处比色。根据标准曲线确定发酵液中L-赖氨酸产量。
4) 产品纯度分析:HPLC法和LC-MS法。
5) 产品丰度分析:MAT-271型质谱仪测定,微量转化法。
3 结果与讨论
菌体的发酵培养受多个发酵条件、多种发酵因素的影响。本研究将对发酵培养条件、发酵培养基配方通过一系列条件实验进行优化。对发酵培养条件中的种子培养时间、发酵初始pH、发酵装液量、发酵温度等对菌种产酸的影响进行条件实验;对发酵培养基配方中的葡萄糖、硫酸铵、高丝氨酸、碳酸钙等成分,通过正交实验来确定最佳配比。
3.1 发酵培养条件的优化
3.1.1种子液培养时间
种子培养时间即种龄,是指种子液中培养的菌体开始移入下一级种子瓶(罐)或发酵瓶(罐)时培养时间。选择适当的种龄非常重要,太年轻或过老的种子都对发酵不利。一般选择种龄在对数生长期后期,即培养液中菌浓接近高峰时所需的时间为宜[8]。
实验选取新鲜活化斜面菌种一环于(20 mL/250 mL三角瓶)种子培养基中,30 ℃、200 r/min 震荡培养,每隔一定时间取样,稀释20倍后用756MC型分光光度计于620 nm、光程1 cm测量OD620值,结果示于图1。由图1可知,赖氨酸产生菌在培养4 h后即开始进入对数生长期,在培养16 h后基本达到对数生长末期,之后即进入稳定生长期。因此选取种子培养12~16 h。
3.1.2发酵培养基初始pH对产酸的影响
pH是代谢活动的综合指标,其变化会影响各种酶活、菌对基质的利用速率和细胞的结构,从而影响菌的生长和产物的合成,尤其是在产氨基酸的微生物中pH的影响非常重要[9]。本研究将发酵培养基的pH调节在6.8~7.2,等间距设了4个点,发酵结果列于表1。
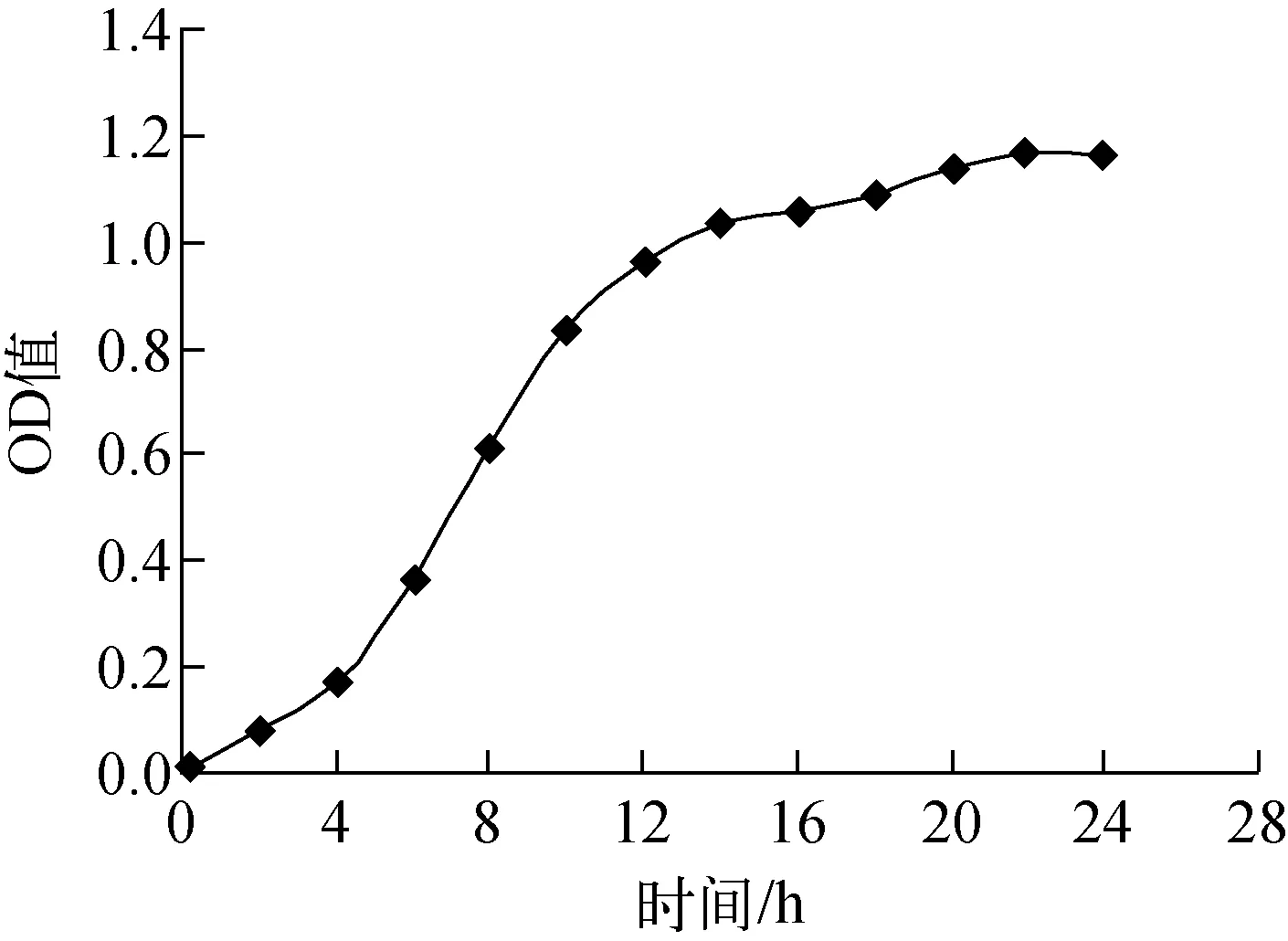
图1 ZLD118生长曲线Fig.1 The growth curve of ZLD118

pH 6.87.07.27.4Lys.HCl/(g·L-1)39.8745.5647.9342.49
注:产量以赖氨酸的盐酸盐计(Lys.HCl)
由表1可见,pH 6.8时产酸最低,pH 7.0产酸上升明显,pH 7.2产酸继续上升,到pH 7.4产酸下降,因此,较佳的发酵初始pH为 7.0~7.2。pH过高过低都会影响菌体的生长、酶的活性以及引起菌体代谢途径的改变,进而影响目的产物的生成。因此本株L-赖氨酸产生菌的发酵培养基初始pH以7.2为最佳。
3.1.3不同瓶子的装液量对发酵的影响
摇瓶发酵过程的供氧主要取决于装液量和转速,L-赖氨酸产生菌是好氧微生物,只有当培养液中溶解氧浓度大于菌的临界浓度,菌体呼吸才能得到满足。在赖氨酸发酵过程中当氧供给能满足菌体的呼吸,产酸量即可达到最大值。针对实验室不同品种的500 mL三角瓶,为找出不同瓶子对发酵的差异性,得到优选的瓶子及装液条件,进行不同瓶子的装液量发酵实验,结果列于表2。
由表2结果知,装液量对发酵产酸的影响较大,不同瓶子间不同装液量的产酸差异更大。3种规格的瓶子“GG17”和“95”在结构尺寸上非常接近,瓶子高度、瓶口内径、瓶底外径都一样,唯一不同的是瓶颈高度“GG17”比“95”高13 mm,而“华鸥”的瓶子4个尺寸比另外2个都小,达不到L-赖氨酸产生菌供氧的要求,所以产酸最低。而“GG17”瓶颈比“95”高,供氧更好,因此产酸最高。20 mL装液量时通风量大,菌体生长快、耗糖过快,而30、35 mL装液量下则通风量过小,菌体生长慢且不足,耗糖也慢,两者明显影响菌株的产酸率。25 mL装液量的通风量较为适宜,因此任何一种瓶子的25 mL装液量产酸都最高,而GG17瓶子不管在何种装液量条件下在3种瓶子中产酸都最高,故最终采用GG17瓶子25 mL装液量的发酵条件。

表2 不同瓶子的装液量对L-赖氨酸发酵的影响Table 2 Effect of medium volumn on L-Lysine fermentation for different flask
3.1.4发酵温度对产L-赖氨酸的影响
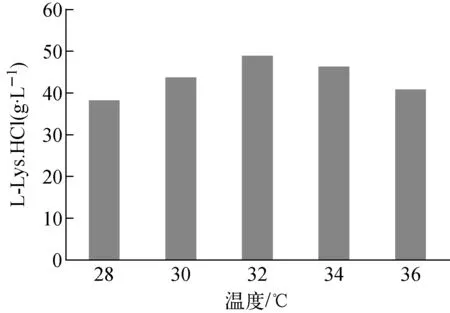
图2 温度对L-赖氨酸产量的影响Fig.2 Effect of temperature on L-Lysine production
温度会影响各种酶活,直接影响发酵过程的反应速率,并且还通过改变发酵液的物理性质而间接影响产物的合成。本研究分别采用5个不同的培养温度28、30、32、34、36 ℃来考察温度对菌株ZLD118的L-赖氨酸产量的影响(图2)。
由图2结果可知,当温度从28 ℃递增到32 ℃时,L-赖氨酸的产量随着温度的升高而逐渐增加,温度为32 ℃时,L-赖氨酸产量达到最大值;随着温度的进一步上升,L-赖氨酸产量有所降低,而36 ℃比34 ℃更低。当温度低于30 ℃时,可能因菌体生长缓慢,使得L-赖氨酸产量下降;温度高于34 ℃,即可能因为温度升高使酶反应速率加大、生长代谢更快,导致生产期缩短,也可能因为酶本身过热失活,导致菌体衰老发酵周期提前而改变最终产量。由此,选择32 ℃为最佳发酵温度。
3.2 发酵培养基的优化
本发酵培养基由于要用来制备13C、15N双标记的产品,因此碳源采用葡萄糖、氮源采用硫酸铵,是为了分别可以用13C、15N标记碳源、氮源原料。发酵培养基中的重要成分为葡萄糖、硫酸铵、高丝氨酸和碳酸钙,拟通过正交试验确定配比。


表3 L9(34)正交实验表及结果Table 3 L9(34) orthogonal list and the result of test
在该最佳条件下进行验证试验,Lys.HCl产量达到48.97 g/L,证实了A3B2C2D2为最佳组合条件,将用于稳定同位素13C、15N高丰度发酵以制备产品。
3.3 高丰度实验及产品的表征
3.3.1高丰度实验及结果
根据上述试验获得的较佳发酵条件,配制13C、15N双标记高丰度发酵培养基进行高丰度实验,并对所得发酵液进行分离提取精制得到双标记的高丰度产品。
发酵培养结束后,将发酵液调pH至4左右进行离心,上清液上732铵型树脂柱,水洗后用0.10 mol/L的氨水溶液洗脱,自动收集L-赖氨酸单斑洗脱液,真空浓缩赶氨。赶氨完毕,加水溶解成溶液,用盐酸调pH至4.9~5.0,加活性炭脱色,所得滤液经真空浓缩至有结晶开始析出即加入乙醇结晶。结晶液冷藏过夜,经抽滤得到白色晶体, 60 ℃真空干燥,得到L-赖氨酸盐酸盐-13C6、15N2产品,结果列于表4。

表4 高丰度实验结果Table 4 Results of high abundance fermentation and extraction
由表4可知,产品13C、15N的丰度值都很好,丰度下降值小尤其是13C的丰度下降更小,纯度达98.47%,后续工作提高菌种产酸,优化相关工艺条件并适当放大将有更好的市场竞争力。
3.3.2产品表征
13C、15N双标记L-赖氨酸盐酸盐高丰度产品的HPLC及LCMS谱图示于图3。
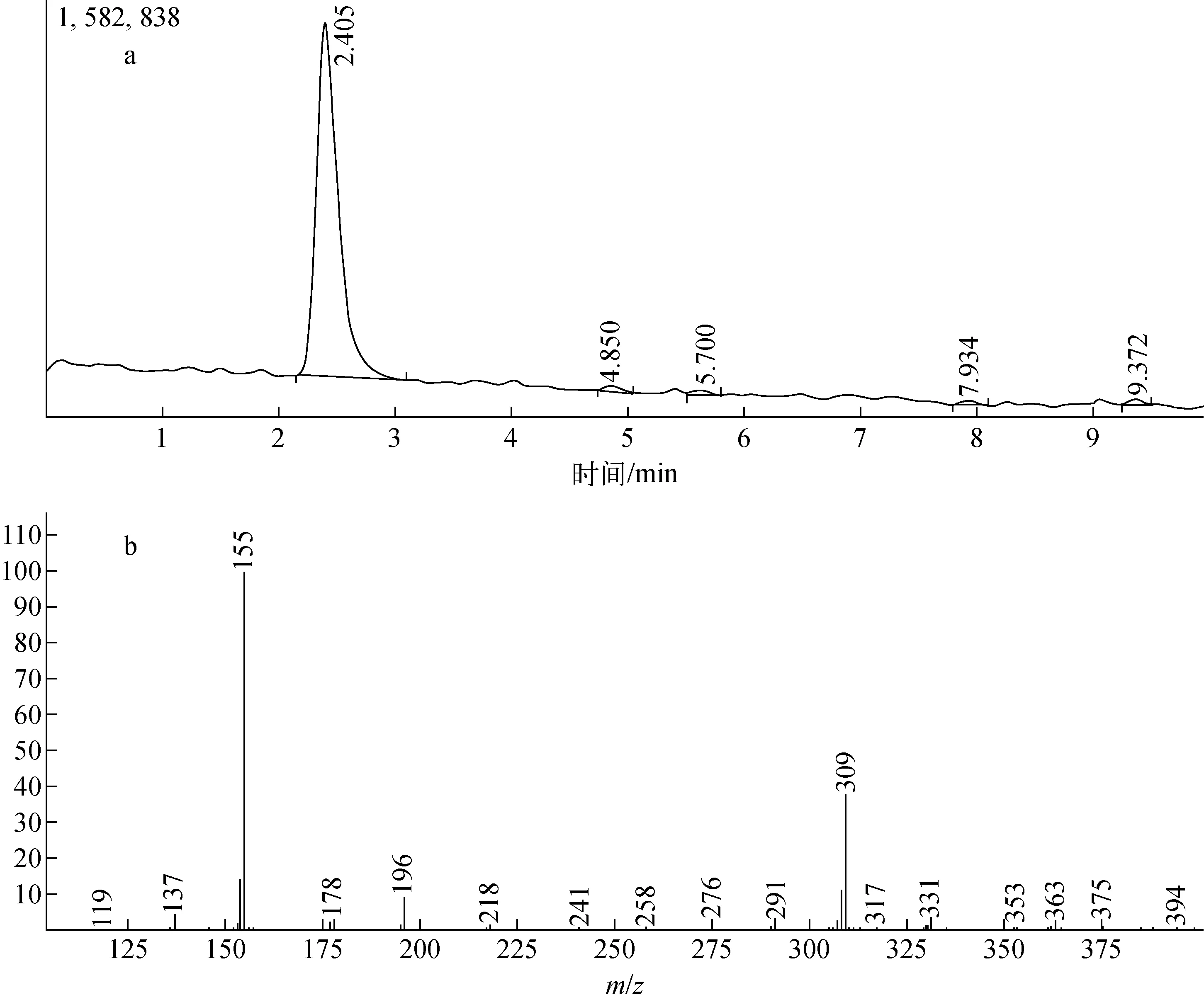
a——HPLC;b——LCMS图3 L-Lys.HCl-13C6、15N2的液相色谱、质谱图a——HPLC;b——LCMSFig.3 HPLC and MS of L-Lys.HCl-13C6、15N2
本产品的纯度经HPLC检测为98.47%,丰度经同位素质谱仪检测分别为98.61%13C,98.15%15N。LCMS测L-Lys的相对分子质量146,L-Lys-13C6、15N2的相对分子质量154,故显示的分子离子峰为154,在正离子模式下分子离子峰为155,为目标产物。
4 小结
通过条件优化实验,获得了较佳的发酵工艺条件并制备了稳定同位素13C、15N双标记产品。经过高丰度发酵实验并对发酵液进行提取精制,产品13C、15N双标记-L-赖氨酸盐酸盐的13C和15N丰度分别为98.61%和98.15%,纯度为98.47%,产率达88.8%,取得了较好的结果。关于用发酵法制备13C、15N双标记的L-赖氨酸盐酸盐还未见有文献报道,产品的13C丰度仅下降0.39%,如再对菌种进行技术处理提高产酸率,以及继续优化发酵培养条件,将使产品的技术指标进一步提升。

