通腑泄热方对脓毒症大鼠肺功能与外周血T淋巴细胞亚群的影响
许志恒 李宏贵 巢阳发
摘要 目的:探究通腑泄熱方对脓毒症大鼠肺功能与外周血T淋巴细胞亚群的影响。方法:选取SPF级SD大鼠120只,随机分成6组,分别为空白对照组、假手术组、模型组、中药低剂量组、中药高剂量组、中药中剂量组,每组20只,空白对照组大鼠常规喂养,假手术组大鼠行开腹、取出盲肠后放回腹腔并缝合切口的操作,模型组与中药组大鼠行盲肠结扎穿孔术制作脓毒症模型。各中药组大鼠分别于造模成功后6 h、18 h、30 h、42 h给予相应剂量汤剂灌胃。观察48 h后各组大鼠一般情况,并取大鼠动脉血检测外周血T淋巴细胞亚群并进行血气分析。结果:假手术组大鼠各数据指标与空白对照组比较,差异无统计学意义(P>0.05),而模型组死亡率明显高于空白对照组,差异有统计学意义(P<0.05),采用中高剂量通腑泄热方灌胃干预可提高大鼠生存率;模型组大鼠外周血中CD3+、CD4+、CD8+细胞的表达水平较空白对照组低,差异有统计学意义(P<0.05);中药低剂量组大鼠外周血中CD3+、CD4+、CD8+细胞的表达水平与模型组比较,差异无统计学意义(P>0.05);中药中剂量组与高剂量组大鼠CD3+、CD4+、CD8+细胞的表达水平高于模型组,差异有统计学意义(P<0.05);模型组PaO2明显低于空白对照组,差异有统计学意义(P<0.05),PaCO2则明显升高,差异有统计学意义(P<0.05);中药低剂量组大鼠PaO2明显高于模型组,差异有统计学意义(P<0.05),PaCO2则较模型组明显降低,差异有统计学意义(P<0.05);中药中剂量组与中药高剂量组大鼠PaO2明显高于模型组,差异有统计学意义(P<0.05),PaCO2则明显降低,差异有统计学意义(P<0.05),但2组间数据比较,差异无统计学意义(P>0.05)。结论:通腑泄热方可有效保护脓毒症大鼠肺功能,降低脓毒症相关性肺损伤,并在一定剂量范围内起到调节外周血T淋巴细胞亚群水平的作用。
关键词 脓毒症;T淋巴细胞亚群;肺功能损伤;通腑泄热方;大鼠
Abstract Objective:To investigate the effects of Tongfu Xiere Decoction on lung function and peripheral T lymphocyte subpopulations in septic rats.Methods:A total of 120 SPF SD rats were randomly divided into 6 groups:the blank control group,the sham-operation group,the model group,the low-dose Chinese medicine group,the high-dose Chinese medicine group and the medium-dose Chinese medicine group,with 20 rats in each group.The blank control group rats were only fed routinely.Rats in the sham-operation group were only laparotomized,had their caeca removed and placed back into the abdominal cavity,and the incisions sutured.The sepsis models were established by cecal ligation and perforation in the model group and the Chinese medicine groups.The rats in each TCM group received gavage of decoctions at the corresponding dose 6 h,18 h,30 h,42 h respectively after successful model establishment.After 48 hours,the general condition of rats in each group was observed,their arterial blood was sampled for the detection of the peripheral blood T lymphocyte subpopulations,as well as for the blood gas analysis.Results:Compared with the blank control group,there was no statistical significance between the sham-operation group and the blank control group(P>0.05),while the mortality of the model group was significantly higher than that of the blank control group(P<0.05).The gavage intervention of high-dose Tongfu Xiere Decoction could improve the survival rate of rats; the expression levels of CD3+,CD4+,CD8+ cells in the model group were lower than that in the blank control group(P<0.05).The expression levels of CD3+,CD4+ and CD8+ cells in peripheral blood of rats in the low-dose group presented no statistical significance compared with those in the model group(P>0.05).The expression levels of CD3+,CD4+,CD8+ cells in the middle-dose group and the high-dose group were higher than those in the model group(P<0.05); the PaO2 level in the model group was significantly lower than that in the blank control group(P<0.05),while the PaCO2 level was significantly increased(P>0.05).The level of PaO2 was significantly higher in the low-dose group than that in the model group(P<0.05),while the level of PaCO2 was significantly lower than that in the model group(P>0.05).The PaO2 levels of the middle-dose Chinese medicine group and the high-dose Chinese medicine group of were significantly higher than that of the model group(P<0.05)while the PaCO2 levels were significantly lower(P>0.05),but no statistical significance was shown between those 2 groups(P>0.05).Conclusion:Tongfu Xiere Decoction can effectively protect the lung function of septic rats to reduce sepsis-related lung injury,and it plays a role in regulating the level of T lymphocyte subpopulations in peripheral blood within a certain dose range.
Key Words Sepsis; T lymphocyte subsets; Pulmonary function impairment; Tongfu Xiere Decoction; Rats
中图分类号:R289.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.05.024
脓毒症(Sepsis)发病过程中由于致病微生物及其裂解或分泌的毒素在机体内蓄积,可直接损伤机体组织细胞[1],并引发全身性炎性反应综合征(System Inflammatory Response Syndrome,SIRS),大量炎性细胞被激活并释放大量炎性反应递质入血,导致炎性反应失控并间接损伤机体脏器组织[2],随着病情发展可出现多器官衰竭综合征、脓毒性休克等,临床脓毒症相关性死亡率高达28%~50%[3]。而在脓毒症早期,往往先出现脓毒症相关性急性肺损伤与急性呼吸窘迫综合征,是导致患者死亡的主要原因之一[4]。临床研究表明,脓毒症所诱导的全身性炎性反应并不仅仅是大量释放炎性反应递质,随着脓毒症发展可出现T淋巴细胞凋亡,机体出现免疫抑制后无力清除体内感染病菌,也是脓毒症死亡的主要原因[5-6]。中医强调辨证论治治疗脓毒症疗效好,本研究所用通腑泄热方具有清热解毒、攻里通下之功效,临床治疗脓毒症患者效果显著,但关于该方剂对机体免疫功能的报道研究较为少见,故本实验选用本院常用汤剂通腑泄热方对脓毒症大鼠进行干预,并观察该方剂对脓毒症大鼠外周血T淋巴细胞亚群的影响,探究其对脓毒症相关性肺损伤的保护作用。
1 材料与方法
1.1 材料
1.1.1 动物
选取SPF级雄性SD大鼠120只(由广州中医药大学实验动物中心提供,实验动物生产许可证SCXK(粤)2008-0020)体质量150~210 g,干预前进行适应性饲养1周,实验前1天晚上停止喂食,自由饮水。
1.1.2 药物
按照成人组方用量配制通腑泻热方,主要方剂组成:虎杖30 g、地胆草30 g、生大黄10 g、芒硝10 g、山栀子10 g、龙胆草5 g、忍冬藤15 g、莱菔子10 g,除芒硝外,其余中药分别用水浸泡30 min,其余六味后加热煎煮30 min,大黄后下,煎煮沸腾后滤取煎液,复渣再次煎液合并,纳入芒硝并加湿充分溶解。纱布过滤,滤液水浴蒸发浓缩至含生药1、2、4 g/mL 3种不同的剂量后放置4 ℃冰箱保存备用。
1.2 方法
1.2.1 分组与模型制备
选取SPF雄性大鼠120只,随机分为6组,每组20只,分别为空白对照组、假手术组、模型组,空白对照组除常规喂养外不做任何干预,假手术组只行开腹、取出盲肠并放回后关腹的操作。大鼠术后均在大鼠背部皮下注射生理盐水以补充手术中大鼠体液丢失,并起到抗休克的作用。模型组大鼠制备步骤SD大鼠经腹腔注射10%水合氯醛35 mg/kg麻醉后腹部剃毛消毒,铺无菌洞巾。沿腹正中线作1.5 cm切口,沿着回肠找到盲肠,在盲肠根部进行结扎,结扎长度约0.8 cm,避免结扎回肠盲肠以及系膜血管。用18G注射器针头贯通穿刺盲肠2次,并用5-0缝合线穿过系好,防止针孔闭合。将盲肠还纳腹腔,逐层缝合腹壁切口,术毕。立即动物皮下注射生理盐水10 mL/kg以补充术中体液丢失并抗休克。术后禁食8 h,自由饮水。
1.2.2 给药方法
中药组大鼠分别按成人(60 kg体质量)剂量转换系数为0.018,于造模后6 h,18 h,30 h,42 h给予4.5 g/(kg·d)中药灌胃。其余3组则在相应时间点给与生理盐水灌胃。
1.2.3 檢测指标与方法
记录各组大鼠生存情况后,对各组存活大鼠均采用腹腔注射40 mg/kg水合氯醛麻醉后,沿着腹正中线切口进入腹腔并用手术钳推开腹腔小肠后暴露腹主动脉,采集5 mL腹主动脉血后分离血浆,外周血T淋巴细胞亚群则将血液样本处理有采用细胞流式仪进行检查。并取动脉血行血气分析检测。
1.3 统计学方法
采用SPSS 18.0统计软件进行数据分析,其中计数资料以率表示,采用χ2检验,计量单位采用均数±标准差(±s)表示,组间两两比较采用q检验,多组数据间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠生存情况比较
空白对照组大鼠与假手术组大鼠未见大鼠死亡,存活率为100%;手术后48 h,模型组大鼠死亡14只,存活率为30.00%;中药低剂量组大鼠死亡11只,存活率为45.00%,与模型组存活率比较,差异无统计学意义(P>0.05);中药中剂量组与高剂量组均死亡7只,存活率为65.00%明显高于模型组,差异有统计学意义(P<0.05)。
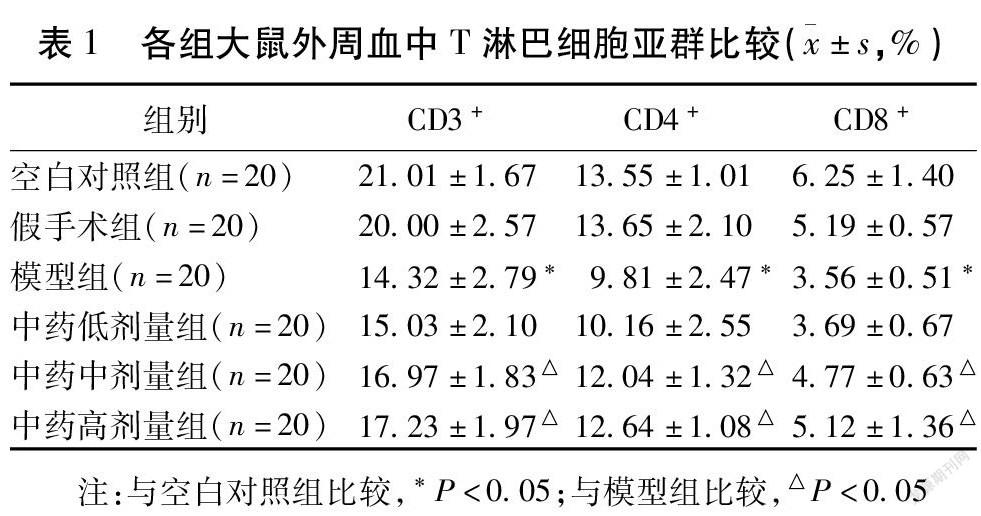
2.2 各组大鼠外周血中T淋巴细胞亚群比较
假手术组大鼠外周血CD3+、CD4+、CD8+细胞的表达与空白对照组比较,差异无统计学意义(P>0.05);模型组大鼠外周血中CD3+、CD4+、CD8+细胞的表达较空白对照组低,差异有统计学意义(P<0.05);中药低剂量组大鼠外周血中CD3+、CD4+、CD8+细胞的表达水平与模型组比较,差异无统计学意义(P>0.05);中药中剂量组与高剂量组大鼠CD3+、CD4+、CD8+细胞的表达高于模型组(P<0.05),但2组间比较差异无统计学意义(P>0.05)。见表1。
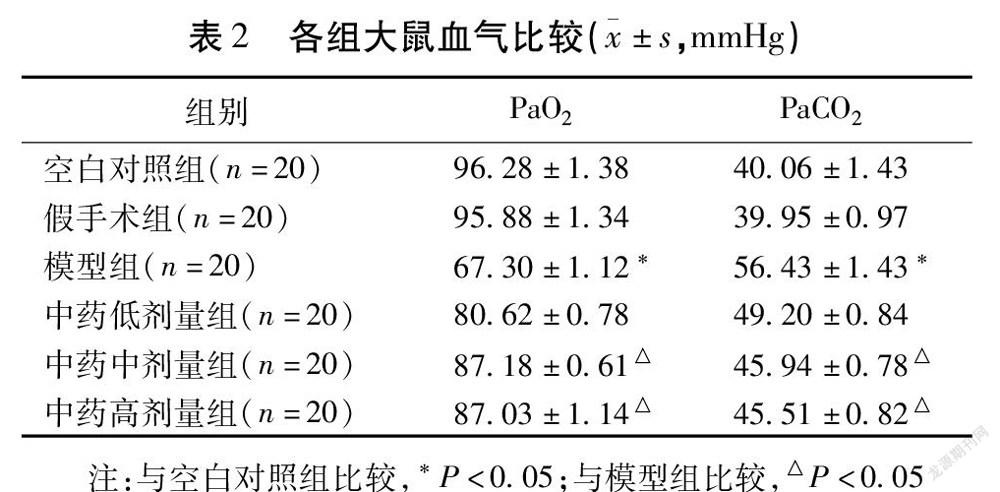
2.3 各组大鼠血气比较
假手术组大鼠的PaO2、PaCO2与空白对照组比较,差异无统计学意义(P>0.05),模型组PaO2明显低于空白对照组,差异有统计学意义(P<0.05),PaCO2则明显升高(P>0.05);中药低剂量组大鼠PaO2明显高于模型组,PaCO2则较模型组降低,差异有统计学意义(P<0.05);中药中剂量组与中药高剂量组大鼠PaO2明显高于模型组,PaCO2则明显降低,差异有统计学意义(P<0.05),但2组比较差异无统计学意义(P>0.05)。见表2。
3 讨论
现代临床生理病理研究发现机体免疫系统对脓毒症的应答可而分为2个部分,早期高炎性反应期与后期免疫抑制期[7]。时间较短的高炎性反应时期,在这个时期机体固有免疫成员参与并产生强烈的免疫应答[8],大量活化的巨噬细胞、中性粒细胞等向肺部募集,并产生大量的炎性反应递质损伤肺部细胞,并产生组织炎性反应[9-10],但并不是单纯的促炎性反应,同时还有相应抗炎反应以减弱炎性反应递质的作用,唐荣等[11]通过观察脓毒症及脓毒症急性肾损伤患者外周静脉血T淋巴细胞亚群的水平变化,发现脓毒症及脓毒症急性肾损伤患者存在着不同程度的细胞免疫失衡,表现为循环CD3+T、CD4+T细胞百分比和CD4+T/CD8+T比值的下降。故可认为肺部T淋巴细胞亚群的变化是导致肺部发生继发性损伤的主要因素之一。
而中医药复方主要通过多成分、多途径、多靶点、多机制综合复杂调控发挥治疗作用,治疗脓毒症所致的多器官多系统疾病有明显疗效。中医古籍医书中并未有“脓毒症”的记载,而现代医师多根据脓毒症发病时的临床特征将其归类为热毒内蕴、正气内虚、腑实不通、瘀血阻滞等辨证分型[12]。我们通过长时间的观察,内毒外邪入侵是导致脓毒症发病的主要原因,故选取腑泄热方作为研究方剂,该方主要功效有清热解毒、通里攻下[13]。研究结果显示,假手术组大鼠各数据指标与空白对照组比较,差异无统计学意义,说明手术操作并不影响大鼠肺功能与体内T淋巴细胞亚群水平。模型组大鼠外周血中CD3+、CD4+、CD8+细胞的表达水平较空白对照组低,根据造模条件,脓毒症相关性炎性反应高峰应在造模后12 h时,由于选取的时间点为造模后48 h,相当于脓毒症后期,也就是免疫抑制期,该时期模型组PaO2明显低于空白对照组,PaCO2则明显升高,说明肺功能受到明显的损伤。戴凌燕等[14]认为CD4+T淋巴细胞具有抑制中性粒细胞聚集的作用,环节肺部炎性反应,程婷婷等[15]对脓毒性诱导的急性肺损伤小鼠支气管肺泡灌洗液及肺部组织中的促炎性反应递质、趋化因子水平及肺组织髓过氧化物酶活性进行观察,发现B和T淋巴细胞衰减因子可通过激活肺部炎性细胞增加小鼠肺通透性,肺部中性粒细胞募集促使肺细胞凋亡。说明T淋巴细胞在肺部聚集有利于肺的保护作用[16]。但随着机体大量消耗能量物质,代谢负荷加重,大量固有免疫细胞凋亡,这种高强度炎性反应慢慢下降[17],若此时机体免疫系统调节失衡,髓性抑制细胞增加、Treg细胞增殖、免疫细胞耗竭可导致机体进入脓毒症后期免疫抑制期,在这个时期T淋巴细胞受到抑制或程序性死亡,导致机体无力清除体内病原菌,加重脏器损伤[18-19],死亡率大大增加。陈浩等[20]采用祛瘀解毒益气方治疗脓毒症患者胃肠功能障碍,发现方中大黄具有泻热通肠、逐瘀通经,保护肠胃功能的重要作用,降低肠壁血管壁的通透性以防止肠道细菌产生的内毒素进入血液循环中,达到治疗的效果。采用药物干预后虽然中药低剂量组大鼠外周血中CD3+、CD4+、CD8+细胞表达与模型组比较,差异无统计学意义,但中药中剂量组与高剂量组大鼠CD3+、CD4+、CD8+细胞表达高于模型组,且中药给药各组大鼠肺血气指标均较模型组有所改善,说明通腑泄热方可起到明显的肺保护作用,并在一定剂量范围内起到调节T淋巴细胞免疫作用。方剂组成中的生大黄、莱菔子、地胆草、虎杖等诸味中药均有确切的抗菌、抗炎反应[21],刘大全等[22]采用主要组成为大黄、黄芩、白头翁、败酱草的清热解毒方通过抑制致病菌的繁殖而对脓毒症起到治疗作用。且生大黄、芒硝、山栀子具有调节免疫、增加肠蠕动,抑制肠内水分吸收,促进排便的作用,治疗脓毒症相关炎性反应的同时调节肠胃运化功能[22],忍冬藤与龙胆草均有清热解毒,燥湿泻肝的功效,诸药齐下可起到清热解毒、祛湿清邪的功效[23]。
但通腑泄热方中各味药物在体内调节T淋巴细胞的主要作用机制仍不明确,有待进一步深入探究。
参考文献
[1]Pedrazza L,Cubillos-Rojas M,de Mesquita FC,et al.Mesenchymal stem cells decrease lung inflammation during sepsis,acting through inhibition of the MAPK pathway[J].Stem Cell Res Ther,2017,8(1):289.
[2]Yeh LC,Huang PW,Hsieh KH,et al.Elevated Plasma Levels of Gas6 Are Associated with Acute Lung Injury in Patients with Severe Sepsis[J].Tohoku J Exp Med,2017,243(3):187-193.
[3]Yorulmaz H,Ozkok E,Ates G,et al.Investigation of the effectiveness of ghrelin treatment in lung tissue of rats with sepsis[J].Bratisl Lek Listy,2017,118(10):585-590.
[4]Fung AWS,Beriault D,Diamandis EP,et al.The Role of Procalcitonin in Diagnosis of Sepsis and Antibiotic Stewardship:Opportunities and Challenges[J].Clin Chem,2017,63(9):1436-1441.
[5]張人菁,朱璇,周原,等.Toll样受体及T淋巴细胞亚群与脓毒症的关系分析[J].中华医院感染学杂志,2016,26(22):5090-5092.
[6]陈涛,臧彬.脓毒症及脓毒性休克患者T淋巴细胞亚群变化研究[J].临床军医杂志,2017,45(1):46-48.
[7]Jia Y,Wang Y,Yu X.Relationship between blood lactic acid,blood procalcitonin,C-reactive protein and neonatal sepsis and corresponding prognostic significance in sick children[J].Exp Ther Med,2017,14(3):2189-2193.
[8]桂海波,杜晓刚,陈雪梅.T淋巴细胞凋亡在脓毒症患者免疫抑制和预后中的作用[J].重庆医科大学学报,2016,41(7):738-746.
[9]袁远宏,肖政辉,张慧,等.小儿脓毒症T细胞亚群变化分析及临床意义[J].中国当代儿科杂志,2013,15(3):216-218.
[10]李峰,丛涛,李珍,等.缺锌对内毒素/脂多糖所致脓毒症大鼠相关免疫功能的影响[J].中华烧伤杂志,2015,31(5):361-366.
[11]唐荣,钟永,肖舟,等.脓毒症急性肾损伤患者外周血T淋巴细胞亚群变化及意义[J].中国医师杂志,2015,17(3):324-327.
[12]喻文立,崔乃强,傅强等.清热解毒方剂对脓毒症大鼠腸系膜淋巴结免疫功能的影响[J].中国新药与临床杂志,2010,29(9):696-699.
[13]于晶,谢晓华,张子敬.通腑泻热方对外科脓毒症患者降钙素原和免疫功能影响[J].辽宁中医药大学学报,2013,15(12):108-111.
[14]戴凌燕,章义利,程碧环.T淋巴细胞亚群变化与脓毒症发病的关系[J].中华全科医学,2014,12(5):715-716.
[15]程婷婷,白建文.B和T淋巴细胞衰减因子激活在休克/脓毒症诱导的急性肺损伤中的作用[J].中国急救医学,2015,(7):646-650.
[16]穆雪鹍,傅应云,韩雪梅,等.脓毒症患者免疫失衡与疾病严重程度的关系[J].中国急救医学,2012,32(2):120-123.
[17]吴铁军,张丽娜,亢翠翠.Treg/Th17失衡在脓毒症发病机制中的作用[J].中国病理生理杂志,2011,27(12):2411-2413.
[18]王银芳,陈愉生.脓毒症患者免疫失衡与疾病严重程度关系的临床研究[J].福建医药杂志,2015,37(6):104-106.
[19]郑优敏,应亚萍,张凌姿.免疫功能分析对脓毒症病情及预后的评估作用[J].现代实用医学,2017,29(10):1329-1331.
[20]陈浩,张少言,田雨,等.祛瘀解毒益气方对脓毒症患者胃肠功能障碍的影响[J].上海中医药杂志,2013,47(06):50-51.
[21]胡丹丹,杨国良,陈伟.益气凉血化瘀汤对脓毒症大鼠心肌损伤的影响[J].浙江中西医结合杂志,2012,22(11):856-858.
[22]刘大全,高巧营,吴尚为,等.清热解毒方治疗大鼠实验性脓毒症的药效学观察[J].中国实验方剂学杂志,2013,19(16):246-249.
[23]杨静,刘洪斌,李东华.清热解毒方改善脓毒症大鼠脏器功能的比较[J].中国中西医结合外科杂志,2012,18(2):157-160.
(2018-06-28收稿 责任编辑:杨觉雄)

