响应面法优化糯高粱多糖提取工艺及其抗氧化活性分析
尹学伟 王秋月 李清虎 鲁远源 魏灵 张晓春




摘要:【目的】优化糯高粱多糖提取工艺,并分析其抗氧化活性,为糯高粱食品开发利用提供理论依据。【方法】以国窖红1号糯高粱籽粒为材料,在单因素试验的基础上,采用响应面法优化其多糖提取工艺,并测定所提取多糖清除DPPH自由基和羟基自由基的能力。【结果】建立了料液比(X1)、微波功率(X2)和提取时间(X3)与糯高粱多糖提取率(Y)的回归模拟方程:Y=6.43277+0.26425X1+0.89398X2+0.35226X3-0.09537X1X2-0.14083X1X3-0.10898X2X3-1.39713X12-1.35532X22-0.26889X32,回归方程模型极显著(P<0.01),R2=0.999885,方程拟合程度高。糯高粱多糖提取的最佳工艺条件为:料液比1∶400、微波功率480 W、提取时间110 s,在此条件下,得到多糖平均值为6.48%,与预测值(6.68%)相对误差为2.91%。糯高粱多糖的DPPH自由基清除率随多糖质量浓度的增加先增后减,多糖质量浓度为0.4 mg/mL时,清除率最高达54.38%,低于对照2,6-二叔丁基对甲酚(BHT)的清除率;羟基自由基清除率随多糖质量浓度的增加而增加,多糖质量浓度为0.10 mg/mL时达最大值(94.70%),高于相同质量浓度对照BHT的清除率。【结论】采用响应面法优化的工艺条件可用于糯高粱多糖提取,且糯高粱多糖具有较强的抗氧化活性,可用于健康食品开发。
关键词: 糯高粱多糖;提取工艺;抗氧化活性;响应面法
0 引言
【研究意义】高粱(Sorghum bicolor L. Moench)亦称蜀黍,属禾本科高粱属一年生草本植物,自古有“五谷之精”“百谷之长”的称誉,广泛分布于全国各地,重庆、四川等西南地区因其独特的气候条件,是我国糯高粱优势产区(程庆军等,2010;尹学伟等,2014)。糯高粱籽粒除了含有丰富的淀粉外,还富含单宁、原花青素、黄酮、多糖等具有较强抗氧化能力和抑菌活性的物质(Waniska,2000;吴丽等,2014)。多糖是一类具有抗氧化、抗疲劳、抗病毒及调节免疫细胞等多种生物活性功能的高分子化合物,作为构成动植物生命基本物质,其还具有抗凝血、抗血栓、降血糖、降血脂、延缓衰老等特性(吴笳笛,2008;吴春华等,2011;许春平等,2014)。糯高粱籽粒是重要的传统食用杂粮作物,有增强人体免疫、降低人体血糖等功效,随着人民生活水平的日益提高,以糯高粱为原料深加工制成的健康特色食品具有广阔的市场和开发前景(段江莲等,2013)。因此,探讨我国南方糯高粱籽粒中多糖的提取工艺及其抗氧化活性对新型食用高粱食品的开发利用具有重要意义。【前人研究进展】关于高粱多糖,Ramesh和Tharanathan(1999)研究表明,温度对高粱多糖的提取具有较大影响,55或100 ℃有利于多糖提取;Betts等(2015)研究认为,高粱籽粒中除了富含淀粉外,还含有丰富的多糖,且多糖组分间具有明显差异,基因型是影响高粱组分比例的主要因素。在高粱抗氧化活性方面,前人主要集中在酚类、醇类和原花青素等成分研究,王华等(2007)研究得出高粱籽粒提取物总酚含量范围为3.87%~38.87%,不同溶剂条件下提取物的抗氧化能力存在明显差异;张国涛和王华(2011)研究发现,不同种皮颜色高粱的甲醇提取物表现出显著不同的抗氧化活性;Wu等(2011)研究表明,高粱糠原花青素提取物不仅具有较强的抗氧化活性,还具有一定的抑瘤作用;刘睿等(2013)研究表明,不同提取剂对高粱种皮原花青素的提取及其抗氧化能力有一定影响;刘禹等(2013)研究发现,不同溶剂对高粱米中多酚和黄酮含量及抗氧化活性有明显影响,80%丙酮提取物中的多酚和黄酮含量最高,表现出较强的抗氧化能力;张慧芸等(2014)研究发现,高粱提取物中含有丰富的总酚,微生物发酵不仅能增加总酚含量,还使其具有更高的抗氧化活性,并因微生物种类不同而存在差异。【本研究切入点】微波辅助响应面法优化提取工艺技术具有低成本、高效等优点,目前广泛应用于油菜籽(鞠兴荣等,2012)、绿豆(钟葵等,2013)、燕麦麸(赵慧霞,2015)、藜麦(袁俊杰等,2016)等作物的多糖提取,但未见用于提取高粱多糖的研究报道,且关于高粱籽粒多糖抗氧化活性方面的研究也未见相关报道。【拟解决的关键问题】采用响应面法优化微波提取糯高粱籽粒多糖的工艺条件,并测定其抗氧化活性,为南方优质糯高粱食品的综合开发利用提供理论依据。
1 材料与方法
1. 1 试验材料
糯高粱品种为南方主栽品种国窖红1号(四川省农业科学院水稻高粱研究所选育),选取糯高粱籽粒50 g,粉碎,过80目筛,烘干保存备用。主要仪器设备:CEM MARS 6微波消解/萃取系统(美国CEM公司)、SB-5200 DTD超声波清洗机(宁波生物科技有限公司)、MAPADA V-1100D紫外可見分光光度计(上海美普达仪器有限公司)。
1. 2 试验方法
1. 2. 1 糯高粱多糖提取 精确称取试样2 g置于提取容器中,加入20.0 mL 80%乙醇微波提取30 min;过滤掉溶液,用80%乙醇清洗滤渣3~5次,将滤渣再置于洁净的提取容器内,加入一定量纯净水进行微波提取,提取2次,合并滤液待用。
1. 2. 2 单因素试验 选取料液比[1∶200、1∶300、1∶400、1∶500、1∶600(g/mL,下同)]、微波功率(200、250、300、350、400和450 W)和提取时间(20、40、60、80、100和120 s)进行单因素试验,采用1.2.1方法进行糯高粱多糖提取,每组重复3次,根据公式计算多糖提取率:
式中,c为提取的样品液多糖质量浓度(mg/mL),V0为样品液总体积(mL),n为稀释倍数,V为样品测定液体积(mL),m为预处理糯高粱粉质量(g)。
1. 2. 3 响应面试验设计 在单因素试验结果的基础上,采用Box-Behnken试验设计,以料液比(X1)、微波功率(X2)和提取时间(X3)3个因素为自变量,多糖提取率(Y)为因变量进行响应面分析,优化糯高粱多糖提取工艺。响应面试验因素水平设计见表1。
1. 2. 4 糯高粱多糖抗氧化活性分析
1. 2. 4. 1 DPPH自由基清除能力测定 参照Atoui等(2005)的方法测定。取1.0 mL不同质量浓度的多糖水溶液,加入3.0 mL 0.005%甲醇DPPH溶液,30 min后于517 nm波长下比色。空白组用蒸馏水代替样品,对照组用2,6-二叔丁基对甲酚(BHT)代替,每个样品重复3次。
1. 3 统计分析
利用Excel 2003和Design-Expert V8.0进行数据处理并制图。
2 结果与分析
2. 1 单因素试验结果
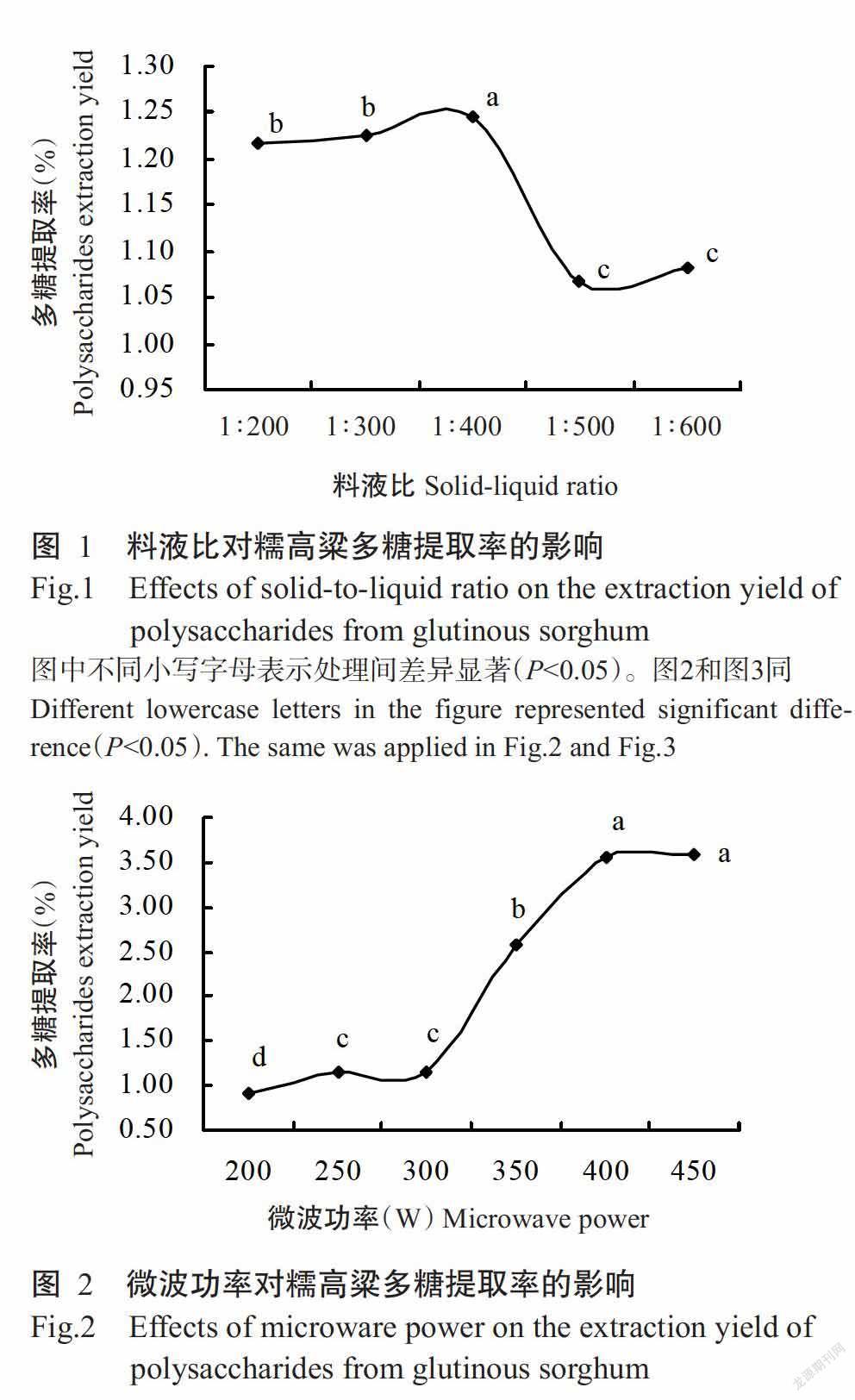
2. 1. 1 料液比对糯高粱多糖提取率的影响 由图1可知,在微波功率300 W、提取时间60 s的条件下,随着料液比的减小,糯高粱多糖提取率总体呈先升高后降低的变化趋势,料液比在1∶200~1∶400时多糖提取率增加缓慢,1∶400之后,多糖提取率急劇下降,然后略有增加。在料液比为1∶400时,多糖提取率显著高于其他料液比的提取率(P<0.05,下同),因此确定最佳料液比为1∶400。
2. 1. 2 微波功率对糯高粱多糖提取率的影响 由图2可知,在料液比1∶400、提取时间60 s的条件下,随着微波功率的增加,糯高粱多糖提取率呈先升高后趋于平稳的变化趋势;当微波功率在200~300 W时,多糖提取率的变化幅度不大,300 W后多糖提取率急剧升高,300 W的多糖提取率与微波功率350和400 W的多糖提取率之间差异达显著水平,400 W后保持平稳,450 W的多糖提取率与400 W间差异不显著(P>0.05)。因此,确定400 W为糯高粱多糖的最佳微波提取功率。
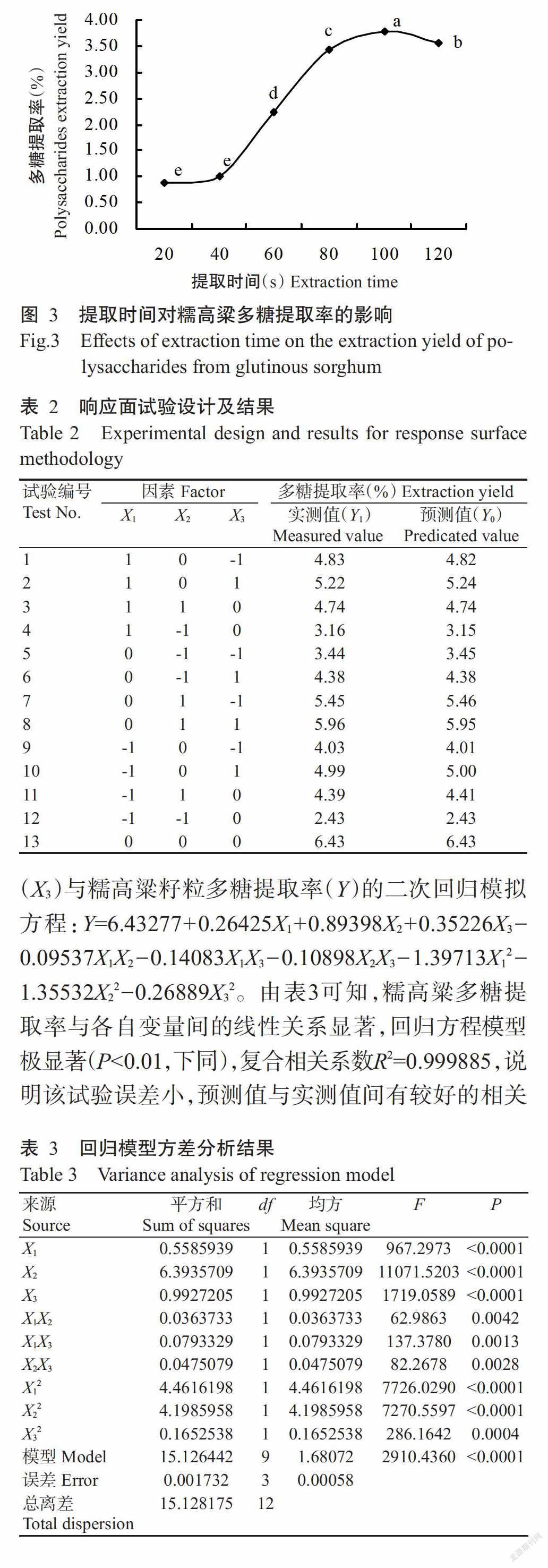
2. 1. 3 提取时间对糯高粱多糖提取率的影响 如图3所示,在料液比1∶400、微波功率400 W的条件下,不同提取时间的糯高粱多糖提取率差异显著,随提取时间的延长呈先升高后降低的变化趋势,提取时间在40 s后多糖提取率急剧增加,100 s后缓慢下降,可能由于提取时间过长引起部分多糖降解(和法涛等,2015)。因此,确定最佳提取时间为100 s。
2. 2 糯高粱多糖提取条件的响应面优化结果
2. 2. 1 回归模型的建立及其显著性检验 采用Box-Behnken设计方法对糯高粱多糖的提取条件进行优化,结果见表2。通过对表2试验数据进行多元回归拟合,建立料液比(X1)、微波功率(X2)和提取时间(X3)与糯高粱籽粒多糖提取率(Y)的二次回归模拟方程:Y=6.43277+0.26425X1+0.89398X2+0.35226X3-0.09537X1X2-0.14083X1X3-0.10898X2X3-1.39713X12-1.35532X22-0.26889X32。由表3可知,糯高粱多糖提取率与各自变量间的线性关系显著,回归方程模型极显著(P<0.01,下同),复合相关系数R2=0.999885,说明该试验误差小,预测值与实测值间有较好的相关性,方程拟合程度高,可用该回归方程对糯高粱多糖提取率进行预测。从回归方程的偏相关系数可知,各因素对糯高粱多糖提取率的影响排序为X2(微波功率)>X3(提取时间)>X1(料液比),且均为正效应。
2. 2. 2 响应面分析及优化 响应面图是各试验因素交互作用下得到的一个三维空间曲面,从二元线性回归方程结果可知,3个因素中的任意两个因素间交互作用均达极显著水平。从图4~图6可知,料液比与提取时间的曲线最陡,说明这两个因素间的交互作用对糯高粱多糖提取率影响最大;料液比与微波功率的曲张最平滑,响应值变化差异较小,对多糖提取率的影响较小。上述结果与方差分析结果(表3)表现一致。
2. 2. 3 验证试验结果 通过对试验数据分析优化可知,糯高粱多糖提取的最佳工艺条件为:料液比1∶400.56、微波功率480.46 W、提取时间111.59 s,在此条件下,预测糯高粱多糖提取率最大值为6.68%。为进一步验证该响应面结果的可靠性,在料液比1∶400、微波功率480 W、提取时间110 s条件下进行试验,所得糯高粱多糖的平均值为6.48%,相对标准偏差为0.11%,与预测值的相对误差为2.91%,说明该响应面结果可靠。
2. 3 糯高粱多糖的抗氧化能力分析结果
2. 3. 1 糯高粱多糖对DPPH自由基的清除能力
糯高粱多糖对DPPH自由基的清除效果见图7,当糯高粱多糖质量浓度在0.2~0.4 mg/mL时,随着质量浓度的增加,其对DPPH自由基的清除率逐渐升高,当多糖质量浓度为0.4 mg/mL时,DPPH自由基清除率达最大值(54.38%),之后继续增加多糖质量浓度,DPPH自由基清除率呈下降趋势;在同一质量浓度下,糯高粱多糖的DPPH自由基清除率均低于对照BHT的清除率,表明糯高粱多糖具有一定的DPPH自由基清除能力,但弱于BHT。
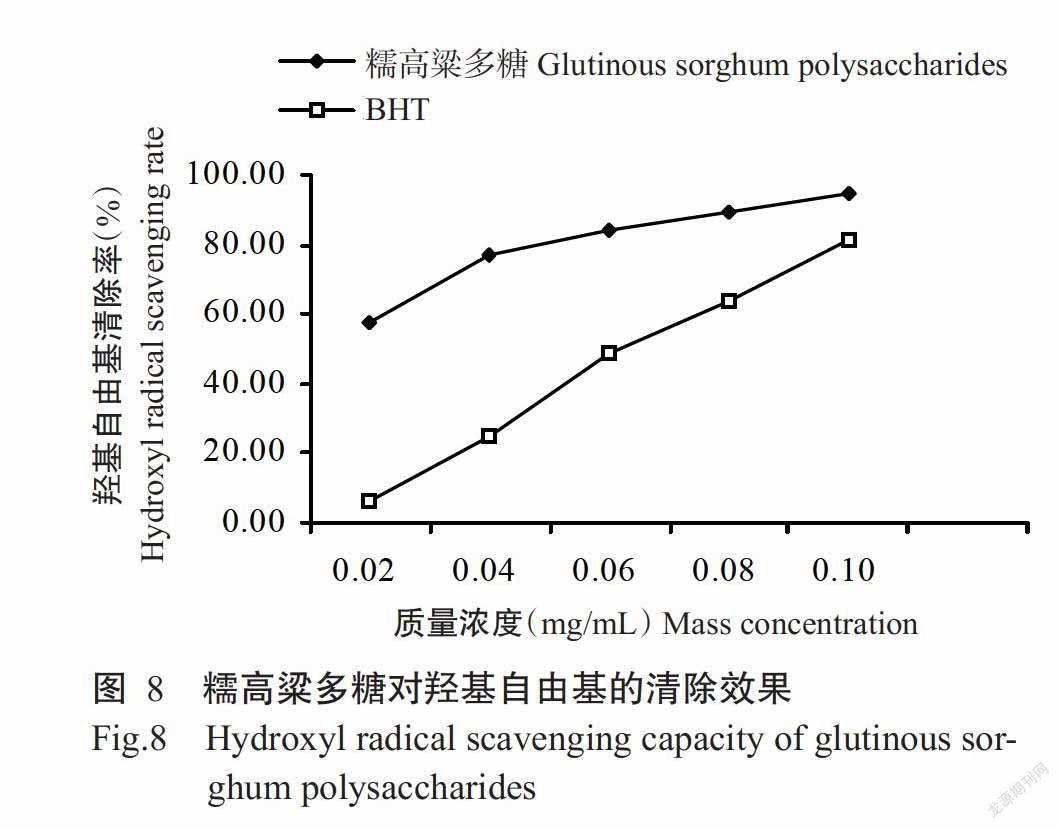
2. 3. 2 糯高粱多糖对羟基自由基的清除能力 从图8可看出,糯高粱多糖的羟基自由基清除率随多糖质量浓度的增加而升高,质量浓度在0.02~0.06 mg/mL时,多糖对羟基自由基的清除率升高较快,当质量浓度为0.10 mg/mL时达最大值(94.70%),高于相同质量浓度条件下对照BHT的羟基自由基清除率,表明糯高粱多糖对羟基自由基的清除能力较强。
3 讨论
目前,常用的多糖提取方法有煎煮法、浸提法、回流提取法等,但这些方法均存在提取成本高、提取率低、提取时间长及提取温度高等问题。因此,发展一种快速、有效提取多糖的方法成为必要。在近20年间研究者们提出了“绿色化学”的观点,对环保型提取技术越来越重视,而微波辅助提取是近几年新发展起来的技术,在天然化学产物提取方面的应用逐渐增多(鞠兴荣等,2012;袁俊杰等,2016;王永立等,2017)。微波可使多糖的链构象形成更均匀分布的网络结构,增强多糖溶液的稳定性,具有效率高、耗时短、消耗提取溶剂少、温度和耗能低等优点,在实际大规模生产中也可行,是很有应用前景的多糖提取方法(王胜男等,2019)。响应面试验设计是一种正交优化试验设计方法,可分析多个自变量对因变量的影响及自变量间的相互作用,已广泛应用于优化提取条件(赵慧霞等,2015;李静等,2017;王波等,2018)。本研究采用响应面法优化微波提取糯高粱多糖的工艺条件,结果表明,糯高粱籽粒含有丰富的多糖,在料液比1:400、微波功率480 W、提取时间110 s的优化条件下,获得多糖提取率达6.48%。Ramesh和Tharanathan(1999)通过高温方式(55或100 ℃温度)对糯高粱籽粒中的淀粉进行酶解、清除,从而得到多糖。本研究的提取方法用时较短,提取率较高,是提取糯高粱多糖的高效方法。
DPPH自由基是一种十分稳定的自由基,其稳定性来自共振稳定作用及3个苯环的空间障碍;羟基自由基是一种重要的活性氧,具有极强的氧化性,其可与大多数有机物发生反应而氧化分解为二氧化碳和水。因而,不同的自由基反应体系中多糖抗氧化作用不同(张燕等,2019)。本研究结果显示,糯高粱多糖对DPPH自由基的清除率为54.38%,对羟基自由基的清除率为94.70%,表明糯高粱多糖具有较强的抗氧化活性。糯高粱多糖质量浓度在0.4 mg/mL时,DPPH自由基清除率达最大值,浓度大于0.4 mg/mL后,清除率下降,可能由于高粱多糖中含有丰富的X链(85%~86%的β-葡聚糖残基连接支点)和Y链(93%~94%的β-葡聚糖残基连接支点)β-葡聚糖,该物质在其酸解和酶解过程产生结晶颗粒(Onwurah,2001),随着糯高粱多糖质量浓度的增加,反应液出现混浊,透光率轻微下降,导致其活性趋于降低。本研究明确了糯高粱籽粒含有丰富的多糖并具有较强的抗氧化能力,但一种天然抗氧化多糖成分复杂,通常具有协同增效作用,因此,关于高粱多糖的成分物质、结构分布、含量等方面还有待进一步研究,以深入了解糯高粱多糖的抗氧化機理。
4 结论
采用响应面法优化的工艺条件(料液比1∶400、微波功率480 W、提取时间110 s)可用于糯高粱多糖提取,且糯高粱多糖具有较强的抗氧化活性,可用于健康食品开发。
参考文献:
程庆军,张福耀,赵威军,常玉卉,田承华,高海燕,高鹏,张桂香. 2010. 高淀粉高粱种质筛选及其研究利用[J]. 中国农学通报,26(11):103-106. [Cheng Q J,Zhang F Y,Zhao W J,Chang Y H,Tian C H,Gao H Y,Gao P,Zhang G X. 2010. Screening and utilization of high starch content sorghum[J]. Chinese Agricultural Science Bulletin,26(11):103-106.]
段江莲,刁文睿,李为琴,徐建国. 2013. 高粱籽粒乙醇提取物的体外抗氧化及抑菌活性[J]. 中国粮油学报,28(11):13-17. [Duan J L,Diao W R,Li W Q,Xu J G. 2013. Study on in vitro antioxidant and antimicrobial activities of ethanol extract from the sorghum grains[J]. Journal of the Chinese Cereals and Oils Association,28(11):13-17.]
和法涛,刘光鹏,朱风涛,赵岩,王娟,初乐. 2015. 响应面法优化热水法浸提猴头菇多糖工艺提高多糖得率[J]. 食品科技,40(1):210-215. [He F T,Liu G P,Zhu F T,Zhao Y,Wang J,Chu L. 2015. Optimization hot water extraction process of polysaccharide from Hericium erinaceus for improving the yield of polysaccharide by response surface methodology[J]. Food Science and Technology,40(1):210-215.]
鞠兴荣,税丹,何荣,王立峰,王雪峰,高瑀珑,袁建. 2012. 响应面分析法优化菜籽多糖酸法提取工艺的研究[J]. 中国粮油学报,27(3):89-93. [Ju X R,Shui D,He R,Wang L F,Wang X F,Gao Y L,Yuan J. 2012. Study on the optimization of the extraction technology of polysaccharides from rapeseed meal by acid using response surface method[J]. Journal of the Chinese Cereals and Oils Association,27(3):89-93.]
李静,操庆国,凡军民,韩艳丽. 2017. 响应面法优化无花果多糖的提取条件研究[J]. 江西农业学报,29(12):93-97. [Li J,Cao Q G,Fan J M,Han Y L. 2017. Optimization of conditions for extraction of polysaccharide from Ficus carica by using response surface methodology[J]. Acta Agriculturae Jiangxi,29(12):93-97.]
刘睿,谢笔钧,潘思轶,刘卫兵. 2013. 高粱种子外种皮中原花青素提取、纯化及其抗氧化活性的研究[J]. 中国粮油学报,18(4):43-48. [Liu R,Xie B J,Pan S Y,Liu W B. 2013. Extraction,purification and antioxidation test of procyanidins from episperm of sorghum seed[J]. Journal of the Chinese Cereals and Oils Association,18(4):43-48.]
刘禹,段江莲,李为琴,张梅庆,琚裕杰. 2013. 高粱米不同溶剂提取物的抗氧化活性研究[J]. 中国粮油学报,28(6):36-39. [Liu Y,Duan J L,Li W Q,Zhang M Q,Ju Y J. 2013. Study on antioxidant activities of different solvent extracts from the sorghum rice[J]. Journal of the Chinese Cereals and Oils Association,28(6):36-39.]
王波,张晓艳,黄攀,吕德雅,严帆,刘辉. 2018. 响应面法优化马齿苋黄酮超声波提取工艺[J]. 江苏农业学报,34(1):166-171. [Wang B,Zhang X Y,Huang P,Lü D Y,Yan F,Liu H. 2018. Optimization of ultrasonic wave extraction of flavonoid from Portulace oleracea L. by response surface methodology[J]. Jiangsu Journal of Agricultural Sciences,34(1):166-171.]
王华,姚亚平,王毕妮,陈卫军,李荣玮,曹炜. 2007. 高粱籽粒提取物抗氧化活性的研究[J]. 食品与发酵工业,33(10):123-127. [Wang H,Yao Y P,Wang B N,Chen W J,Li R W,Cao W. 2007. Antioxidant properties of sorghum groats extract[J]. Food and Fermentation Industries,33(10):123-127.]
王胜男,曲丹妮,邵国强,杨晋杰,赵贺开,杨立娜,李君,何余堂,刘贺,朱丹实. 2019. 超声—微波协同提取大豆种皮多糖性质及微观结构的研究[J]. 食品科学. doi:10.7506/spkx1002-6630-20190416-203. [Wang S N,Qu D N,Shao G Q,Yang J J,Zhao H K,Yang L N,Li J,He Y T,Liu H,Zhu D S. 2019. Study on properties and microstructure of soy hul polysaccharide extracted by ultraso-nic-microwave synergistic method[J]. Food Science. doi:10.7506/spkx1002-6630-20190416-203.]
王永立,袁浩,樊淑华. 2017. 七叶一枝花总黄酮提取工艺优化[J]. 南方农业学报,48(4):698-703. [Wang Y L,Yuan H,Fan S H. 2017. Optimization of extraction technique for total flavonoids from Paris Polyphylla[J]. Journal of Southern Agriculture,48(4):698-703.]
吴春华,陈艺勤,邱恬,姚闽娜,庞杰. 2011. 多糖微观构象与抗肿瘤活性关系研究进展[J]. 中国粮油学报,26(4):123-128. [Wu C H,Chen Y Q,Qiu T,Yao M N,Pang J. 2011. Research advances in relationship between micro-conformation and anti-tumor activity of polysaccharides[J]. Journal of the Chinese Cereals and Oils Association,26(4):123-128.]
吳笳笛. 2008. 多糖的作用及其研究进展[J]. 沈阳师范大学学报(自然科学版),26(2):221-223. [Wu J D. 2008. A-dvance in study of polysaccharide[J]. Journal of Shenyang Normal University(Natural Science Edition),26(2):221-223.]
吴丽,赵钢,邹亮,任贵兴. 2014. 高粱中酚类物质及其功能活性的研究进展[J]. 食品安全质量检测学报,5(6):1589-1595. [Wu L,Zhao G,Zou L,Ren G X. 2014. Research progress on phenolic compounds and potential health of sorghum grains[J]. Journal of Food Safety and Quality,5(6):1589-1595.]
许春平,杨琛琛,郑坚强,毛多斌. 2014. 植物叶多糖的提取和生物活性综述[J]. 食品研究与开发,35(14):111-114. [Xu C P,Yang C C,Zheng J Q,Mao D B. 2014. Review on extraction and biological activity of polysaccharides from plant leave[J]. Food Research and Development,35(14):111-114.]
尹学伟,王培华,张晓春,李泽碧,张志良,唐生佑,马强,谭平. 2014. 14个糯高粱亲本主要农艺性状配合力及遗传力分析[J]. 西南农业学报,27(4):1363-1368. [Yin X W,Wang P H,Zhang X C,Li Z B,Zhang Z L,Tang S Y,Ma Q,Tan P. 2014. Analysis of 14 parents glutinous sorghum’s main agronomic characteristics combining abi-lity and heritability[J]. Southwest China Journal of Agricultural Sciences,27(4):1363-1368.]
袁俊杰,蒋玉蓉,孙雪婷,陈琪,周伟,陆国权,毛前. 2016. 藜麦多糖提取工艺的响应面法优化及其品种差异[J]. 食品科技,41(1):154-159. [Yuan J J,Jiang Y R,Sun X T,Chen Q,Zhou W,Lu G Q,Mao Q. 2016. Optimization of polysaccharides extraction by response surface metho-dology and genotypic variation in quinoa[J]. Food Science and Technology,41(1):154-159.]
张国涛,王华. 2011. 不同果皮颜色高粱抗氧化活性研究[J]. 应用化工,40(7):1201-1204. [Zhang G T,Wang H. 2011. Research on antioxidant activity of the sorghums with different color pericarp[J]. Applied Chemical Industry,40(7):1201-1204.]
张慧芸,陈俊亮,康怀彬. 2014. 发酵对几种谷物提取物总酚及抗氧化活性的影响[J]. 食品科学,35(11):195-199. [Zhang H Y,Chen J L,Kang H B. 2014. Effect of fermentation on total polyphenol content and antioxidant activity of cereal extract[J]. Food Science,35(11):195-199.]
张燕,简荣超,谭乾开,谭镇濠,余汉忠,盛钊君. 2019. 响应面法优化微波辅助提取马铃薯渣中果胶工艺[J]. 食品工业,40(6):30-34. [Zhang Y,Jian R C,Tan Q K,Tan Z H,Yu H Z,Sheng Z J. 2019. Optimization of microwave-assisted extraction of pectin from potato pulp by res-ponse surface methodology[J]. The Food Industry,40(6):30-34.]
赵慧霞,刘昆,赵泽龙,何帼英,张丽萍. 2015. 响应面法优化磁化水提取燕麦麸皮多糖工艺[J]. 食品科学,36(8):37-43. [Zhao H X,Liu K,Zhao Z L,He G Y,Zhang L P. 2015. Optimization of extraction for oat bran polysaccharides using magnetized water by response surface metho-dology[J]. Food Science,36(8):37-43.]
钟葵,曾志红,林伟静,王强,周素梅. 2013. 绿豆多糖制备及抗氧化特性研究[J]. 中国粮油学报,28(2):93-98. [Zhong K,Zeng Z H,Lin W J,Wang Q,Zhou S M. 2013. Study on the preparation of polysaccharides from mung bean seed and anti-oxidant activity[J]. Journal of the Chinese Cereals and Oils Association,28(2):93-98.]
Atoui A,Mansouri A,Boskou G,Kefalas P. 2005. Tea and herbal infusions:Their antioxidant activity and phenolic profile[J]. Food Chemistry,89(1):27-36.
Betts N S,Fox G P,Kelly A M,Cruickshank A W,Lahnsteina J,Henderson M,Jordan D R,Burton R A. 2015. Non-cellulosic cell wall polysaccharides are subject to genotype×environment effects in sorghum(Sorghum bicolor) grain[J]. Journal of Cereal Science,63:64-71.
Halliwell B,Gutteridge J M C,Aruoma O. 1987. The deoxyribose method:A simple test-tube assay for determination of rate constants for reaction ofhydroxyl radical[J]. Analytical Biochemistry,165(1):215-219.
Onwurah I N E. 2001. Crystallinity and polysaccharide chains of β-glucan in white sorghum,SK5912[J]. International Journal of Biological Macromolecules,29(4-5):281-286.
Ramesh H P,Tharanathan R N. 1999. Water-extracted polysaccharides of selected cereals and influence of temperature on the extractability of polysaccharides in sorghum[J]. Food Chemistry,64:345-350.
Waniska R D. 2000. Structure,phenolic compounds and antifungal proteins of sorghum caryopses[C]//The Internatio-
nal Crops Research Institute for the Semi-Arid Tropics. Pro-
ceedings of Technical Institutional Options for Sorghum
Grain Mold Management:Proceedings of an International
Consultation:72-106.
Wu L,Huang Z H,Qi P Y,Yao Y,Meng X J,Zou J Q,Zhu K,Ren G Q. 2011. Chemical characterization of a pro-cyanidin-rich extract from sorghum bran and its effect on oxidative stress and tumor inhibition in vivo[J]. Journal of Agricultural and Food Chemistry,59(16):8609-8615.
(責任编辑 罗 丽)

