云南药用野生稻种质资源的白叶枯病抗性评价
陈玲 张敦宇 陈越 付坚 王波 钟巧芳





摘要:【目的】鉴定评价云南药用野生稻对白叶枯病菌株的抗性,为药用野生稻的保护及抗病新品种选育提供理论依据。【方法】利用24个近年在云南稻作区流行的白叶枯病菌株及国内外部分标准强致病菌系对云南8个居群(OF1~OF8)的31份药用野生稻材料进行接种鉴定,测量病斑长度,按照抗性分级标准进行抗性等级划分,建立抗病谱,比较分析不同药用野生稻材料间和不同居群间的抗性差异。【结果】接种24个白叶枯病菌株21 d后,感病材料金刚30的病斑长度均超过20.00 cm,而未接种的叶片未发生任何变化,说明24个白叶枯病菌株均未丧失致病力;31份药用野生稻材料大多出现典型的白叶枯病症状,但抗病等级存在差异,其中,67.7%的供试药用野生稻对XOO8菌株表现抗病,说明XOO8菌株的致病性最强,所有材料均抗XOO14菌株,说明XOO14菌株的致病性最弱。31份药用野生稻的抗菌率均在50.0%以上,其中OF2-1的抗菌率最高,为100.0%,OF4-2的抗菌率最低,为50.0%。8个居群中,以OF5和OF7的抗菌率最高,均为100.0%,说明二者对24个白叶枯病菌株均表现抗性;OF4的抗菌率最低,为79.2%,仅抗19个菌株。8个居群抗性由强至弱排序为:OF5=OF7>OF6>OF1=OF2=OF8>OF3>OF4。各居群内样品个体间抗性差异明显,推测是由于野生稻杂合程度较高所导致。【结论】云南药用野生稻种质资源对当前在云南流行的白叶枯病小种及国内外部分强致病菌整体抗性较好,其抗性差异来源于居群内的杂合度,与地理分布无关,推测云南药用野生稻具有特异的优良抗白叶枯病基因,其在遗传研究和品种改良方面具有较大应用潜力。
关键词: 药用野生稻;白叶枯病;抗性;鉴定评价;云南
0 引言
【研究意义】水稻(Oryza sativa L.)是全世界近50%人口的主食作物,但病虫害严重制约其生产。其中,由黄单胞杆菌致病变种——白叶枯病菌(Xanthomonas oryzae pv. oryzae,简称Xoo)引起的水稻白叶枯病(Bacterial blight)是世界范围内最严重的水稻细菌性病害(Huang et al.,2012;Khan et al.,2014)。目前,防治水稻白叶枯病暂无特效药剂,实践证明,选育抗病品种是最经济、安全和有效的手段。为避免品种失效,需不断发掘新的抗源,培育新的抗病品种(夏春等,2012)。全世界稻属中有22个野生种,从中发掘新抗源并加以利用,是近年来国内外水稻育种的研究热点。其中,药用野生稻(O. officinalis Wall.)是我国现有3种野生稻资源之一,分布于云南、广东、广西和海南等地,具有许多优良性状,利用价值很高,尤其是云南药用野生稻遗传变异较丰富,从云南省搜集药用野生稻种质资源,并进行综合性抗性评价,对加快优异药用野生稻种质创新和培育具有重要的意义。【前人研究进展】我国抗白叶枯病的种质资源丰富,其中,野生稻主要包括普通野生稻、疣粒野生稻和药用野生稻(谭光轩等,2004;阮辉辉等,2008;Zhou et al.,2011);栽培品种主要包括扎昌龙(Wang et al.,2003;Yang et al.,2011)、明恢63(Xiang et al.,2006;Hur et al.,2013)、黃玉(Shin et al.,2007)等;经人工突变获得的抗病种质如M41(Kinoshita,1995)等;人工多基因聚合获得的抗病种质主要包括以IR24为遗传背景构建的近等基因系IRBB1、IRBB2、IRBB3、IRBB5、IRBB7和IRBB13等(章琦,2007;高杜娟等,2016)。有关药用野生稻白叶枯病抗性研究报道较少,尤其是1994─2012年期间未见相关报道。彭绍裘等(1982)考察和测定了16份云南药用野生稻种质对湖南白叶枯病强致病菌系的抗性,发现云南药用野生稻的抗病类型为抗~高抗;李容柏和秦学毅(1994)利用8个白叶枯病菌系对15份广西药用野生稻种质进行抗性评价,结果发现绝大多数属中抗类型;章琦等(1994)利用4个白叶枯病强致病菌系对我国48份药用野生稻种质进行接种鉴定,结果发现高抗种质占49.8%;陈成斌等(2012)利用5个白叶枯病菌系对211份广西药用野生稻进行接种鉴定,结果发现大多数种质的抗病类型为抗~中抗,高抗种质较少,且还存在极少的中感种质;余腾琼等(2016)利用白叶枯病菌系BD8438、CN9404和X1对6份云南药用野生稻种质进行接种鉴定,结果发现6份种质抗病类型为抗~高抗。综上所述,药用野生稻的白叶枯病抗性鉴定评价主要集中在云南和广西,云南药用野生稻对白叶枯病菌株抗性良好,抗病类型为抗~高抗;广西药用野生稻稍差,大多数为中抗。【本研究切入点】虽然云南药用野生稻对白叶枯病抗性良好,但随着病原菌的变异,云南药用野生稻对近年在云南稻作区流行的菌株及国内外部分标准强致病菌系抗性尚不清楚,亟需开展相关研究。【拟解决的关键问题】利用近年在云南稻作区流行的菌株及国内外部分标准强致病菌系对云南8个居群(OF1~OF8)的31份药用野生稻材料进行接种鉴定,测量病斑长度,按照抗性分级标准进行抗性等级划分,建立抗病谱,比较分析不同药用野生稻材料间和不同居群间的抗性差异,以期筛选出抗性良好的种质资源,为药用野生稻保护及抗病新品种选育提供理论依据。
1 材料与方法
1. 1 试验材料
供试药用野生稻材料从云南西双版纳州、临沧市和普洱市等地收集而来,共31份,并按其分布地及生境特点划分为8个具有代表性的居群(表1),每个居群为3~7个材料,取样时材料间水平距离均大于50 m。以金刚30为感病对照。供试白叶枯菌株(表2)是2013─2017年从云南不同地区的水稻白叶枯病病叶中分离获得的致病菌株及国内外部分标准强致病菌系,共24个菌株。
1. 2 材料种植及接种处理
将采集的药用野生稻材料种植在温室内,从中选取生长旺盛的健康植株,对其进行割茬处理,分栽至直径21 cm、高21 cm的水桶中,每份材料栽24桶,每桶栽植1个单株,浇透水,置于温室阴凉处,1周后进行正常水肥及光照管理,待植株长至孕穗期时进行接种鉴定。
1. 3 菌株致病力检测及材料抗性鉴定
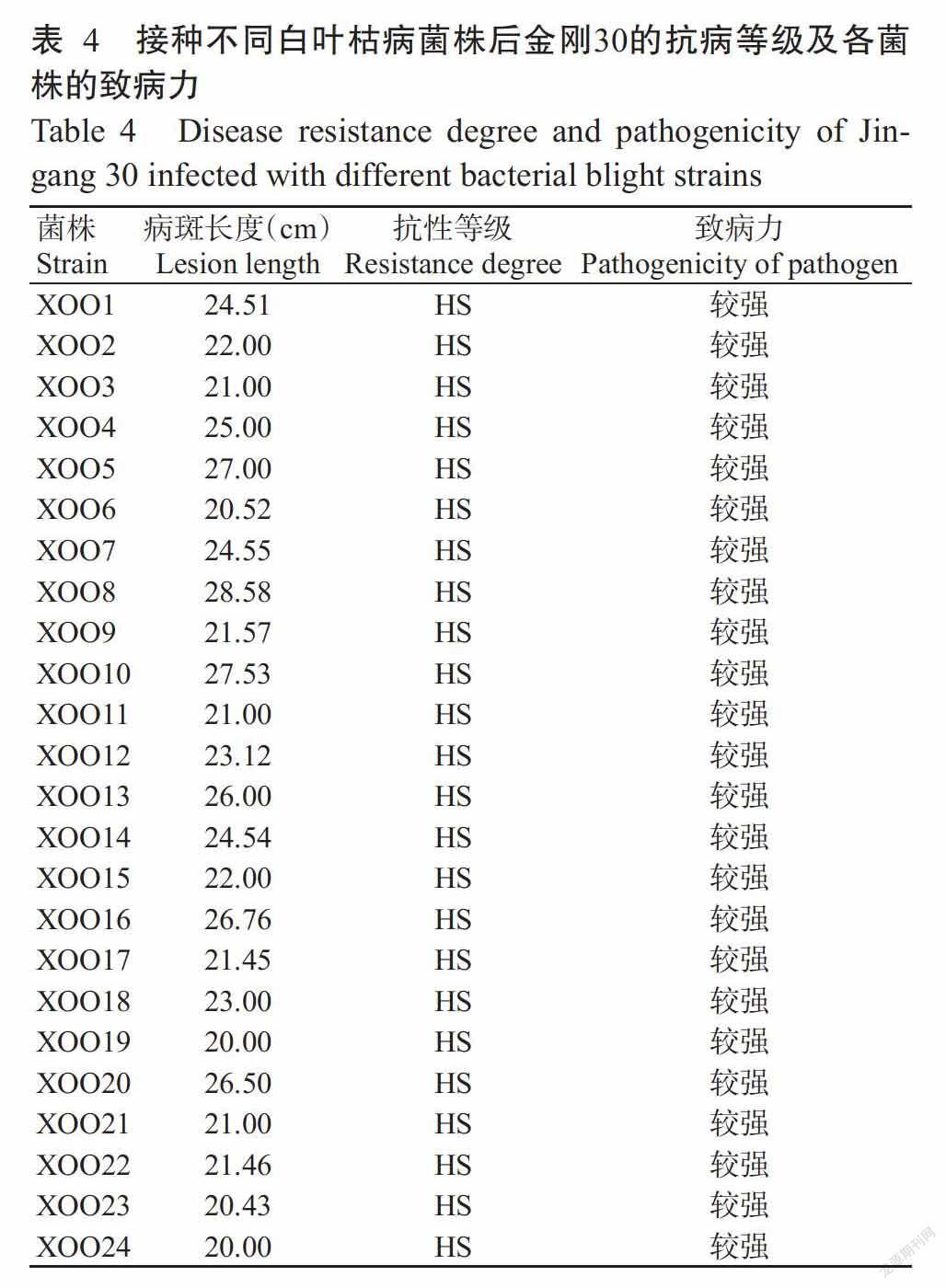
接种前,将-20 ℃保存的菌种接种于NA培养基上复壮,28~30 ℃下培养48~72 h后,用无菌水洗脱菌株,悬浮均匀,将菌悬液浓度调至3×108 CFU/mL(OD600=0.5)用于后续试验。将手术剪灭菌后,蘸取制备好的病菌悬浮液,将平展部叶片的叶尖剪去1~3 cm,每种菌株接种1株植株,每株植株接种3片以上叶片,以感病水稻金刚30为对照。接种15~21 d后,当参试材料的病情发展趋于稳定时,量取病斑长度,按照抗性分级标准(表3)对其进行抗性等级划分。同时,根据对照材料金刚30接种不同白叶枯病菌株后的病斑长度进行抗性等级划分,根据等级划分结果间接判断各菌株的致病力。
1. 4 统计分析
利用Excel 2010对抗性等级划分结果进行整理分析,建立抗病谱,比较不同药用野生稻材料和不同居群的抗性差异。参照程在全等(2008)对野生稻的抗感划分方法,将0~2级归为抗病,3~6级归为感病,分别统计不同药用野生稻材料和不同居群的抗病率(抗病材料比例)和抗菌率(抗各菌株的比例),其中,材料抗病率(%)=抗病材料份数/供试材料总数×100;材料抗菌率(%)=材料抗各菌株的个数/菌株总数×100;居群抗病率(%)=抗病居群的材料份数/居群总数×100;居群抗菌率(%)=居群抗各菌株的个数/菌株总数×100。
2 结果与分析
2. 1 白叶枯病菌株致病力分析结果
对照材料金刚30接种不同白叶枯病菌株15~21 d后,其发病病情均趋于稳定。接种21 d后,金刚30病斑长度均超过20.00 cm(表4),叶片枯黄,而未接种叶片未发生任何变化,说明24株白叶枯病菌株均未丧失致病力,可用于后续接种试验。
2. 2 云南药用野生稻对白叶枯病抗性反应的基本情况
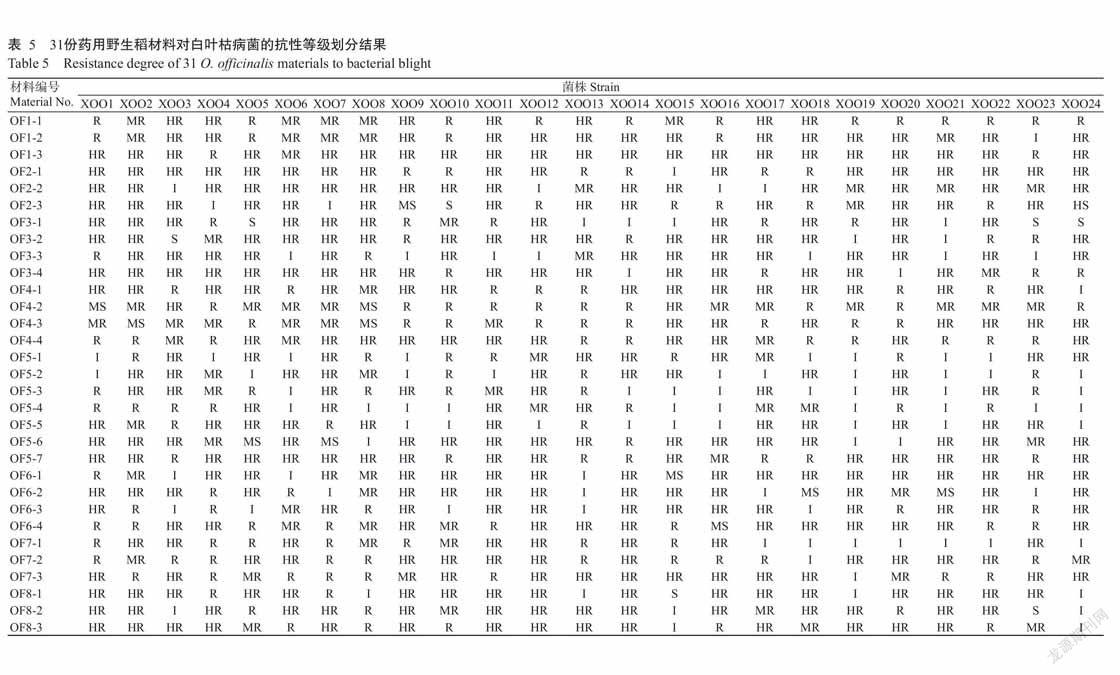
田间观察发现,供试药用野生稻材料接种白叶枯病菌株21 d后,普遍出现典型病斑,颜色为褐黄色(图1-A)或黄色(图1-B),少部分出现急性型病斑,水渍状,呈灰绿色(图1-C)。由表5可知,接种不同白叶枯病菌株后,31份药用野生稻材料的抗病等级存在差异,对各菌株抗性达0~2级的材料比例为81.6%~100.0%,只有OF2-3高感XOO24菌株,说明31份药用野生稻材料整体抗性良好。
2. 3 供试白叶枯病菌株对药用野生稻致病性分析結果
由表6可知,31份药用野生稻对24个白叶枯病菌株的抗性主要为1级(HR),该级材料所占比例为32.3%~67.7%,说明24个白叶枯病菌株对31份药用野生稻的致病力均不强。统计抗病材料所占比例,结果如图2所示。67.7%的供试药用野生稻对XOO8菌株表现抗病,说明XOO8菌株致病力最强;所有供试药用野生稻均抗XOO14菌株,说明XOO14菌株致病力最弱。24个白叶枯病菌株对供试药用野生稻的致病力排序为:XOO8>XOO6>XOO2>XOO23>XOO4=XOO5=XOO7=XOO10=XOO17>XOO21>XOO3=XOO15=XOO16=XOO18=XOO19=XOO24>XOO1=XOO9=XOO11=XOO12=XOO13=XOO20=XOO22>OO14。
2. 4 31份药用野生稻材料的抗菌情况
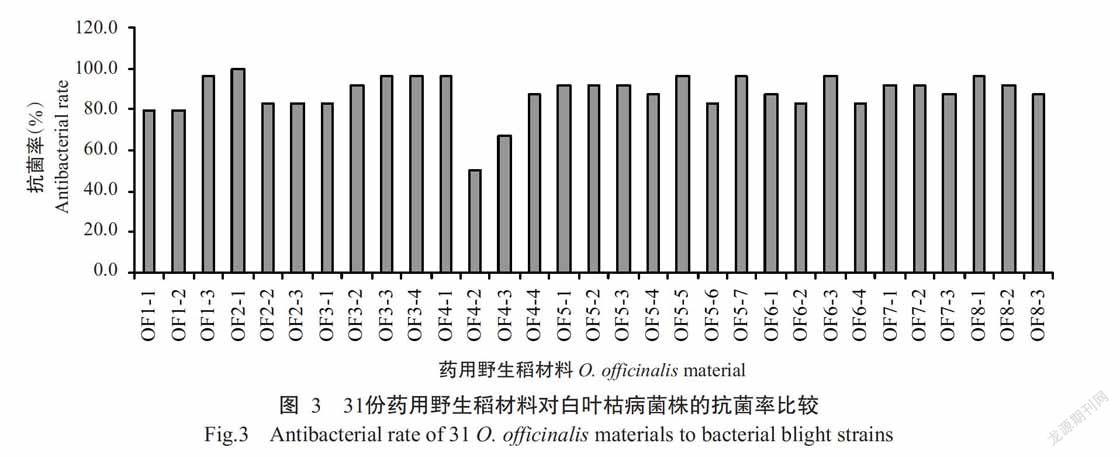
由图3可知,31份药用野生稻的抗菌率均在50.0%以上,其中OF2-1的抗菌率最高为100.0%,说明其对24个白叶枯病菌株均表现抗病,整体抗性最好,抗谱最广;OF4-2的抗菌率最低,为50.0%,说明其仅抗12个白叶枯病菌株,整体抗性最差,抗谱较窄。31份药用野生稻对白叶枯病菌株抗性排序为:OF2-1>OF1-3=OF3-3=OF3-4=OF4-1=OF5-5=OF5-7=OF6-3=OF8-1>OF3-2=OF5-1=OF5-2=OF5-3=OF7-1=OF7-2=OF8-2>OF4-4=OF5-4=OF6-1=OF7-3=OF8-3>OF2-2=OF2-3=OF3-1=OF5-6=OF6-2=OF6-4>OF1-1=OF1-2>OF4-3>OF4-2。
2. 5 8个药用野生稻居群抗性比较分析结果
计算各居群材料病斑长度的均值,分析8个居群对24个白叶枯病菌株的抗性,结果如表7所示。8个居群对各白叶枯病菌株均表现3级(中抗)以上水平,说明8个居群对白叶枯病菌的抗性均较好。
野生稻通常是遗传杂合体,个体间存在遗传背景差异。本研究以标准差作为考核指标,评估同一居群不同材料对同一菌株的抗性差异,标准差越大,说明同一居群不同材料间的病斑长度差异大,则抗病能力差异明显,反之亦然。由表7可知,8个居群的病斑长度标准差变幅较明显,尤其是OF2和OF8,甚至出现标准差超过病斑长度现象,说明各居群材料间的抗性差异明显。
根据表7统计不同居群的抗菌率,结果(图4)发现在8个居群中,以OF5和OF7的抗菌率最高,均为100.0%,说明二者对24个白叶枯病菌株均表现抗病,整体抗性最好,抗谱最广;OF4的抗菌率最低,为79.2%,说明OF4只抗19个菌株,整体抗性最差,抗谱较窄。8个居群对白叶枯病菌株的抗性排序为:OF5=OF7>OF6>OF1=OF2=OF8>OF3>OF4。
3 讨论
水稻白叶枯病菌群中存在生理小种分化,评价水稻材料抗性时,应采用不同的生理小种进行鉴定,以便最大限度鉴定出抗不同生理小种的水稻材料,同时获得更清晰的抗谱,为充分发掘广谱抗病基因打下基础(许志刚等,2004;章琦,2005;张佳环等,2016)。本研究选用不同的生理小种评价药用野生稻的抗性,结果显示,仅有1个材料高感XOO24菌株,81.6%以上的药用野生稻达0~2级抗性,说明云南大部分药用野生稻携有丰富的优良白叶枯病抗性基因,尤其是OF2-1的抗性较好,抗谱也较广,推测其含1个甚至多个高抗白叶枯病基因。这些丰富的基因资源在遗传研究和品种改良方面具有较大潜力。陈成斌等(2012)利用5个白叶枯病菌株鉴定广西药用野生稻的抗性,结果发现高抗材料较少,尤其是对国际最强毒性的菲律宾小种6(P6菌系)达3级以上抗性的材料极少。但在本研究的31份药用野生稻中,有17份高抗P6菌系(编号XOO1),2份对P6免疫,10份抗P6菌系,仅1份中感P6菌系。可见,与广西药用野生稻相比,云南药用野生稻对白叶枯病的抗性整体较好。
寄主与病原菌间存在协同进化的关系。当一个新的抗病品种大量推广后,病菌会发生变异产生新生理小种,并导致抗病品种的抗性丧失,因而在生产中应时常监测抗病品种的抗性变化(Attitalla et al.,2004)。前人研究表明,云南药用野生稻对往年流行的菌株抗性良好(彭绍裘等,1982;余腾琼等,2016)。本研究发现,31份药用野生稻的抗菌率均在50.0%以上,其中OF2-1的抗菌率最高,为100.0%,且毒性最强的XOO8菌株只对32.3%的供试药用野生稻具有致病力,其余67.7%的供试材料均对XOO8菌株表现抗病,说明31个云南药用野生稻材料对近年流行的24个白叶枯病菌株的抗性整体较好,抗谱较广,今后在加强对XOO8菌株防控的同时,应充分发掘利用云南药用野生稻的优异抗性基因。
本研究还发现,同一居群不同材料间的抗性差异明显,不同居群的材料间抗性也出现一致的情况,如OF3-3、OF3-4、OF4-1、OF5-5、OF5-7和OF6-3的抗性一致,推测云南药用野生稻的抗性差异来源于居群内的杂合度,与地理位置无关。药用野生稻之外的其他野生稻,如普通野生稻也存在类似的情况(余腾琼等,2016),推测是由于野生稻柱头大而外露,异交结实率较高,造成同一地点采集的材料不是抗性纯合体(孙佩甫等,2015;周国华,2017)。可见,对野生稻接种鉴定时,同一居群应选取多株材料进行考察,或应首先对试材进行亲缘关系分析,分类之后再开展抗性鉴定试验,从而有利于发掘新的抗源。
4 结论
云南药用野生稻种质资源对当前在云南流行的白叶枯病小种以及国内外部分强致病菌整体抗性较好,其抗性差异来源于居群内的杂合度,与地理分布无关,推测云南药用野生稻具有特异的优良抗白叶枯病基因,其在遗传研究和品种改良方面具有较大应用潜力。
参考文献:
陈成斌,曾华忠,梁云涛,梁世春,徐志健,张烨,黄娟. 2012. 广西野生稻抗白叶枯病多菌系鉴定[J]. 广西农学报,27(3):1-3. [Chen C B,Zeng H Z,Liang Y T,Liang S C,Xu Z J,Zhang Y,Huang J. 2012. Appraisal of bacterial blight resistance of Guangxi wild rice[J]. Journal of Guangxi Agriculture,27(3):1-3.]
程在全,晏慧君,耿顯胜,殷富有,孙一丁,章成,黄兴奇. 2008. 云南疣粒野生稻抗白叶枯病鉴定及叶片组织学观察[J]. 植物病理学报,38(6):582-591. [Cheng Z Q,Yan H J,Geng X S,Yin F Y,Sun Y D, Zhang C,Huang X Q. 2008. Identification of Oryza granulate for resistance to Xanthomonas oryzae pv. oryzae and observation of leaf tissue[J]. Acta Phytopathologica Sinica,38(6):582-591.]
高杜娟,唐善军,陈友德,李友荣. 2016. 水稻抗白叶枯病种质资源[J]. 中国种业,(8):26-29. [Gao D J,Tang S J,Chen Y D,Li Y R. 2016. Germplasm resources of rice resistance to bacterial blight[J]. China Seed Industry,(8):26-29.]
李容柏,秦学毅. 1994. 广西野生稻抗病虫性鉴定研究的主要进展[J]. 广西科学,1(1):83-85. [Li R B,Qin X Y. 1994. The main findings of resistant identification of Guangxi wild rice to diseases and pests[J]. Guangxi Sciences,1(1):83-85.]
彭绍裘,魏子生,毛昌祥,黄河清,肖放华,罗宽. 1982. 云南省疣粒野生稻、药用野生稻和普通野生稻多抗性鉴定[J]. 植物病理学报,12(4):58-60. [Peng S Q,Wei Z S,Mao C X,Huang H Q,Xiao F H,Luo K. 1982. Identification of multiresistance of O. meyeriana,O. officinalis and O. rufipogon growing in Yunnan Province[J]. Acta Phytopathologica Sinica,12(4):58-60.]
阮辉辉,严成其,安德荣,刘仁虎,陈剑平. 2008. 疣粒野生稻抗白叶枯病新基因xa32(t)的鉴定及其分子标记定位[J]. 西北农业学报,17(6):170-174. [Ruan H H,Yan C Q,An D R,Liu R H,Chen J P. 2008. Identifying and mapping new gene xa32(t) for resistance to bacterial blight(Xanthomonas oryzae pv. oryzae,XOO) from Oryza meyeriana L.[J]. Acta Agriculturae Boreali-Occidentalis Sinica,17(6):170-174.]
孙佩甫,朗越,裴新梧,袁潜华. 2015. 普通野生稻花器性状及异交结实率分析[J]. 湖北农业科学,54(10):2317-2322. [Sun P F,Lang Y,Pei X W,Yuan Q H. 2015. The analysis of floral characters of common wild rice and its outcrossing rate[J]. Hubei Agricultural Sciences,54(10):2317-2322.]
谭光轩,任翔,翁清妹,时振英,祝莉莉,何光存. 2004. 药用野生稻转育后代一个抗白叶枯病新基因的定位[J]. 遗传学报,31(7):724-729. [Tan G X,Ren X,Weng Q M,Shi Z Y,Zhu L L,He G C. 2004. Mapping of a new resistance gene to bacterial blight in rice line introgressed from Oryza officinalis[J]. Acta Genetica Sinica,31(7):724-729.]
夏春,陈红旗,朱旭东. 2012. 水稻白叶枯病抗性基因的鉴定、定位、克隆与育种应用[J]. 分子植物育种, 10(6):761-771. [Xia C,Chen H Q,Zhu X D. 2012. Identification,ma-pping,isolation of the genes resisting to bacterial blight and their breeding application in rice[J]. Molecular Plant Breeding,10(6):761-771.]
许志刚,孙启明,刘凤权,陈志谊,胡白石,郭亚辉,刘永峰,刘红霞. 2004. 水稻白叶枯病菌小种分化的监测[J]. 中国水稻科学,18(5):469-472. [Xu Z G,Sun Q M,Liu F Q,Chen Z Y,Hu B S,Guo Y H,Liu Y F,Liu H X. 2004. Race monitoring of rice bacterial blight(Xanthomonas oryzae pv. oryzae) in China[J]. Chinese Jouranl of Rice Science,18(5):469-472.]
余腾琼,肖素勤,殷富有,张敦宇,李娥贤,程在全. 2016. 云南野生稻和地方稻资源抗白叶枯病分析[J]. 植物保护学报,43(5):774-781. [Yu T Q,Xiao S Q,Yin F Y,Zhang D Y,Li E X,Cheng Z Q. 2016. Identification of Yunnan wild rice and local landraces resistance ability to Xanthomonas oryzae pv. oryzae[J]. Journal of Plant Protection,43(5):774-781.]
张佳环,马周杰,刘巍,王继春,邵玺文,凌凤楼,刘一凝. 2016. 东北水稻白叶枯病菌生理小种及水稻品种对9号小种的抗性[J]. 植物保护,42(3):204-207. [Zhang J H,Ma Z J,Liu W,Wang J C,Shao X W,Ling F L,Liu Y N. 2016. Physionlogical races of Xanthomonas oryzae pv. oryzae from japonica rice in Northeast China and resistance of rice varieties to the race 9[J]. Plant Protection,42(3):204-207.]
章琦. 2005. 水稻白叶枯病抗性基因鉴定进展及其利用[J]. 中国水稻科学,(19):453-459. [Zhang Q. 2005. Highlights in identification and application of resistance genes to bacterial blight[J]. Chinese Journal of Rice Science,(19):453-459.]
章琦. 2007. 水稻白叶枯病抗性的遗传与改良[M]. 北京:科学出版社. [Zhang Q. 2007. Genetics and improvement of resistance to bacterial blight in rice[M]. Beijing:Science Press.]
章琦,王春莲,施爱农,白建法,林世成,李道远,陈成斌,庞汉华. 1994. 野生稻抗稻白叶枯病性(Xanthomonas oryzae pv. oryzae)的评价[J]. 中国农业科学,27(5):1-9. [Zhang Q,Wang C L,Shi A N,Bai J F,Lin S C,Li D Y,Chen C B,Pang H H. 1994. Evaluation of resistance to Xanthomonas oryzae pv. oryzae in wild rice[J]. Scientia Agricultura Sinica,27(5):1-9.]
周國华. 2017. 元江野生稻柱头特异性启动子p51408的克隆及功能分析[J]. 西南农业学报,30(11):2393-2397. [Zhou G H. 2017. Cloning and functional analysis of specific promoter p51408 in stigma exsertion of wild rice(Oryza rufipogan Griff.) from Yuanjiang city[J]. Southwest China Journal of Agricultural Sciences,30(11):2393-2397.]
Attitalla H I,Latiffah Z,Salleh B,Brishammar S. 2004. Biology and partial sequencing of an endophytic Fusarium oxysporum and plant defense complex[J]. Molecular Evolution,1(2):121-144.
Huang X H,Kurata N,Wei X H,Wang Z X,Wang A,Zhao Q,Zhao Y,Liu K Y,Lu H Y,Li W J,Guo Y L,Lu Y Q,Zhou C C,Fan D L,Weng Q J,Zhu C R,Huang T,Zhang L,Wang Y C,Feng L,Furuumi H,Kubo T,Miyabayashi T,Yuan X P,Xu Q,Dong G,Zhan Q,Li C Y,Fujiyama A,Toyoda A,Lu T T,Feng Q,Qian Q,Li J Y,Han B. 2012. A map of rice genome variation reveals the origin of cultivated rice[J]. Nature,490(7421):497-501.
Hur Y J,Jeung J U,Kim S Y,Park H S,Cho J H,Lee J Y,Sohn Y B,Song Y C,Park D S,Lee C W,Sohn J G,Nam M H,Lee J H. 2013. Functional markers for bacte-rial blight resistance gene Xa3 in rice[J]. Molecular Bree-ding,31(4):981-985.
Khan M A,Naeem M,Iqbal M. 2014. Breeding approaches for bacterial leaf blight resistance in rice(Oryza sativa L.),current status and future directions[J]. European Journal of Plant Pathology,139(1):27-37.
Kinoshita T. 1995. Report of the committee on gene symbo-lization nomenclature and linkage groups[J]. Rice Gene-tics Newsletter,12:24-93.
Shin S H,Kim K Y,Shin M S,Ko J K,Kim C K. 2007. Identification of rice varieties containing bacterial blight resistance gene Xa1 by SNP marker(16PFXa)[J]. Korean Journal of Breeding Science,39(1):63-69.
Wang C T,Tan M P,Xu X,Wen G S,Zhang D P,Lin X H. 2003. Localizing the bacterial blight resistance gene,Xa22(t),to a 100-kilobase bacterial artificial chromosome[J]. Phytopathology,93(10):1258-1262.
Xiang Y,Cao Y L,Xu C G,Li X H,Wang S P. 2006. Xa3,conferring resistance for rice bacterial blight and enco-ding a receptor kinase-like protein,is the same as Xa26[J]. Theoretical and Applied Genetics,113(7):1347-1355.
Yang Q,Wang C,Liu X Q,Tan Y P. 2011. Cloning and gene-tic transformation of the candidate genes for the bacterial blight resistance gene Xa31(t) in rice[J]. Chinese Agricultural Science Bulletin,27(18):223-227.
Zhou Y L,Uzokwe V N E,Zhang C H,Cheng L R,Wang L,Chen K,Gao X Q,Sun Y,Chen J J,Zhu L H,Zhang Q,Ali J,Xu J L,Li Z K. 2011. Improvement of bacterial resistance of hybrid rice in China using the Xa23 gene derived from wild rice(Oryza rufipogon)[J]. Crop Protection,30(6):637-644.
(責任编辑 陈 燕)

