羊肚菌多糖提取及其抗氧化活性研究
周益帆 杨滢 卢会敏 王静 刘松青 王芳



摘 要: 为了探讨碱法提取羊肚菌多糖的工艺条件并测定其抗氧化活性,该研究以四川北川羊肚菌为原料,采用碱法提取羊肚菌多糖,利用苯酚-硫酸法对羊肚菌多糖得率进行测定,并通过单因素探讨提取温度(70、80、90、100 ℃)、提取时间(2、4、6、8 h)、碱液浓度(0.4、0.6、0.8、1.0 mol·L-1)、料液比(1∶15、1∶20、1∶25、1∶30 g·mL-1)对羊肚菌多糖得率的影响,同时采用正交试验优化提取工艺,对其抗氧化活性进行测定。结果表明:在提取温度90 ℃、提取时间5 h、碱液浓度0.7 mol·L-1、料液比1∶20(g·mL-1)条件下得到的羊肚菌多糖得率为5.39%。羊肚菌多糖具有较强的清除DPPH自由基、羟自由基、超氧阴离子的能力和较好的还原能力,其IC50分别为0.468、0.208、0.022、0.014 mg·mL-1,抗氧化能力依次为还原能力>超氧阴离子清除能力>羟自由基清除能力>DPPH自由基清除能力。优化后的羊肚菌多糖提取工艺合理、可行,且羊肚菌多糖具有较强的抗氧化活性。
关键词: 羊肚菌, 多糖, 碱提法, 工艺优化, 抗氧化活性
中图分类号: Q946 文献标识码: A 文章编号: 1000-3142(2019)07-0887-09
Abstract: The alkali extraction method of polysaccharide from Morchella was optimized and its antioxidant activity was studied. Morchella in Beichuan County of Sichuan Province was selected as raw material, adopting alkali extraction method to extract polysaccharide, and then the polysaccharide extraction content was determined by phenol-sulfuric acid method. The extraction process of the polysaccharide was studied by single factor experiment and orthogonal experiment, which controlled extraction temperature (70, 80, 90, 100 ℃), extraction time (2, 4, 6, 8 h), alkali concentration (0.4, 0.6, 0.8, 0.6 mol·L-1), solid-liquid ratio (1∶15, 1∶20, 1, 25∶30 g·mL-1). Those antioxidant activities of polysaccharide were also assayed. The results of the optimal extraction conditions were as follows: Extraction temperature was 90 ℃, extraction time 5 h, concentration of alkali concentration 0.7 mol·L-1 and solid-liquid ratio 1∶20 g·mL-1, the maximum yield of polysaccharide was 5.39%. The polysaccharide of Morchella had a powerful scavenge DPPH free radicals, hydroxyl radicals, superoxide anions, as well as the good reduction capacity, whose IC50 were 0.468, 0.208, 0.022, 0.014 mg·mL-1, respectively. The polysaccharide of Morchella antioxidant capacity was arranged successively reduction capacity > superoxide anion > scavenging capacity > DPPH free radical scavenging capacity. The optimized extraction process of polysaccharide from Morchella was reasonable, feasible and had strong antioxidant activity.
Key words: Morchella, polysaccharide, alkali extraction method, technology optimization, antioxidant activity
羊肚菌是珍稀的野生食(藥)用菌之一,属于真菌界子囊菌门子囊菌纲盘菌目羊肚菌科羊肚菌属,因其形似羊肚而得名(赵琪等,2010)。经研究发现,羊肚菌多糖具有抗疲劳(Guo, 2015)、抗肿瘤(陈彦等,2008)、抗氧化(Zi et al., 2018)等作用,且在一定程度上能够减轻癌症患者放疗、化疗引起的毒副作用(李娟等,2005)。因此,羊肚菌在医学界和保健食品界倍受关注。已报道的羊肚菌多糖提取方法主要有酶提取法(Zhao et al., 2018)、水提醇沉法(刘浪浪等,2009)、微波-超声提取法(黄生全等,2010)等,以上提取方法均以破坏细胞壁为前提,促使多糖的溶出。但是,羊肚菌多糖存在于细胞壁中的小纤维网状结构基质内(李蔚,2008),大多与其蛋白质结合在一起,测量其多糖得率时需要掩蔽蛋白质的影响,使整个提取工艺流程变得复杂、费时。任嘉兴等(2018)、毕博和于荣利(2016)研究表明,水提醇沉法提取羊肚菌多糖的得率分别为4.24%、2.25%。吉仙枝和陈玮(2007)研究表明,碱提法提取食用菌多糖的得率比水提法高约6倍。NaOH作为一种强碱,在一定浓度下能够有效破除细胞壁,促使多糖-蛋白质间的键裂解以及多糖溶出(孙玉军等,2010)。因此,碱法提取羊肚菌多糖能提高多糖得率,且其提取工艺流程简单、高效。
目前,大多数抗氧化剂是人工合成品,对人们的健康有一定的威胁。天然抗氧化剂具有安全、无毒的特点,引起了人们的广泛关注,寻找高效天然抗氧化剂已成为国内外研究的热点。研究已发现灵芝多糖(张志军等,2011)、茶树菇多糖(余萍等,2009)、梭柄松孢菇多糖(刘蒙蒙等,2013)、木耳多糖(孔沛筠等,2018)、鲍鱼内脏多糖(陈胜军等,2019)等具有良好的抗氧化活性,而有关四川羊肚菌多糖抗氧化活性的研究报告甚是局限,开展四川北川羊肚菌多糖抗氧性活性的研究显得尤为重要。本研究对羊肚菌多糖提取工艺进行了优化,采用苯酚-硫酸法对羊肚菌多糖含量进行测定,考察了提取温度、提取时间、碱液浓度、料液比对羊肚菌多糖得率的影响,通过正交实验对碱提工艺进行优化,测定其体外抗氧化活性,旨在为四川北川羊肚菌的开发利用提供技术支撑。
1 材料与方法
1.1 材料和试剂
材料:羊肚菌(由四川北川神农有限责任公司提供,产地为四川北川)。试剂:2,4,6三吡啶基三嗪(TPTZ)、1,1-二苯基-2-三硝基苯肼(DPPH)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠(EDTA-2Na)、邻苯三酚(PR)、盐酸、过氧化氢、水杨酸、无水乙醇、苯酚、浓硫酸、NaOH,以上试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器和设备
UV5000紫外分光光度计,安徽皖仪科技股份有限公司;SC-3610低速离心机,安徽中科中佳科学仪器有限公司;DHG-9030A电热恒温鼓风干燥箱,上海申光仪器仪表有限公司;HWS12恒温水浴锅,上海一恒科技有限公司;JA3003精密电子天平,上海良平仪器仪表有限公司;FK-A组织捣碎机,江苏金坛市金城国胜实验仪器厂;pHSJ-4F上海雷磁精密酸度计,仪电科学仪器股份有限公司;HC-2062离心机,安徽中科中佳科学仪器有限公司;JH-ZLS-3真空旋转浓缩仪,上海申光仪器仪表有限公司。
1.3 方法
1.3.1 碱法提取羊肚菌多糖工艺流程 羊肚菌粉末→过筛→精确称取1 g粉末→碱液提取→离心(1 000 r·min-1,5 min)→滤液→重复提取→合并滤液→真空减压浓缩(至原体积1/3)→加入3倍体积95%乙醇(陈丹红,2010)→4 ℃过夜醇沉(溶液中的多糖可被乙醇沉降下来)(薛雅茹等,2017)→离心(同上)→沉淀→干燥→溶解→测定吸光度。
1.3.2 羊肚菌多糖含量的测定 采用硫酸-苯酚法(Chu et al., 2018)对羊肚菌多糖得率进行测定:精密称取105 ℃干燥至恒重的无水葡萄糖纯品20 mg,置于100 mL容量瓶中超纯水定容作为标准溶液,精密吸取2、4、6、8、10 mL分别置于100 mL容量瓶中定容,分别取1 mL葡萄糖溶液,随后再加入0.5 mL 5%苯酚溶液,摇匀,再加入2.5 mL浓硫酸,混匀,于40 ℃水浴锅中保温30 min后,在490 nm波长下测定吸光度。
以葡萄糖含量(mg·mL-1)作为横坐标,以吸光度值作为纵坐标,得到标准曲线线性回归方程为y=0.015 6x+0.000 4,R2=0.999 7。由线性回归方程计算羊肚菌样品中多糖得率。羊肚菌多糖得率=(多糖浓度×多糖体积×稀释倍数)/羊肚菌干重×100%。
1.3.3 羊肚菌多糖碱法提取的单因素及正交试验优化
1.3.3.1 多糖碱法提取的单因素试验 在保持其他条件不变的情况下,分别以不同的提取温度(70、80、90、100 ℃)、提取时间(2、4、6、8 h)、碱液浓度(0.4、0.6、0.8、1.0 mol·L-1)和料液比(1∶15、1∶20、1∶25、1∶30 g·mL-1)为单因素,考察各因素对羊肚菌多糖得率的影响。
1.3.3.2 多糖碱法提取正交试验 在单因素试验基础上,以提取温度、提取时间、碱液浓度、料液比为试验因素,依次用A、B、C、D表示,并以1、2、3分别代表各自的低、中、高水平,以羊肚菌多糖得率为评价指标确定最佳工艺参数。正交试验因素及水平编码见表1。
1.3.4 羊肚菌多糖抗氧化活性研究
1.3.4.1 多糖的精制 利用Sevage法(郝博慧等,2011)除去粗多糖中蛋白質。向粗多糖溶液中加入3倍体积的Sevage试剂(正丁醇∶氯仿=1∶5),充分振荡7 ~ 8 min,于4 000 r·min-1下离心5 min,静置10 min,吸取上清液,重复上述操作,直至无白色中间层。合并上清液,向其中加入3倍体积乙醇置于4 ℃冰箱过夜,离心,取沉淀,烘干备用。
1.3.4.2 多糖清除DPPH自由基能力的测定 参照Li et al.(2012)的方法,用95%乙醇稀释羊肚菌多糖样品,进行清除DPPH自由基能力的测定,重复3次,以Vc作阳性对照。
1.3.4.3 多糖羟自由基清除能力的测定 参照文献(李顺峰等,2008),用水杨酸法对羟自由基进行测定,重复3次,以Vc作阳性对照。
1.3.4.4 多糖超氧阴离子清除能力的测定 参照文献(尹巧汕,2012),改进如下:以邻苯三酚自氧化法测定羊肚菌多糖对超氧阴离子的清除率,稀释多糖溶液至0.025、0.05、0.075、0.1 mg·mL-1,于25 ℃恒温水浴20 min,再加入相同处理的邻苯三酚溶液,空白实验做相同处理,5 min内每隔30 s测定一次吸光度。重复3次,以Vc作阳性对照。
1.3.4.5 多糖铁离子还原能力的测定 参照文献Benzie & Strain(1996)的方法,取不同浓度梯度的FeSO4溶液,制作标准曲线;取样品浓度分别为0.025、0.05、0.075、0.1 mg·mL-1的溶液,参照参考文献进行试验。重复3次,以Vc作阳性对照。
1.3.5 数据统计分析 所有试验均重复进行3次,试验数据均以平均值±标准误(x ±sx)表示,用SPSS 20.0软件计算各抗氧化指标的IC50值。
2 结果与分析
2.1 提取羊肚菌多糖的单因素试验
2.1.1 提取温度对羊肚菌多糖得率的影响 图1显示,在70~90 ℃时,随着提取温度的升高,羊肚菌多糖得率持续增加,在提取温度达到90 ℃时,羊肚菌多糖得率达到最高,为3.85%;超过90 ℃后,得率略微下降。这是由于提取温度对羊肚菌细胞破坏程度(向东等,2004)和多糖分子运动(胡琴汉等,2018)有一定影响,在一定范围内,温度越高,破坏程度和运动速度越大,越有利于多糖的溶出。而温度过高可能会破坏多糖结构,造成多糖得率的下降。综合考虑,选择90 ℃为最佳提取温度。
2.1.2 提取时间对羊肚菌多糖得率的影响 图2显示,羊肚菌多糖得率随提取时间的增加而增加。在2~4 h时羊肚菌多糖得率持续递增。在提取时间达到4 h时,羊肚菌多糖得率最高,达4.98%;提取时间达到4 h之后,随提取时间增加,多糖得率增幅不大,多糖溶出达到最大值(刘继超等,2018)。因此,选择4 h为最佳提取时间。
2.1.3 碱液浓度对羊肚菌多糖得率的影响 图3显示,羊肚菌多糖得率随碱液浓度的增加呈先增大后降低的趋势,碱液浓度在0.8 mol·L-1时,多糖得率最高,达到5.08%,之后随着碱液浓度的增大而平缓下降。可能是碱液在一定浓度范围内能显著提高胞内外渗透压差,增大细胞间距,使得羊肚菌组织变得疏松,让多糖溶出更充分、快速(蒋玉梅等,2017)。但羊肚菌多糖在高浓度碱液中可能会降解,浓度过大,反而对多糖提取不利(王志刚等,2007)。因此,选择0.8 mol·L-1为最佳碱液浓度。
2.1.4 料液比对羊肚菌多糖得率的影响 图4显示,在料液比为1∶15 ~ 1∶20(g·mL-1)的范围内,多糖得率随料液比增大而增加,当料液比为1∶20(g·mL-1)时,得率最大,为5.03%,在料液比为1∶20~1∶30(g·mL-1)的范围内,羊肚菌多糖得率增幅变化不大,多糖溶出达到最大值。在一定范围内,增加溶剂量会增大体系中固相和液相的接触面积,从而提高多糖浸出的可能性,使多糖的得率提高(任嘉兴等,2018)。因此,选择1∶20(g·mL-1)为最佳料液比。
2.2 正交设计结果与分析
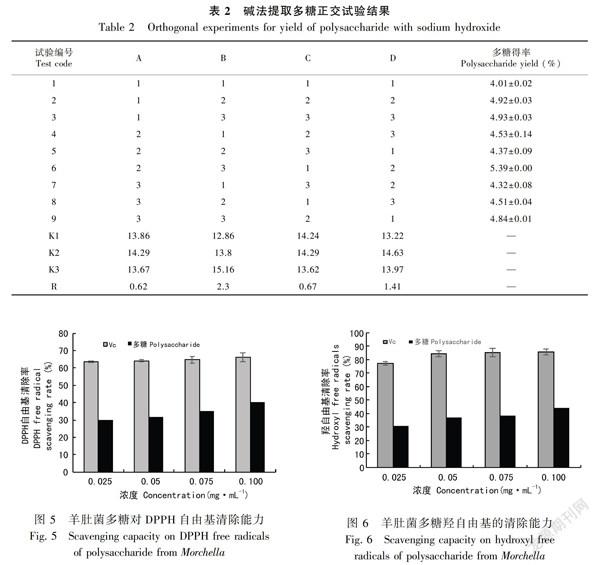
基于单因素试验,影响碱法提取羊肚菌多糖得率的因素有提取温度、提取时间、碱液浓度、料液比,采用正交试验优化提取工艺,结果见表2。由表2极差分析可知,影响羊肚菌多糖得率的因素按其影响程度的大小排列分别为B>D>C>A,最佳提取条件为A2B3C2D2,即提取温度90 ℃,提取时间5 h,碱液浓度0.7 mol·L-1,料液比1∶20(g·mL-1)。当提取次数为2次时,在此条件下,多糖得率为5.39%。
2.3 羊肚菌抗氧化活性测定
2.3.1 DPPH自由基清除能力 DPPH自由基是一种稳定的自由基,一般用来对抗氧化成分的体外抗氧化性进行评价,清除率越大表明其抗氧化能力越强(于静等,2018)。图5结果表明,在羊肚菌多糖浓度0.025~0.100 mg·mL-1范围内,随着羊肚菌多糖浓度增加,清除DPPH的能力增强,即清除率与多糖浓度存在量效关系。在多糖浓度为0.100 mg·mL-1时,羊肚菌多糖和Vc对DPPH自由基清除率分别达到66.32%和40.22%,虽然羊肚菌多糖对DPPH清除率弱于Vc,但羊肚菌多糖仍然表现出较强的清除DPPH自由基的能力。
IC50值为清除50%自由基所需多糖浓度(徐小伟等,2013)。IC50值越小,其对应样品的抗氧化活性越强(李敏等,2015)。羊肚菌多糖清除DPPH自由基的IC50为0.468 mg·mL-1。梭柄松孢菇多糖(刘蒙蒙等,2013)和木耳多糖(孔沛筠等,2018)的IC50分别为3.27、1.47 mg·mL-1。这表明羊肚菌多糖具有较好的DPPH自由基的清除能力。
2.3.2 羟自由基清除能力 羟自由基是一种强氧化剂,其清除率是物质抗氧化作用的重要指标(金鸣等,1996)。图6结果表明,羊肚菌多糖浓度在0.025~0.100 mg·mL-1范围内,随着羊肚菌多糖浓度的增加,清除羟自由基的能力增强,即清除率与多糖浓度存在量效关系。在多糖浓度为0.100 mg·mL-1时,羊肚菌多糖和Vc对羟自由基的清除率分别达到44.28%和85.69%,虽然羊肚菌多糖对DPPH的清除率弱于Vc,但羊肚菌多糖仍然表现出较强的清除羟自由基的能力。
羊肚菌多糖的IC50为0.208 mg·mL-1。李方亮等(2011)研究发现香菇多糖和褐蘑菇多糖的IC50值分别为0.703、0.320 mg·mL-1,说明羊肚菌多糖具有较好的清除羟自由基的能力。
2.3.3 超氧阴离子清除能力 超氧阴离子自由基可以经过一系列反应生成其他的氧自由基,引起脂质过氧化,导致细胞膜结构和功能的改变(杨少辉等,2010)。因此,通过对超氧阴离子自由基的清除也能达到抗氧化作用。图7结果表明,羊肚菌多糖和Vc对超氧阴离子都有一定的清除能力,在羊肚菌多糖浓度0.025~0.100 mg·mL-1范圍内,随着羊肚菌多糖浓度的增加,清除超氧阴离子的能力增强,即清除超氧阴离子的能力与多糖浓度存在量效关系。在浓度为0.100 mg·mL-1时,羊肚菌多糖和Vc对超氧阴离子的清除率分别达到65.92%和85.19%,两者清除超氧阴离子的能力比较接近,表明羊肚菌多糖有较强的清除超氧阴离子的能力。
羊肚菌多糖对超氧阴离子的清除率为65.93%,其IC50=0.022 mg·mL-1。经报道,茶树菇多糖的IC50为1.282 mg·mL-1(余萍等,2009),对于超氧阴离子清除能力来说,羊肚菌多糖和Vc的清除率是相近的,但远远大于茶树菇多糖的清除能力。说明羊肚菌多糖具有很好的清除超氧阴离子的能力。
2.3.4 铁离子的还原能力 FRAP法是测定物质还原能力的一种方法,它可以用来反映样品的总抗氧化活性,其值越大,说明抗氧化活性越强(盛冉等,2018)。图8结果表明,随着羊肚菌多糖浓度的增加,多糖对铁离子的还原能力呈线性关系缓慢增加,与Vc相比,羊肚菌多糖的还原能力较低。
IC50表示样品还原能力达到50%时所需要的多糖浓度(刘蒙蒙等,2013)。通过线性拟合得出,羊肚菌多糖的IC50为0.014 mg·mL-1。经刘蒙蒙等(2013)报道,梭柄松孢菇的还原能力的IC50为0.58 mg·mL-1,两者比较,羊肚菌多糖的还原能力远远大于梭柄松孢菇多糖。
3 结论
通过单因素和正交试验,优化了碱法提取羊肚菌多糖的工艺条件,即加入20倍体积的0.7 mol·L-1 NaOH溶液在90 ℃下提取5 h,经两次提取,多糖得率达到5.39%。本研究通过研究羊肚菌多糖清除DPPH自由基、羟基自由基和超氧阴离子的能力以及铁离子的还原能力,发现其抗氧化能力依次为还原能力>超氧阴离子清除能力>羟自由基清除能力>DPPH自由基清除能力,以Vc为对照,羊肚菌多糖的抗氧化能力均低于Vc,但其IC50值显著高于其他食用菌多糖,说明羊肚菌多糖具有较好的抗氧化活性。
参考文献:
BENZIE IFF, STRAIN JJ, 1996. The ferric reducing ability of plasma (FRAP) as a measures of “antioxidant power”: The FRAP assay [J]. Analyt Biochem, 239(1): 70-76.
BI B, YU RL, 2016. Ultrasound-assistedextraction of polysaccharides from Morchella conica and their effects on selected antioxidant indices in mice with CCl_4-induced liver injury [J]. Acta Edul Fung, 23(3):53-56. [毕博,于荣利,2016. 尖顶羊肚菌多糖的超声波辅助提取工艺优化及其对肝损伤小鼠抗氧化活性的影响 [J]. 食用菌学报,23(3): 53-56.]
CHEN DH, 2010. Alcohol extraction of coprinus comatus polysaccharides [J]. Light Textile Ind Fujian, (10): 35-37. [陈丹红, 2010. 鸡腿菇多糖的醇析工艺研究 [J]. 福建轻纺, (10): 35-37.]
CHU DH, HUANG ZB, HE FW, et al., 2018. Comparison between sulfuric acid-phenol andsulfuric acid-anthrone methods used for determination of polysaccharides in shoots of Aralia elata (Miq.) seem [J]. Agric Biotechnol, (3): 170-173.
CHEN SJ, LIU XJ, YANG XQ, et al., 2019. Isolation and purification of visceral polysaccharides fromabalone and its antioxidant activity [J]. J Southern Agric, 50(2): 372-377. [陳胜军, 刘先进, 杨贤庆, 等, 2019. 鲍鱼内脏多糖分离纯化与抗氧化活性评价[J]. 南方农业学报, 50(2): 372-377.]
CHEN Y, PAN J, ZHOU LW, et al., 2008. Antitumor activity of extracellular polysaccharides from Morchella esculenta [J]. Food Sci, (9): 553-556. [陈彦, 潘见, 周丽伟, 等, 2008. 羊肚菌胞外多糖抗肿瘤作用的研究 [J]. 食品科学, (9): 553-556.]
GUO XF, 2015. Effect of jujube date polysaccharide in resisting sportsfatigue [J]. Adv J Food Sci Technol, 9(12): 939-943.
HAO BH, YANG X, MA Y, et al., 2011. Study on deprotei-nization in extraction of polysaccharides from Patentilla anserina by Sevage [J]. Sci Technol Food Ind, (2): 254-255, 258. [郝博慧, 杨鑫, 马莺, 等, 2011. 蕨麻Sevage法脱蛋白工艺研究 [J]. 食品工业科技, (2): 254-255,258.]
HU QH, WANG W, LUO YB, et al., 2018. Optimization of ultrasonic assisted enzymatic extraction of polysaccharide from Kadsura longipedunculata by response surface analysis [J]. Curr Biotechnol, 8(4): 351-357,373. [胡琴汉, 汪伟, 罗应彪, 等, 2018. 响应面分析法优化超声波辅助酶法提取南五味子多糖工艺的研究 [J]. 生物技术进展, 8(4): 351-357,373.]
HUANG SQ, LI JW, NING ZX, et al., 2010. Ultrasonic-microwave synergistic extraction of polysaccharides from cultivated Ganoderma lucidum [J]. Food Sci, 31(16): 52-55. [黄生权, 李进伟, 宁正祥, 等, 2010. 微波-超声协同辅助提取灵芝多糖工艺 [J]. 食品科学, 31(16): 52-55.]
JIANG YM, JIANG TT, YUE TN, et al., 2017. Extraction of polysaccharide from lemon by alkaline solution [J]. Chem World, (5): 257-261. [蒋玉梅, 蒋婷婷, 岳天宁, 等, 2017. 碱法提取柠檬中的多糖 [J]. 化学世界, (5): 257-261.]
JIN M, CAI YX, LI JR, et al., 1996. 1, 10-Phenanthroline Fe2+ oxidative assay of hydroxyl radical produced by H2O2/Fe2+ [J]. Prog in Biochem Biophy, 23(6): 553-555. [金鸣, 蔡亚欣, 李金荣, 等, 1996. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基 [J]. 生物化学与生物物理进展, 23(6): 553-555.]
JI XZ, CHEN W, 2007. Study on the extraction technology of polysaccharides from edible fungi [J]. Mod Business Trade Ind, (5):174-175. [吉仙枝, 陳玮, 2007. 食用菌多糖的提取工艺研究 [J]. 现代商贸工业, (5):174-175.]
KONG PJ, CHANG YN, NIE JR, et al., 2018. Optimization of extraction technology of polysaccharid from Auricularia auricula and study on its antioxidant activities [J]. Food Drug, 20(3): 187-193. [孔沛筠, 常雅宁, 聂嘉睿, 等, 2018. 木耳多糖提取工艺优化及其体外抗氧化活性研究 [J]. 食品与药品, 20(3): 187-193.]
LI J, WANG Z, YAO LT, et al., 2005. Advanced in Morchella esculenta polysaccharides studies [J]. J Microbiol, 25(4): 89-91. [李娟, 王臻, 姚良同, 等, 2005. 羊肚菌多糖研究进展 [J]. 微生物学杂志, 25(4): 89-91.]
LI XC, LIN J, GAO YX, et al., 2012. Antioxidant activity and mechanism of rhizoma cimicifugae [J]. Chem Centr J, 6: 1-10.
LIU MM, SUN LP, ZHUANG YL, et al., 2013. Analysis of polysaccharide composition and in vitro antioxidant activities of fruiting bodies of Catathelasma ventricosum [J]. Sci Technol Food Ind, 34(21): 72-77. [刘蒙蒙, 孙丽平, 庄永亮, 等, 2013. 梭柄松孢菇子实体中多糖组分及体外抗氧化活性分析 [J]. 食品工业科技, 34(21): 72-77.]
LI SF, ZHANG LH, FU JN, et al., 2008. Antioxidant properties of polysaccharide extracts from fruitbodies of Hypsizigus marmoreus [J]. Acta Agric Boreal-Occident Sin, 17(4): 302-305. [李顺峰, 张丽华, 付娟妮, 等, 2008. 真姬菇子实体多糖体外抗氧化特性研究 [J]. 西北农业学报, 17(4): 302-305.]
LI W, WANG ZM, GONG P, et al., 2008. Study on the ultrasonic extraction of polysaccharides from Morchella hyphostroma [J]. Super Fluid Extr, (3): 25-28. [李蔚, 王忠民, 龚平, 等, 2008. 超声波提取羊肚菌菌丝体多糖的研究 [J]. 农产品加工(学刊), (3): 25-28.]
LI FL, ZHAO LD, GAO Y, et al., 2011. Comparison between antioxidant activities of polysaccharides extracts from two kinds of edible mushroom [J]. Hunan Agric Sci, (9): 108-111. [李芳亮, 赵立冬, 高杨, 等, 2011. 两种食用菌多糖提取物的抗氧化活性比较研究 [J]. 湖南农业科学, (9): 108-111.]
LIU JC, LIU XF, ZHANG X, et al., 2018. Optimization of the hot eater extraction technology of polysaccharide from nostoc commune [J]. Mol Plant Breed, 16(13): 4425-4430. [刘继超, 刘晓风, 张璇, 等, 2018. 地木耳多糖热水提取工艺优化 [J]. 分子植物育种, 16(13): 4425-4430.]
LIU LL, LIU L, LIU JH, et al., 2009. Research focus and development trend on polysaccharide from edible fungi [J]. Chem Technol Mark, 32(7): 37-40. [刘浪浪, 刘伦, 刘军海, 等, 2009. 食用菌多糖研究热点及发展趋势 [J]. 化工科技市场, 32(7): 37-40.]
LI M, XI GS, LUO YY, et al., 2015. Study on the antioxidant activity of polysaccharides and flavonoids in different strains of Polygonatum odoratum [J]. N Hortic, (5): 135-138. [李敏, 奚广生, 罗益远, 等, 2015. 不同品系玉竹多糖及黄酮抗氧化活性研究 [J]. 北方园艺, (5): 135-138.]
REN JX, ZHANG JH, BAI BQ, et al., 2018. Study on optimization of extraction technology of polysaccharide and its antioxidant activity from Morchella esculentum [J]. J Shanxi Agric Sci, 46(7): 1199-1203. [任嘉兴, 张锦华, 白宝清, 等, 2018. 羊肚菌多糖提取工艺优化及抗氧化性研究 [J]. 山西农业科学, 46(7): 1199-1203.]
SHENG R, SUN ZG, ZHANG Z, et al., 2018. Purification and identification of carotenoids from Acinetobacter lwoffii UL and detection of their antioxidant activity [J/OL]. Food Ferment Ind: 1-12. [盛冉, 孙志高, 张震, 等, 2018. 鲁氏不动杆菌Acinetobacter lwoffii UL产类胡萝卜素的纯化与鉴定及其抗氧化活性检测 [J/OL]. 食品与发酵工业: 1-12.]
SUN YJ, CHEN Y, MA YH, et al., 2010. Extraction of polysaccharides from carrot [J]. Chin J Trop Crop, 31(10):1849-1852. [孙玉军, 陈彦, 马玉涵, 等, 2010. 胡萝卜多糖的提取研究 [J]. 热带作物学报, 31(10): 1849-1852.]
WANG ZG, JIANG H, ZHU BW, et al., 2007. Alkaline extraction of polysaccharide from Auricularia auricular [J]. J Dalian Inst Light Ind, 26(3): 206-209. [王志刚, 姜红, 朱蓓薇, 等, 2007. 碱法提取木耳渣中多糖的研究 [J]. 大连轻工业学院学报, 26(3): 206-209.]
XIANG D, LAI FY, LIANG P, et al., 2004. Study on extraction of pumpkin polysaccharide by alkali method [J]. Sci Technol Food Ind, 25(11): 120-122. [向东, 赖凤英, 梁平, 等, 2004. 碱法提取南瓜多糖的研究 [J]. 食品工业科技, 25(11): 120-122.]
XU XW, LI ZY, MIAO JZ, et al., 2013. Study on extraction of polysaccharides and antioxidant activity of Chinese yam by ultrasound combined with enzyme [J]. Agric Mach, (6): 79-81. [徐小伟, 李振宇, 苗敬芝, 等, 2013. 超声结合酶法提取山药多糖及抗氧化活性研究 [J]. 农业机械, (6): 79-81.]
XUE YR, CAO R, LU X, et al., 2017. Response surface model optimization of oligosaccharide extraction from coix seed by ultrasonic-assisted technology [J]. Chin J Trop Crop, 38(3): 565-571. [薛雅茹, 操然, 卢旭, 等, 2017. 响应面法优化超声波辅助提取薏苡仁低聚糖工艺的研究 [J]. 热带作物学报, 38(3): 565-571.]
YU P, ZHENG LQ, FANG YH, et al., 2009. Study on the antioxidant activity of polysaccharides from Agrocybe aegerita [J]. Food Res Dev, 30(11): 36-40. [余萍, 鄭立群, 方一泓, 等, 2009. 茶树菇多糖抗氧化性能的研究 [J]. 食品研究与开发, 30(11): 36-40.]
YU J, JIANG B, PAN QL, et al., 2018. Study on extraction technology and its antioxidation activity of Aralia elata seem polysaccharide [J]. Guangzhou Chem Ind, 46(17): 52-55. [于静, 姜波, 潘巧灵, 等, 2018. 刺嫩芽多糖提取工艺及其抗氧化活性的研究 [J]. 广州化工, 46(17): 52-55.]
YANG SH, SONG YJ, WANG JH, et al., 2010. Antioxidant and free radical scavenging ability of yacon in vitro [J]. Food Sci, 31(17): 166-169. [杨少辉, 宋英今, 王洁华, 等, 2010. 雪莲果体外抗氧化和自由基清除能力 [J]. 食品科学, 31(17): 166-169. ]
YIN QS, 2012. Isolation, purification, physicochemical properties, structure and antioxidant activity of polysaccharides from cordyceps kyushu [D]. Jinan: Shandong University. [尹巧汕, 2012. 九州虫草子座多糖的分离纯化, 理化性质、结构及抗氧化活性测定 [D]. 济南:山东大学.]
ZHAO SH, NONG GZ, MENG LL, et al., 2018. Study on enzymatic extraction process of polysaccharide from Urena lobata L. and investigation on its antioxidant activity [J]. Chin J Phar Toxicol, (4): 341.
ZHAO Q, KANG PD, QI SW, et al., 2010. Current statues of morels resources and sustainable development strategies [J]. SW Chin J Agric Sci, 23(1): 266-269. [趙琪, 康平德, 戚淑威, 等, 2010. 羊肚菌资源现状及可持续利用对策 [J]. 西南农业学报, 23(1): 266-269.]
ZHNAG ZJ, LI SF, WEI XS, et al., 2011. Study on antioxidant activity of Ganoderma lucidum polysaccharide [J]. Chem Bioeng, 28(3): 63-65. [张志军, 李淑芳, 魏雪生, 等, 2011. 灵芝多糖体外抗氧化活性的研究 [J]. 化学与生物工程, 28(3): 63-65.]
ZI Y, ZHANG B, JIANG B, et al., 2018. Antioxidant action and protective and reparative effects of lentinan on oxidative damage in HaCaT cells [J]. J Cosmet Dermatol, 26(3): 1108-1114.

