藏药多刺绿绒蒿种子萌发特性研究
袁芳 宋凯杰 蔡熙彤 兰小中
摘 要: 多刺绿绒蒿(Meconopsis horridula )为罂粟科绿绒蒿属一年生草本植物,是一种极具观赏价值和药用价值的高山植物,目前处于濒危状态,因此研究多刺绿绒蒿种子的萌发特性对其种子育苗及人工栽培具有重要意义。为了提高多刺绿绒蒿的种子发芽率,该研究以多刺绿绒蒿的种子为材料,分析了不同消毒剂、浸种时间、温度和外源植物激素对种子萌发特性的影响。结果表明:(1)最适消毒方法为75%乙醇1 min + 3% H2O2 5 min,最适浸种时间为24 h,最适温度和光照条件为20 ℃/10 ℃(光照12 h/黑暗12 h),用无菌水浸种后的种子发芽率为49.67%。(2)GA3 100 ~ 600 mg·L-1和NAA 5 ~ 30 mg·L-1可以提高种子的发芽率、发芽势和发芽指数,缩短发芽启动时间和发芽持续时间,对种子的萌发有促进作用。(3)6-BA 5 mg·L-1和10 mg·L-1对种子的萌发有一定的促进作用,但不显著,6-BA浓度≥15 mg·L-1则抑制种子的萌发。(4)用GA3 500 mg·L-1浸种后的种子发芽指标最好,发芽率、发芽势和发芽指数分别为69.67%、33.00%、4.51,种子的发芽起始时间和发芽持续时间分别为10.67 d、11.67 d。
关键词: 多刺绿绒蒿, 种子, 萌发, 消毒剂, 浸种时间, 温度, 外源植物激素
中图分类号: Q945.35,R282.2 文獻标识码: A 文章编号: 1000-3142(2019)07-0902-08
Abstract: Meconopsis horridula is an endangered annual herb belonging to family Papaveraceae. M. horridula is a rare alpine flower, and is a kind of traditional Tibetan medicine. In order to provide a scientific reference for the seed bree-ding and artificial cultivation of M. horridula, the germination characteristics of seeds were studied under the different conditions of disinfector, soaking time, temperature and exogenous plant hormone. The results were as follows: (1) The optimum conditions of seed disinfection method, soaking time, temperature and illumination were 75% ethanol 1 min + 3% H2O2 5 min, 24 h and 20 ℃/10 ℃ (illumination 12 h/darkness 12 h), respectively, and the germination rate of disinfected seeds after soaked in sterile water 24 h was 49.67%. (2) Both GA3 100-600 mg·L-1 and NAA 5-30 mg·L-1 had effects on promotion the germination of seeds, mainly by improving seed germination rate, germination potential and germination index, and shortening germination start time and germination duration time. (3) 6-BA 5 mg·L-1 and 10 mg·L-1 both could promote the germination of seeds, but the effects were not significant, and when the 6-BA concentration higher than 15 mg·L-1, the germination of seeds were inhibited. (4) The germination data of M. horridula seeds soaked with GA3 500 mg·L-1 were the best. The germination rate, germination energy and germination index of seeds were 69.67%, 33.00% and 4.51, respectively, and the germination start time and germination duration time of seeds were 10.67 d and 11.67 d, respectively.
Key words: Meconopsis horridula, seed, germination, disinfector, soaking time, temperature, exogenous plant hormone
绿绒蒿属(Meconopsis Vig.)是罂粟科绿绒蒿属植物的总称,全世界共有54种,中国有43种。本属植物共有18种入药,其中多刺绿绒蒿(Meconopsis horridula )是本属最具代表性的常用藏药材(赵凤等,2017)。多刺绿绒蒿为一年生草本植物,生长于海拔3 600~5 100 m的草坡或石坡上,在中国主要分布于西藏(广泛分布)、甘肃西部、青海东部至南部、四川西部(中国植物志编委会,1999)。多刺绿绒蒿是享誉海内外的珍稀高山花卉,被称作“喜马拉雅蓝罂粟”,以全草或地上部分入药,藏语名为“刺尔恩”(赵凤等,2017)。《晶珠本草》中记载,“刺尔恩”味苦,功效清热,具有接骨、活血化瘀、止痛的作用,为治头创伤最有疗效之药,藏医多用于治疗头伤、骨折、跌打损伤等,临床上多以复方形式入药(帝玛尔·丹增彭措,2012;中国科学院西北高原生物研究所,1991)。《中华人民共和国卫生部药品标准》收载了十余种含有多刺绿绒蒿的藏药成方制剂(中华人民共和国卫生部药典委员会,1995)。目前,已从多刺绿绒蒿中分离得到生物碱类、黄酮类、萜类、甾体类等化合物,现代药理学研究多围绕抗癌、抗病毒、心脏保护等方面(赵凤等,2017;Guo et al.,2016;Fan et al.,2015)。
多刺绿绒蒿的生境特殊,储量有限,加之引种驯化困难,商品多刺绿绒蒿主要以野生为主,导致其野生资源急剧减少。在2005年,多刺绿绒蒿被列为西藏自治区Ⅲ级濒危藏药材。卢杰等根据西藏自治区(中)藏药资源的调查数据,建议将其列入Ⅰ级濒危藏药材名录(卢杰等,2011;卢杰和兰小中,2013a,2013b)。保护绿绒蒿野生资源并解决市场资源紧缺问题,最重要的是发展人工栽培(索南仁欠,2017)。种子繁殖方式既能保证后代种群的遗传多样性,又能增强幼苗的抗逆性和生长潜力,是植物人工栽培最易成功的一种繁殖方式(屈燕和区智,2012)。对于长年生长于高寒山区,生态幅度较小的绿绒篙引种时,以种子进行繁殖比移植效果更好(董晓东等,1995)。
多刺绿绒蒿种子休眠为PY+PD(物理休眠和生理休眠)型复合休眠,且自然状态下发芽率低,给人工栽培带来了一定的困难(达清璟等,2018),所以打破休眠提高种子发芽率,是开展多刺绿绒蒿人工栽培的首要任务,但是目前有关此方面的研究报道甚少。因此,本研究以多刺绿绒蒿种子为材料,运用发芽试验方法,探讨不同消毒剂、不同浸种时间与萌发温度及外源植物激素对多刺绿绒蒿种子萌发的影响,以期提高多刺绿绒蒿种子发芽率,为这一珍贵观赏与药用植物资源的保护、栽培和引种驯化等提供一定的理论依据。
1 材料与方法
1.1 材料
多刺绿绒蒿种子于2015年9月采自西藏自治区那曲市嘉黎县。种子自然干燥后于4 ℃低温贮藏6个月。种子千粒重为(0.096 2±0.008 5)g。
1.2 方法
1.2.1 种子消毒处理 将种子先用流水冲洗10 min,然后转入超净工作台进行消毒处理。先用将种子75%乙醇消毒1 min,无菌水冲洗3次,再分别用0.1% HgCl2、2% NaClO和3% H2O2消毒5 min或10 min,无菌水冲洗3次。接种前,用无菌水浸泡种子12 h。共6个消毒处理,每个处理设3次重复,每个重复1个培养皿,每个培养皿接种100粒种子,在培养箱中于20 ℃、12 h光照/12 h黑暗交替下培养。
1.2.2 浸种时间与萌发温度处理 浸种时间设置为不浸种、浸种12 h、18 h和24 h共4个处理。参考西藏自治区气温变化资料(杜军等,2016;杨春艳等,2014),萌发温度设置为15 ℃、20 ℃、20 ℃/10 ℃(光照/黑暗)、25 ℃和25 ℃/15 ℃(光照/黑暗)共5个处理。光照条件为12 h光照/12 h黑暗交替。根据1.2.1的试验结果,种子用最适消毒方法(75%乙醇1 min + 3% H2O2 5 min)消毒后,先用无菌水经不同时间的浸种,然后将种子置于设置有不同萌发温度的培养箱中培养。每个处理设3次重复,每个重复1个培养皿,每个培养皿接种100粒种子。
1.2.3 外源植物激素处理 根据本课题组前期研究,选用赤霉素(GA3)、6-苄氨基腺嘌呤(6-BA)和萘乙酸(NAA)三种植物激素,质量浓度分别设置为GA3(100、200、300、400、500、600 mg·L-1)、6-BA(5、10、15、20、25、30 mg·L-1)、NAA(5、10、15、20、25、30 mg·L-1)。经过消毒处理的种子,用无菌水(对照)和不同质量浓度的GA3、6-BA、NAA分别浸种24 h后,无菌水冲洗3次。每个处理设3次重复,每个重复1个培养皿,每个培养皿接种100粒种子。在培养箱中20 ℃/10 ℃(光照/黑暗)、12 h光照/12 h黑暗交替下培养。浸种时间24 h与萌发温度20 ℃/10 ℃从1.2.2的试验结果获得。
上述处理中使用的不同消毒剂和植物激素均用无菌水配制,植物激素母液经抽滤灭菌。采用培养皿纸床发芽法,将两层PhytoTC种子萌发纸(购自北京启维益成科技有限公司)铺在培养皿中高温高压灭菌后,将培养皿内的萌发纸用无菌水浸湿,种子均匀撒播在萌发纸上,并用Parafilm封口膜进行封口。
1.2.4 测定指标与计算 以胚根露出种孔2 mm为种子的萌发标志。从处理当天开始,每24 h记录每皿中萌发的种子数,并移出已萌发的种子,连续7 d对照组和试验组的种子萌发数不变时视为种子萌发进程结束。统计种子的污染率、发芽启动时间、发芽持续时间、发芽率、发芽势及发芽指数(郑道君等,2017;郭秋菊等,2018)。(1)污染率=污染种子数/供试种子总数×100%;(2)发芽启动时间,即萌发时滞,指从萌发试验开始到第1粒种子开始萌发所持续的天数;(3)发芽持续时间,即种子开始萌发到最后1粒种子萌发的总天数;(4)发芽率=种子发芽总数/供试种子总数×100%;(5)发芽势=日发芽种子最大时的发芽种子数/供试种子总数×100%;(6)发芽指数=∑(Gt/Dt),其中Gt为t日内的发芽数,Dt为相应的发芽日数。
1.3 数据处理
试验数据采用Excel 2010进行整理和作图,SPSS 19.0进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 不同消毒处理对多刺绿绒蒿种子消毒效果和萌发的影响
种子病虫害直接影响种子发芽率。由表1可知,不同消毒處理对多刺绿绒蒿种子的消毒效果和萌发有显著影响。75%乙醇1 min + 0.1% HgCl2 5 min、75%乙醇1 min + 0.1% HgCl2 10 min和75%乙醇1 min + 2% NaClO 10 min等3个处理的种子污染率均为0,其余3个处理的种子带菌,但污染率均低于7%。0.1% HgCl2的消毒效果最好,其次为2% NaClO,3% H2O2的消毒效果较差。从种子的萌发情况来看,0.1% HgCl2对种子萌发的抑制作用最大,种子萌发率低于4%;其次为2% NaClO;3% H2O2对种子萌发的抑制作用最小。75%乙醇1 min + 3% H2O2 5 min消毒处理的种子,虽然污染率为6.67%,但是种子萌发最快(13.33 d),发芽持续时间较短(13.67 d),发芽率最高(26.67%)。
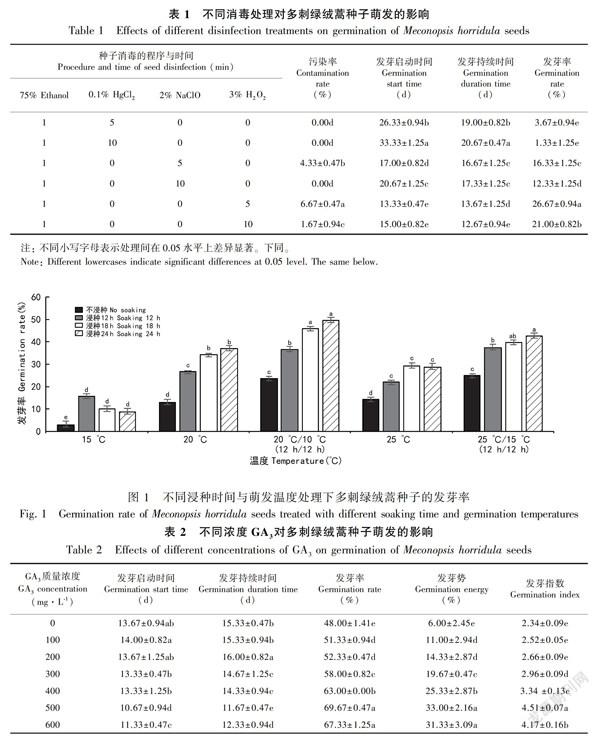
2.2 不同浸种时间与萌发温度对多刺绿绒蒿种子发芽率的影响
由图1可知,多刺綠绒蒿种子在不同浸种时间与萌发温度的交互作用下, 发芽率呈现出不同的变化趋势。在15 ℃和25 ℃时,随着浸种时间的延长,发芽率呈现先升高后降低的趋势。在20 ℃、20 ℃/10 ℃和25 ℃/15 ℃时,随着浸种时间的延长,发芽率逐渐升高,且在相同温度条件下,浸种18 h和24 h的发芽率显著高于不浸种和浸种12 h的发芽率。在同一浸种时间下,变温处理的发芽率显著高于恒温处理,在20 ℃/10 ℃时,浸种18 h的发芽率为46.00%,24 h的发芽率为49.67%。综上所述,在浸种24 h、萌发温度为20 ℃/10 ℃的条件下多刺绿绒蒿的种子发芽率最高,并将该条件作为不同浓度GA3、6-BA和NAA处理种子的试验条件。
2.3 不同浓度外源植物激素对多刺绿绒蒿种子萌发的影响
2.3.1 不同浓度GA3对多刺绿绒蒿种子萌发的影响 由表2可知,不同浓度GA3显著提高了种子发芽率,处理后的发芽率为51.33% ~ 69.67%,而对照(GA3 0 mg·L-1)的发芽率为48.00%。其中,500 mg·L-1处理下发芽率最高,比对照高21.67%;其次为 600 mg·L-1,发芽率比对照高19.33%;500 mg·L-1与600 mg·L-1处理间无显著差异。同时,GA3处理也提高了发芽势和发芽指数,各处理之间有明显差异。发芽势和发芽指数随着GA3浓度的增大而逐渐升高,在500 mg·L-1处理下达到峰值,分别比对照高27.00%和2.17。当GA3浓度为600 mg·L-1时,发芽势和发芽指数有所降低。另外,GA3 100 ~ 400 mg·L-1对缩短发芽启动时间和发芽持续时间的作用不明显。GA3 500 mg·L-1极显著地缩短了种子发芽启动时间和持续时间,比对照提前3 d萌发,从萌发开始到结束持续11.67 d,比对照缩短3.66 d。当GA3浓度为600 mg·L-1时,发芽启动时间和持续时间呈增加趋势。综上所述,在试验设定的不同浓度GA3处理中,用500 mg·L-1浸种最好。
2.3.2 不同浓度6-BA对多刺绿绒蒿种子萌发的影响 由表3可知,不同浓度6-BA对多刺绿绒蒿种子的萌发有着不同的影响。发芽启动时间随着6-BA浓度的增大而逐渐延长,在5 mg·L-1处理下发芽启动时间比对照延长0.33 d,在30 mg·L-1处理下发芽启动时间比对照延长11.33 d。发芽持续时间则随着6-BA浓度的增大而逐渐缩短,在30 mg·L-1处理下,从种子萌发开始到结束持续5.33 d,比对照缩短10 d。随着浓度的增大,发芽率、发芽势和发芽指数呈先升高后降低的趋势。当6-BA的浓度为 5 mg·L-1和10 mg·L-1时,发芽率、发芽势和发芽指数均高于对照,但发芽率和发芽指数与对照无显著差异。其中,5 mg·L-1处理下,发芽率、发芽势和发芽指数最高,分别比对照高6.67%、1.00%和0.39。当6-BA浓度≥15 mg·L-1时,则对种子萌发表现为一定的抑制作用,且质量浓度越高抑制作用越明显。综上所述,在试验设定的不同浓度的6-BA处理中,用 5 mg·L-1浸种最好。
2.3.3 不同浓度NAA对多刺绿绒蒿种子萌发的影响 由表4可知,一定质量浓度的NAA可以提高多刺绿绒蒿种子的发芽率、发芽势、发芽指数,缩短种子发芽启动时间和发芽持续时间。NAA 20、25 mg·L-1处理下种子发芽率、发芽势、发芽指数显著高于对照(NAA 0 mg·L-1)。20 mg·L-1处理下种子发芽势(21.00%)和发芽指数(3.16)最高,分别比对照高15%和0.82。25 mg·L-1处理下发芽率(61.67%)最高,分别比对照和20 mg·L-1处理高13.67%和2.00%,但是发芽势和发芽指数比20 mg·L-1处理降低了1.67%和0.25。另外,25 mg·L-1处理下,种子萌发最快,比对照提前2.67 d萌发,发芽持续时间比对照缩短5.33 d。当浓度为30 mg·L-1时,发芽率、发芽势、发芽指数显著降低,且发芽指数低于对照。综上所述,在试验设定的不同浓度的NAA处理中,用25 mg·L-1浸种最好。
2.3.4 GA3、6-BA和NAA最优处理的比较分析 对2.3.1 ~ 2.3.3分析中GA3、6-BA和NAA的最优处理进行比较分析的结果见图2。由图2可知,在发芽率方面,GA3 500 mg·L-1、6-BA 5 mg·L-1和NAA 25 mg·L-1处理下种子发芽率与对照差异显著,发芽率均高于对照;其中GA3 500 mg·L-1处理的种子发芽率最高,为69.67%,比对照高21.67%。在发芽势方面,三种试剂最优处理下种子发芽势均高于对照;GA3 500 mg·L-1处理的种子发芽势最高,为33.00%,比对照高27.00%;其次为NAA 25 mg·L-1处理下种子发芽势比对照高13.33%;6-BA 5 mg·L-1处理下种子发芽势与对照无显著差异。在发芽指数方面,除了GA3 500 mg·L-1处理外,其他处理的发芽指数与对照均无显著差异。在发芽启动时间方面,除了6-BA 5 mg·L-1处理的种子发芽启动时间与对照无显著差异外,其他处理均可缩短发芽启动时间,促进种子提前萌发;其中,GA3 500 mg·L-1处理的种子发芽最快,比对照提前3 d萌发。在发芽持续时间方面,三种试剂最优处理下种子发芽持续时间与对照差异显著,发芽持续时间均低于对照,其中NAA 25 mg·L-1处理的种子10 d左右萌发结束,比对照缩短5.33 d。但是,NAA 25 mg·L-1处理下种子发芽率、发芽势和发芽指数均低于GA3 500 mg·L-1处理。综上所述,GA3 500 mg·L-1对多刺绿绒蒿种子萌发的促进作用最显著。
3 讨论与结论
多刺绿绒蒿是一种极具观赏价值和药用价值的高山植物,提高其种子发芽率将有利于引种驯化工作的进一步开展。影响种子萌发的因素有很多,包括外部生态因素和内部生理因素,对不同植物来说,影响种子萌发的主要因子也有差异(徐恒恒等,2014;屈燕和区智,2012)。
种子萌发容易受到病害的影响,许多病害都是由带菌种子引起的。本课题组在预试验中发现不进行消毒处理的多刺绿绒蒿种子,其带菌率为53.00%,发芽率仅为9.67%,且幼苗的长势差。在本试验中,采用75%乙醇1 min + 3% H2O2 5 min的方法对种子消毒,消毒效果较好,种子发芽率提高到26.67%,说明多刺绿绒蒿种子病害对种子的萌发具有一定的抑制作用,通过适当的消毒处理可提高种子的发芽率。另外,与0.1% HgCl2和2% NaClO相比较,3% H2O2在达到消毒效果的同时,还具有促进多刺绿绒蒿种子萌发的作用,可能是由于适当浓度的H2O2可轻度腐蚀种皮,提高种皮的通透性,为种子提供充足的氧气而解除休眠(何士敏等,2008)。H2O2在促进种子萌发方面的另一个作用是刺激对解除种子休眠有重要作用的一条胚乳物质代谢途径——磷酸戊糖途径(徐是雄等,1987)。
种子萌发起始于水分吸胀(徐恒恒等,2014)。在种子萌发特性研究中,浸种是比较常用的破除休眠的物理方法。屈燕等(2018)研究了清水浸种不同时间对总状绿绒蒿种子萌发的影响,结果显示,浸种24 ~ 36 h,均可增加种子发芽率和发芽势。达清璟等(2018)的研究显示,多刺绿绒蒿种子在浸种18 h后达到最大吸水率97.80%,浸种20 h后吸水达到饱和,并趋于动态平衡。在本试验中,在适宜的温度条件下,分别浸种12 h、18 h和24 h均可显著提高多刺绿绒蒿种子的发芽率,虽然浸种18 h和24 h的发芽率无显著差异,但是浸种24 h的发芽率最高(49.67%),说明种皮对种子的萌发不造成透性障碍,这与达清璟等(2018)的研究结果一致。
温度也是影响种子萌发的重要因子。本试验研究了3个恒温条件(15 ℃、20 ℃、25 ℃)和2个变温条件(20 ℃/10 ℃、25 ℃/15 ℃)对多刺绿绒蒿种子发芽率的影响,结果表明20 ℃/10 ℃变温处理更有利于多刺绿绒蒿种子的萌发,原因是多刺绿绒蒿生长在海拔3 600 ~ 5 100 m的地区,高海拔地区气温低,昼夜温差大,本试验设置的20 ℃/10 ℃温度条件比较符合西藏高海拔地区春季气温的变化规律。
外源激素法是揭示种子休眠和萌发的激素调控机理的重要研究方法,已被广泛应用于种子萌发特性研究(徐恒恒等,2014)。屈燕等(2018)将总状绿绒蒿的种子用GA3 250 mg·L-1和NAA 10 mg·L-1浸种24 ~ 36 h后,均能达到较好的萌发效果;而6-BA处理抑制总状绿绒蒿种子的萌发。在本试验中,GA3 500 mg·L-1在打破多刺绿绒蒿种子休眠促进其萌发方面效果显著,其次为NAA 25 mg·L-1处理;低浓度6-BA(<15 mg·L-1)虽然能够促进多刺绿绒蒿种子的萌发,但影响不显著,高浓度6-BA(≥15 mg·L-1)则会抑制多刺绿绒蒿种子的萌发,这与屈燕等(2018)对总状绿绒蒿进行的相关研究结果相似。
综合消毒剂、浸种时间、温度和外源植物激素对多刺绿绒蒿种子萌发特性的影响,得出多刺绿绒蒿种子经75%乙醇1 min + 3% H2O2 5 min消毒后,用GA3 500 mg·L-1浸种24 h,在20 ℃/10 ℃(光照12 h/黑暗12 h)条件下,种子萌发最快,发芽率和发芽整齐度最高。由于本研究只比较了3种外源植物激素对多刺绿绒蒿种子萌发时期的影响,这3种外源植物激素对幼苗生长有何影响及是否存在能更好地促进多刺绿绒蒿种子萌发的其他外源植物激素还有待进一步研究。
参考文献:
China Flora Editorial Board, 1999. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, (32): 7, 46. [中國植物志编委会,1999. 中国植物志 [M]. 北京:科学出版社, (32):7,46.]
Chinese Pharmacopoeia Commission, 1995. Drugstandard of ministry of public health of the peoples republic of China: Tibetan medicine·Book 1 [S]. Beijing: Ministry of Health of the Peoples Republic of China. [中华人民共和国卫生部药典委员会,1995. 中华人民共和国卫生部药品标准:藏药·第一册 [S]. 北京:中华人民共和国卫生部.]
DA QJ, CHEN XL, GUAN XJ, et al., 2018. Seed dormancy and relieved methods of Meconopsis horridula Hook. [J]. Bull Biol, 53(4): 51-56. [达清璟, 陈学林, 管熊娟, 等, 2018. 多刺绿绒蒿种子休眠及破除方法 [J]. 生物学通报, 53(4):51-56.]
DA QJ, CHEN XL, ZHANG QW, et al., 2018. Seed dormancy and relieved methods of Meconopsis racemosa [J]. Chin Med Mat, 41(4): 800-805. [达清璟, 陈学林, 张庆雯, 等, 2018. 总状绿绒蒿种子休眠及破除方法 [J]. 中药材, 41(4):800-805.]
DIMAER DZPC, 2012. Jing zhu materia medica: Part 2 [M]. Shanghai: Shanghai Scientific & Technical Publishers: 118. [帝玛尔·丹增彭措, 2012. 晶珠本草:下部 [M]. 上海:上海科学技术出版社:118.]
DONG XD, ZHAO H, MA YX, 1995. Germplasm resources and evaluation of Meconopsis plants in Yunnan Province [J]. J Dali Teach Coll (Nat Sci Ed), (1): 42-46. [董晓东, 赵宏, 马玉心, 1995. 云南绿绒蒿植物种质资源及评价 [J]. 大理师专学报(自然科学版), (1):42-46.]
DU J, MA PF, PAN D, 2016. Spatial-temporal change of air temperature at 02, 08, 14 and 20 Bejing time over Tibet during 1981-2014 [J]. Acta Geogr Sin, 71(3): 422-432. [杜军, 马鹏飞, 潘多, 2016. 1981-2014年西藏各时次气温的变化趋势分析 [J]. 地理学报, 71(3):422-432.]
FAN JP, WANG YQ, WANG XB, et al., 2015. The antitumor activity of Meconopsis horridula Hook, a traditional tibetan medical plant, in murine leukemia L1210 cells [J]. Cell Physiol Biochem, 37(3): 1055-1065.
GUO Q, BAI R, ZHAO B, et al., 2016. An ethnopharmacolo-gical, phytochemical and pharmacological review of the genus Meconopsis [J]. Am J Chin Med, 44 (3): 439-462.
GUO QJ, WANG ZM, DENG ZZ, 2018. Influences of different sodium selenite concentrations on seed germination of Metasequoia glyptostroboides [J]. Guihaia, 38(10): 1319-1325. [郭秋菊, 王志鳴, 邓桢珍, 2018. 不同浓度亚硒酸钠溶液对水杉种子萌发的影响 [J]. 广西植物, 38(10):1319-1325.]
HE SM, WANG JH, BAI ZM, et al., 2008. Effect of H2O2 seed soaking on physiological and biochemical characters of soybean germinating [J]. Soyb Sci, 27(1): 176-180. [何士敏, 汪建华, 白珍明, 等, 2008. 过氧化氢浸种对大豆种子萌发的生理生化效应 [J]. 大豆科学, 27(1):176-180.]
LU J, LAN XZ, 2013a. An investigation on rare and endangered Tibetan medicinal plants in Lhasa region [J]. Chin J Chin Mat Med, 38 (1): 127-132. [卢杰, 兰小中, 2013a. 拉萨市珍稀濒危藏药植物资源调查研究 [J]. 中国中药杂志, 38 (1):127-132.]
LU J, LAN XZ, 2013b. The characteristics of the rare and endangered Tibetan medicinal plant resources in Shannan region [J]. J Nat Resour, 28 (11): 1977-1987. [卢杰, 兰小中, 2013b. 山南地区珍稀濒危藏药植物资源特征 [J]. 自然资源学报, 28 (11):1977-1987.]
LU J, LAN XZ, LUO J, 2011. Investigation and evaluation of the rare and endangered Tibetan medicinal plants in the Linzhi region [J]. Resour Sci, 33(12): 2362-2369. [卢杰, 兰小中, 罗建, 2011. 林芝地区珍稀濒危藏药植物资源调查与评价 [J]. 资源科学, 33(12):2362-2369.]
Northwest Institute of Plateau Biology, Chinese Academy of Sciences, 1991. Flora of Tibetan medicine [M]. Xining: Qinghai Peoples Publishing House: 294. [中国科学院西北高原生物研究所, 1991. 藏药志 [M]. 西宁:青海人民出版社:294.]
QU Y, OU Z, 2012. The research advancement on the genus Meconpsis [J]. N Hortic, (2): 191-194. [屈燕, 区智, 2012. 绿绒蒿属植物国内外研究进展 [J]. 北方园艺, (2):191-194.]
QU Y, OU Z, XIA Y, et al., 2018. Effects of different pretreatment on germination features of Meconopsis racemosa Maxim. seeds [J]. Seed, 37(2): 5-9. [屈燕, 区智, 夏樱, 等, 2018. 不同前处理对总状绿绒蒿种子萌发特性的影响 [J]. 种子, 37(2):5-9.]
SUONAN RQ, 2017. Preliminary discussion on the current situation and suggestion of Tibetan medicine resources protection and development [J]. J Med Pharm Chin Minorities, (6): 32-33. [索南仁欠, 2017. 初探藏药材资源保护发展的现状和建議 [J]. 中国民族医药杂志, (6):32-33.]
XU HH, LI N, LIU SJ, et al., 2014. Research progress in seed germination and its control [J]. Acta Agron Sin, 40(7): 1141-1156. [徐恒恒, 黎妮, 刘树君, 等, 2014. 种子萌发及其调控的研究进展 [J]. 作物学报, 40(7):1141-1156.]
XU SX, TANG XH, FU JR, 1987. Study advance of seed phy-siology [M]. Guangzhou: Sun Yat-sen University Press: 120-122. [徐是雄, 唐锡华, 傅家瑞, 1987. 种子生理的研究进展 [M]. 广州:中山大学出版社:120-122.]
YANG CY, SHEN WS, LIN NF, 2014. Climate change and its regional differences over the Tibet Plateau [J]. Arid Land Geogr, 37(2): 290-298. [杨春艳, 沈渭寿, 林乃峰, 2014. 西藏高原气候变化及其差异性 [J]. 干旱区地理, 37(2):290-298.]
ZHAO F, ZHANGHE XG, BAI RF, et al., 2017. Advance of a representative traditional Tibetan medicine Meconopsis horridula on its phytochemical and pharmacological aspects [J]. Chin J Chin Mat Med, 42(19): 3676-3683. [赵凤, 张和新歌, 白睿峰, 等, 2017. 藏药多刺绿绒蒿的化学和药理学研究进展 [J]. 中国中药杂志, 42(19):3676-3683.]
ZHENG DJ, YANG LR,YUN Y, et al., 2017. Seed dormancy mechanism and its ecological significance of endangered species Dracaena cambodiana [J]. Guihaia, 37(12): 1551-1559. [郑道君, 杨立荣, 云勇, 等, 2017. 濒危植物海南龙血树种子休眠机理及其生态学意义 [J]. 广西植物, 37(12):1551-1559.]

