不同品种罗望子果肉和种子多糖结构及抗氧化活性比较
刘孝平 邹雨珂 刘路 余生玲 邓颖 陈安均






摘要:【目的】對不同品种罗望子的果肉和种子多糖进行提取、结构鉴定及抗氧化活性测定,考察罗望子品种和部位间的多糖结构和体外抗氧化活性差异,为罗望子资源的开发与利用提供参考依据。【方法】以紫外光谱、红外光谱和单糖组成对马蹄酸角(酸型罗望子)和米易酸角(甜型罗望子)的果肉和种子多糖纯度及结构进行评价,并测定4种多糖对DPPH自由基、ABTS自由基和羟基(OH·)自由基的清除能力及铁离子还原能力。【结果】甜型和酸型两种罗望子的果肉多糖均为酸性杂多糖,种子多糖主要由葡萄糖、木糖和半乳糖组成,果肉多糖主要由葡萄糖、半乳糖醛酸、阿拉伯糖和半乳糖组成,其中甜型罗望子果肉多糖比酸型罗望子多糖含有更高比例的葡萄糖。两种果肉多糖在质量浓度为3 mg/mL时,对3种自由基的清除率均高于50.00%,强于两种种子多糖;酸型罗望子种子多糖体外抗氧化活性略强于甜型罗望子种子多糖。4种多糖对铁离子的还原能力均较弱。【结论】罗望子果肉和种子多糖的结构组成和抗氧化活性在品种间差异较小,其果肉多糖是一种良好的自由基清除剂,在食品与医药领域具有一定的应用潜力。
关键词: 罗望子;品种;单糖;结构;抗氧化活性;高效液相色谱
中图分类号: S792.99 文献标志码: A 文章编号:2095-1191(2019)08-1807-07
Comparison of structure and antioxidant activity of fruit and seed polysaccharides from different varieties of tamarind
LIU Xiao-ping, ZOU Yu-ke, LIU Lu, YU Sheng-ling, DENG Ying, CHEN An-jun*
(College of Food Science, Sichuan Agricultural University,Ya’an, Sichuan 625014, China)
Abstract:【Objective】Structure identification and antioxidant activity determination of polysaccharides from fruit flesh and seeds of different varieties of tamarind were carried out to investigate the differences of polysaccharides structure and antioxidant activity in vitro between varieties and parts of tamarind, providing reference for the development and utilization of tamarind resources. 【Method】The purity and structure of the flesh and seeds of horseshoe tamarind(sour type)and Miyi tamarind(sweet type) were evaluated by ultraviolet spectrum, infrared spectrum and monosaccharide composition. The antioxidant capacity of four kinds of polysaccharides in vitro was evaluated by DPPH free radical scavenging ability, ABTS free radical scavenging ability, OH· free radical scavenging ability and ferric reducing antioxident power. 【Result】The results showed that the two kinds of pulp polysaccharides were acidic heteropolysaccharides, and the seed polysaccharides were mainly composed of glucose, xylose and galactose. The pulp polysaccharides were mainly composed of glucose, galacturonic acid, arabinose and galactose, and the sweet tamarind pulp polysaccharide contained higher proportion glucose than the acid type tamarind polysaccharide. When the concentration of the two kinds of pulp polysaccharides was 3 mg/mL, the three free radical scavenging rates were higher than 50.00%, which were stronger than the two seed polysaccharides. The antioxidant activity of acid tamarind seed polysaccharide in vitro was slightly stronger than that of sweet tamarind seed polysaccharide. The reduction ability of four polysaccharides to iron ions was weak. 【Conclusion】The differences among the four varieties of tamarind polysaccharide are small, and tamarind pulp polysaccharide is also a good free radical scavenger with certain application potential in the field of food and medicine.
Key words: tamarind; variety; monosaccharide; structure; antioxidant activity; high performance liquid chromatography
0 引言
【研究意义】罗望子(Tamarindus indica L.)又称酸角,属常绿大型乔木,原产于非洲热带地区,目前在热带亚热带地区广泛种植。罗望子果肉味道酸甜,含有大量还原糖、多糖、有机酸、氨基酸和矿物质等,可作水果食用;其果肉还具有消炎、止泻、治疗脓疡、抑菌、降血糖和抗突变等功效(赵一鹤等,2005)。罗望子种子中含有大量多糖,研究发现罗望子种子提取物具有良好的降血糖和抗蛇毒活性(Bhadoriya et al.,2011)。多糖除了提供人体所必需的能量外,还有良好的功能活性作用,如抗氧化、抗肿瘤和降血糖等(谢明勇等,2017)。因此,研究罗望子果实中多糖结构和抗氧化活性,对进一步认识罗望子的药用机理及开发其资源具有重要意义。【前人研究进展】在罗望子果实多糖结构和物理性质方面, 赵一鹤等(2005)研究发现罗望子种子多糖分子以葡萄糖为主链,半乳糖和木糖分布在侧链,对酸、盐和热的耐受性好;Izquierdo等(2007)提取罗望子果肉粗多糖,研究发现其主要由葡萄糖、木糖和半乳糖组成,动物实验发现其具有显著的退烧消炎作用;Khounvilay和Sittikijyothin(2012)研究发现罗望子种子多糖有很好的增稠作用和凝胶性能;Sharma等(2015)对罗望子果肉水提物进行提取和鉴定,发现其属于果胶类多糖。在提取工艺方面,涂宗财等(2010)利用水提醇沉法对罗望子果肉多糖提取工艺进行优化,在最佳工艺条件(料液比1∶15、pH 6.0、提取温度90 ℃、提取时间120 min、提取次数2次)下,提取率达8.54%;Chawananorasest等(2016)利用不同原料和沉淀剂对罗望子种子多糖进行提取,结果表明,来源于饮料工厂副产物的罗望子种子经己烷脱脂处理后,用乙醇作沉淀剂,得到最高提取率为54.65%。【本研究切入点】罗望子引入亚洲后逐渐演化形成了果荚大、果肉多、含糖量高的品种,人们称之为“甜角”。甜型和酸型两个罗望子品种因为糖酸比有巨大差异从而形成不同风味,但目前鲜见对两个品种罗望子果肉和种子多糖结构及其抗氧化活性进行比较研究的文献报道。【拟解决的关键问题】对提取的4种多糖结构和体外抗氧化活性进行研究,以期深入认识罗望子不同品种和部位间多糖的差异,为罗望子的综合开发利用提供理论依据。
1 材料与方法
1. 1 试验材料
罗望子品种分别为马蹄酸角(酸型)和米易酸角(甜型),均购自四川省攀枝花市鹽边县。乙醇、抗坏血酸(Vc)、水杨酸、硫酸亚铁、过氧化氢、氯化铁、三氯乙酸和1-苯基-3-甲基-5-吡唑啉酮(PMP)均为分析纯,购自成都科隆化学品有限公司;多糖标准品(D-甘露糖、L-鼠李糖、D-半乳糖醛酸、D-葡萄糖、D-半乳糖、D-木糖、L-阿拉伯糖、D-岩藻糖)、1,1-二苯基-2-三硝基苯肼(DPPH)和2,2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)购自上海源叶生物科技有限公司。主要仪器设备:Thermo BR4i型冷冻离心机、Thermo PL3000冷冻干燥机、Spectrun100型傅里叶变换红外光谱仪(美国赛默飞世尔科技有限公司)、UV-1800PC型紫外分析仪(上海美谱达仪器有限公司)、Milli-Q型超纯水系统(美国密理博公司)、高效液相色谱仪(美国安捷伦公司)。
1. 2 试验方法
1. 2. 1 两个品种罗望子果肉和种子多糖提取 罗望子果肉多糖和种子多糖的提取分别参考涂宗财等(2010)、Chawananorasest等(2016)的方法略作改进。
1. 2. 1. 1 果肉多糖提取 将两种新鲜的罗望子分别去壳去籽得到果肉,于70 ℃烘干并粉碎后备用。称取适量的两种罗望子果肉粉末,分别按料液比1∶30加入蒸馏水,在90 ℃下浸提50 min;离心得到提取液,蒸发浓缩至1/3体积,加入3倍体积的无水乙醇,搅拌后静置12 h,离心取沉淀用无水乙醇洗涤两次后复溶,再用超纯水透析48 h后冻干,即得到酸型罗望子果肉多糖(Tamarind pulp polysaccharides,TPP)和甜型罗望子果肉多糖(Sweet tamarind pulp polysaccharides,S-TPP)。
1. 2. 1. 2 种子多糖提取 将两种罗望子种子分别与水按1∶2比例浸泡24 h后剥去种皮,于70 ℃烘干粉碎后制得种仁粉。称取适量种仁粉,按料液比1∶50加入蒸馏水,采用与果肉多糖相同的方法进行提取后得到酸型罗望子种子多糖(Tamarind seed polysaccharides,TSP)和甜型罗望子种子多糖(Sweet tamarind seed polysaccharides,S-TSP)。
1. 2. 2 紫外光谱分析 配置0.1 mg/mL多糖溶液,在190~400 nm进行紫外光谱扫描。观察280和260 nm处多糖水溶液的吸收情况,判断是否有核酸、蛋白质和多肽等物质。
1. 2. 3 红外光谱分析 分别称取4种多糖1 mg和干燥的溴化钾粉末100 mg置于玛瑙研钵中研磨均匀,压片后在400~4000 cm-1波数范围进行红外光谱检测。
1. 2. 4 单糖组成分析
1. 2. 4. 1 样品前处理 采用PMP柱前衍生化高效液相色谱法(Pan et al.,2018)分析4种多糖的单糖组成。分别称取4种多糖样品20 mg,加水定容至5.0 mL,吸取1.0 mL水溶液加入等体积6 mol/L三氟乙酸,混匀后用氮气封口,于95 ℃下反应8 h,将反应物蒸干后加入适量甲醇溶液再次蒸干制得多糖水解产物。多糖水解产物用1.0 mL 1 mg/mL岩藻糖(内标物)溶液溶解,加入1.0 mL 0.5 mol/L PMP溶液和1.0 mL 0.3 mol/L氢氧化钠溶液,于70 ℃下反应2 h进行衍生化;反应完成后加入1.0 mL 0.3 mol/L 盐酸溶液中和,最后加入4.0 mL三氯甲烷萃取,重复3次,取上层清液过0.22 μm滤膜后待测。称取适量单糖标准品鼠李糖、甘露糖、木糖、半乳糖醛酸、阿拉伯糖、葡萄糖和半乳糖,按照与样品相同的衍生化方法制得混合标准单糖溶液。
1. 2. 4. 2 色谱条件 色谱柱型号为ZORBAX Ecliose Plus C18(250 cm×4.6 mm,5 μm),流动相为0.05 mol/L磷酸盐缓冲液(pH 6.8)和乙腈(82∶18),流速0.8 L/min,检测波长250 nm,柱温27 ℃,进样量10 μL。
1. 2. 5 体外抗氧化活性测定 将4种多糖样品和Vc均配制成1、2、3、4、5、6、7、8和9 mg/mL 9个质量浓度梯度,用于体外抗氧化活性指标检测,吸光值测定3次,取平均值。
1. 2. 5. 1 DPPH自由基清除能力测定 取1.0 mL不同质量浓度的多糖溶液,加入0.5 mL 0.35 mg/mL DPPH溶液,振荡混合后迅速放入暗处反应20 min,12000 r/min离心10 min,取上清液于517 nm测定吸光值Ai。以无水乙醇替代DPPH溶液测定吸光值Aj,以蒸馏水替代样品溶液测得吸光值A0(李姝蓓等,2013)。以相同质量浓度的Vc作阳性对照,根据公式计算样品DPPH自由基清除率:
DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100
1. 2. 5. 2 ABTS自由基清除能力测定 将25.0 mL 7 mmol/L ABTS溶液和440 μL 140 mmol/L过硫酸钾溶液混合,避光反应16 h后取5.0 mL用PBS缓冲液(pH 7.4)稀释,直至稀释液在734 nm处吸光值为0.7±0.2。取不同质量浓度的多糖溶液100 μL,迅速加入稀释后的ABTS溶液,混合后于暗室避光反应10 min,然后迅速在734 nm处检测其吸光值Ai,以蒸馏水替代样品测得其吸光值A0(Razali et al.,2012)。以相同质量浓度的Vc作阳性对照,根据公式计算样品ABTS自由基清除率:
ABTS自由基清除率(%)=(A0-Ai)/A0×100
1. 2. 5. 3 羟基(OH·)自由基清除能力测定 依次向刻度试管中加入1.0 mL 9 mmol/L水杨酸—乙醇溶液、1.0 mL 9 mmol/L硫酸亚铁溶液和不同质量浓度多糖溶液,最后加入1.0 mL 8.8 mmol/L硫酸亚铁溶液后迅速转移至37 ℃水浴锅中反应30 min,于510 nm处测定吸光值Ai。以蒸馏水替代过氧化氢测得吸光值Ai0,以蒸馏水替代样品测得吸光值A0(杨江涛等,2008)。以相同质量浓度的Vc作阳性对照,根据公式计算OH·自由基清除率:
OH·自由基清除率(%)=[1-(Ai-Ai0)/A0]×100
1. 2. 5. 4 铁离子还原能力测定 取不同质量浓度的多糖溶液1.0 mL置于试管中,加入2.0 mL 0.2 mol/L磷酸緩冲液(pH 6.6)和2.0 mL 1%铁氰化钾溶液,混匀后迅速于50 ℃反应20 min,取出迅速冷却至室温后加入2.0 mL三氯乙酸终止反应。取反应液1.0 mL加入2.0 mL蒸馏水和0.4 mL 0.1%氯化铁溶液,放入暗室反应30 min后于700 nm处测定吸光值Ai(Tsai et al.,2006)。
2 结果与分析
2. 1 4种多糖紫外光谱分析结果
由图1可知,甜型罗望子的果肉和种子多糖(S-TPP和S-TSP)在260和280 nm处几乎无吸收峰,说明这两种多糖中蛋白质和核酸含量很少;而酸型罗望子的果肉和种子多糖(TPP和TSP)在280 nm处有一定吸收峰,说明这两种多糖中含有少量的蛋白质。
2. 2 4种多糖红外光谱分析结果
由图2可知,4种多糖在3420 cm-1附近均出现吸收峰,可能是由于分子内或糖类分子间的O-H键伸缩振动产生(Jia et al.,2015),其中TSP和S-TSP两种多糖在2924 cm-1附近的吸收峰为烷基的C-H键伸缩振动产生,这两组峰均属于多糖的特征吸收峰(Xu et al.,2016)。在蛋白质的特征吸收谱带,在酰胺Ⅰ区(1600~1700 cm-1),TSP和S-TSP在1625 cm-1处有吸收峰,则归因于蛋白质的β折叠构型(李家旺等,2016);4种多糖在酰胺Ⅱ区(1480~1575 cm-1)均未发现明显吸收峰;而在酰胺Ⅲ区(1260~1330 cm-1),S-TPP和TPP有许多小的吸收峰,说明两种果肉多糖含有少量蛋白质。结合紫外光谱结果可知,4种多糖均含有蛋白质,但由紫外光谱图可看出4种多糖在260 nm处吸收峰不明显,说明4种多糖中蛋白质含量均较少。
其中,两种果肉多糖在1410 cm-1附近的吸收峰可能是由于羧基C-O伸缩振动产生(Zheng et al.,2016)。953~1180 cm-1是糖类化合物的特征吸收区,蛋白质在此谱带的吸收较弱(Oliver et al.,2009)。S-TPP和TPP在1068 cm-1处的吸收峰为吡喃糖环醚键C-O-C;S-TSP和TSP在1041 cm-1附近的吸收峰为木葡聚糖中C-O和C-C的伸缩振动,在1373 cm-1附近的吸收峰为木葡聚糖中CH2的弯曲振动(Alpizar-Reyes et al.,2017)。S-TPP和TPP在790 cm-1处特征吸收峰为吡喃糖上对称呼吸振动,在683 cm-1附近的吸收峰推测果肉多糖中存在吡喃糖的酸性糖,且结构中存在α构型糖苷键(Wu et al.,2012)。400~600 cm-1为吡喃环的特征吸收峰,证明了吡喃糖的存在(王小梅等,2018)。
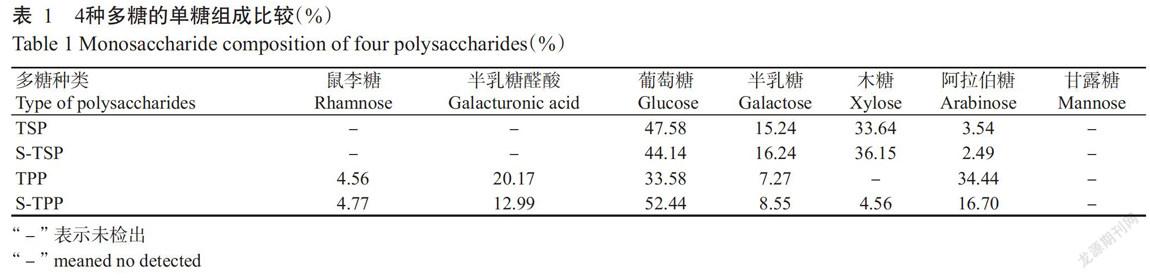
2. 3 4种多糖的单糖组成分析结果
4种多糖的单糖物质量百分比如表1所示,4种多糖及单糖对照品的高效液相色谱图如图3所示,8种单糖标准品在60 min内达到很好的基线分离效果,出峰顺序为甘露糖→鼠李糖→半乳糖醛酸→葡萄糖→半乳糖→木糖→阿拉伯糖→岩藻糖。由表1可知,4种多糖均不含有甘露糖,其中TSP和S-TSP主要由葡萄糖、木糖和半乳糖组成,并含有少量的阿拉伯糖;而TPP和S-TPP主要由葡萄糖、半乳糖醛酸、阿拉伯糖和半乳糖组成,并含有少量的鼠李糖和木糖,说明TPP和S-TPP是一类酸型杂多糖,与红外光谱结果一致。相对于种子多糖,两种果肉多糖含有更多的半乳糖醛酸和阿拉伯糖,故推测罗望子果肉含有较多的果胶物质。其中,S-TPP相比TPP的葡萄糖含量更高,而TPP相比S-TPP含有更多的半乳糖醛酸和阿拉伯糖,推测TPP中果胶类多糖含量较高(Ridley et al.,2001),而两种种子多糖在多糖比例上无明显差异。
2. 4 4种多糖体外抗氧化活性分析结果
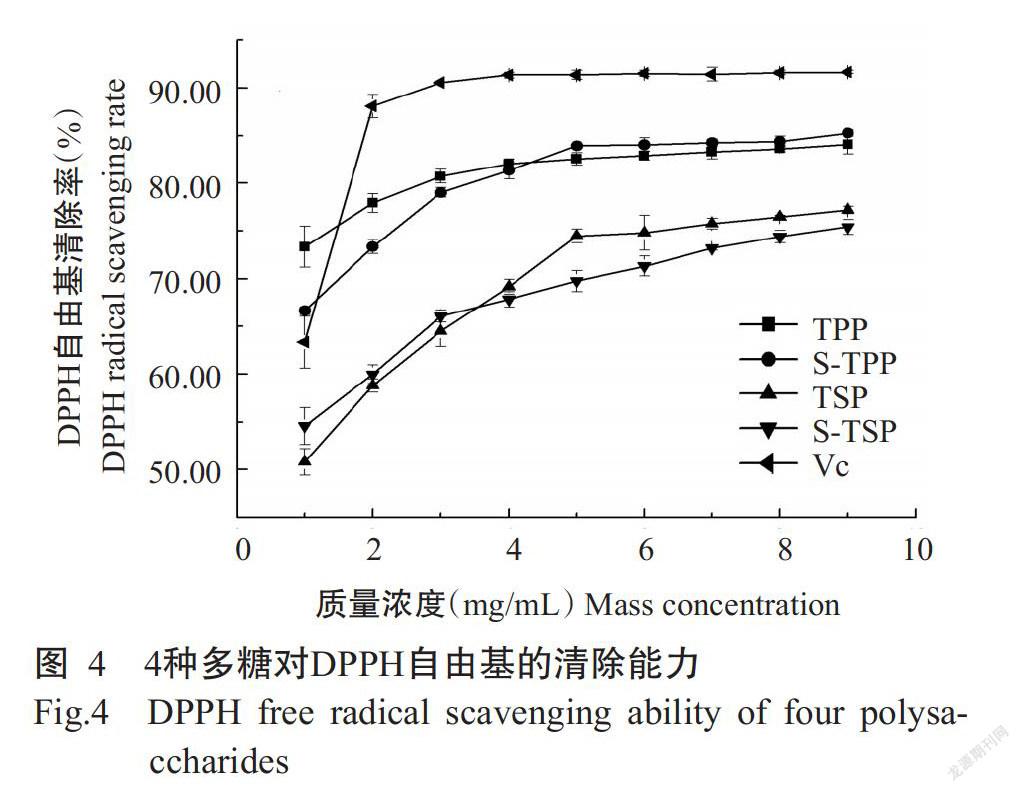
2. 4. 1 DPPH自由基清除能力 如图4所示,4种多糖清除DPPH的能力与浓度相关,随溶液质量浓度的上升,清除能力变强,在1~3 mg/mL范围内上升趋势明显。清除能力由强到弱排序为S-TPP>TPP>TSP>S-TSP,果肉多糖对DPPH自由基的清除能力整体上强于种子多糖,可能與果肉多糖中含有较多的糖醛酸有关。两种果肉多糖的DPPH自由基清除能力很强,接近于Vc,且两个果肉品种间无明显差异;比较两种种子多糖可知,酸型罗望子种子多糖(TSP)的DPPH自由基清除能力略强于甜型罗望子种子多糖(S-TSP)。
2. 4. 2 ABTS自由基清除能力 如图5所示,所有样品对ABTS自由基的清除效率均与浓度有关,随质量浓度的增加,4种多糖对ABTS自由基的清除率逐渐升高,清除能力排序为TPP>S-TPP>S-TSP>TSP;在质量浓度为9 mg/mL时,TPP、S-TPP、S-TSP和TSP对ABTS自由基的清除率分别为91.95%、86.47%、84.12%和60.94%。果肉多糖对ABTS自由基的清除能力依然强于种子多糖,其中TPP的清除能力最强,几乎接近Vc;S-TSP的清除能力接近于两种果肉多糖,而TSP清除能力远低于其他3种多糖。
2. 4. 3 OH·自由基清除能力 如图6所示,4种多糖对OH·自由基的清除能力与浓度呈正相关,清除能力排序为S-TPP>TPP>;S-TSP>TSP。当质量浓度为4 mg/mL时,S-TPP和TPP两种果肉多糖清除能力达到较高水平,在质量浓度为9 mg/mL时清除率分别为80.96%和75.10%。两种种子多糖对OH·自由基的清除率很低,其中S-TSP的清除能力略高于TSP。
2. 4. 4 铁离子还原能力 多糖分子中存在许多羟基基团,可作用于Fe3+,使其还原成Fe2+(苏平等,2018)。如图7所示,4种多糖的还原能力均远低于Vc;其中,S-TSP具有一定的铁离子还原能力, TSP还原能力很弱,而两种果肉多糖对铁离子几乎无还原活性。推测两种果肉多糖中游离的羟基基团和电子供体较少,可能与多糖的分子结构、分子质量和多糖组成有关。
3 讨论
本研究的结构解析结果显示,罗望子种子多糖主要由葡萄糖、木糖和半乳糖构成,品种间差异较小,与Khounvilay和Sittikijyothin(2012)的研究结果一致;罗望子果肉多糖主要由葡萄糖、半乳糖醛酸、阿拉伯糖和半乳糖组成,推测罗望子果肉多糖为一种含果胶类酸性糖(谢明勇等,2017),与Sharma等(2015)利用丙酮沉淀法所得到的罗望子果肉提取物相似。两个品种罗望子果肉多糖组成成分相同,但比例上存在明显差异。可见,不同品种罗望子果肉中除糖酸比存在明显差异外,多糖也有一定差异,且果肉间的差异比种子间的差异更明显。
对4种多糖的体外抗氧化活性进行对比研究,发现果肉多糖对DPPH自由基、ABTS自由基和OH·自由基的清除能力均强于种子多糖,但两种种子多糖较两种果肉多糖具有更强的铁离子还原活性。两种果肉多糖对3种自由基的清除能力均处于较高水平,强于茶树菇多糖(Tsai et al.,2006)、贝母多糖(Pan et al.,2018)和黄秋葵花多糖(苏平等,2018),说明罗望子多糖是一种良好的自由基清除剂。从品种来看,TPP和S-TPP抗氧化能力差异不明显,但S-TSP对于ABTS自由基和OH·自由基清除能力及铁离子还原能力均强于TSP。这可能源于多糖抗氧化活性的差异与单糖组成、多糖分子量和糖醛酸含量等因素有关(Wang et al.,2016)。种子多糖可能因分子量较大而导致分子间的部分活性基团被包裹,导致抗氧化活性低于果肉多糖,果肉多糖可能因为含有较多的糖醛酸和活性基团而体现出较强的抗氧化活性(Sharma et al.,2015)。
目前,关于罗望子的研究主要集中在种子多糖提取、结构鉴定(Chawananorasest et al.,2016)和物理性质(Khounvilay and Sittikijyothin,2012)等方面。罗望子品种间形态、营养成分均有明显差异,但关于罗望子品种间多糖差异比较的研究鲜见报道,且对罗望子果肉多糖的研究也极少。本研究对罗望子种子和果肉多糖进行提取、结构鉴定和体外抗氧化活性测定,并比较品种间的差异,为罗望子资源综合开发利用提供了可靠的参考依据。但罗望子果肉多糖在人体内的药用效果还有待进一步验证,尤其是罗望子果肉多糖的纯化和药用机理将是今后研究的重点方向。
4 结论
罗望子果肉和种子多糖的蛋白质含量较少,结构组成在品种间差异较小,其果肉多糖属于酸性杂多糖,具有较强的体外抗氧化活性,在食品与医药领域具有一定的应用潜力。
参考文献:
李家旺,刘艳,司民真. 2016. 三种山姜干粉的红外光谱对比分析[J]. 光散射学报,28(1):56-61. [Li J W,Liu Y,Si M Z. 2016. A comparison analysis of infrared spectrum to three kinds of Alpinia japonica powder[J]. The Journal of Light Scattering,28(1):56-61.]
李姝蓓,张东,杨岚,李玉洁,朱晓新,付梅红,方婧. 2013. 荚果蕨贯众提取物中黄酮类成分的含量测定和抗氧化活性研究[J]. 中国药学杂志,48(21):1860-1863. [Li S B,Zhang D,Yang L,Li Y J,Zhu X X,Fu M H,Fang J. 2013. Determination of the contents of the main flavones and antioxidative activity of the extract of rhizomes and frond bases of Matteuccia struthiopteris[J]. Chinese Pharmaceutical Journal,48(21):1860-1863.]
苏平,孙昕,宋思圆,魏丹. 2018. 不同提取方法对黄秋葵花多糖的结构组成及抗氧化活性的影响[J]. 食品科学,39(15):93-100. [Su P,Sun X,Song S Y,Wei D. 2018. Effe-ct of extraction method on structure and antioxidant acti-vity of polysaccharides from okra flowers[J]. Food Scien-ce,39(15):93-100.]
涂宗財,张秋婷,王辉,张雪春,朱秀梅,江国忠. 2010. 酸角果肉多糖的提取工艺优化研究[J]. 食品工业科技,31(10):303-305. [Tu Z C,Zhang Q T,Wang H,Zhang X C,Zhu X M,Jiang G Z. 2010. Study on optimizing technology of extracting polysaccharide from Tamarind indica Linn pulp[J]. Science and Technology of Food Industry,31(10):303-305.]
王小梅,王妙,薛红杰,张明,郝大鹏,孙润广. 2018. 热水提取与超声提取的麦冬多糖结构与构象特征的比较研究[J]. 分析测试学报,37(1):23-30. [Wang X M,Wang M,Xue H J,Zhang M,Hao D P,Sun R G. 2018. A comparative study on structure and conformation of polysaccharides in Ophiopogon japonicus by hot water and ultraso-nic extraction[J]. Journal of Instrumental Analysis,37(1):23-30.]
谢明勇,殷军艺,聂少平. 2017. 天然产物来源多糖结构解析研究进展[J]. 中国食品学报,17(3):1-19. [Xie M Y,Yin J Y,Nie S P. 2017. Research progress on structural cha-racterization of polysaccharides from natural resources[J]. Journal of Chinese Institute of Food Science and Technology,17(3):1-19.]
杨江涛,杨娟,谢红,杨小生. 2008. 刺梨多糖粗品与纯品体外抗氧化作用[J]. 食品工业科技,29(2):94-96. [Yang J T,Yang J,Xie H,Yang X S. 2008. The antioxidative activities of crude and pure polysaccharides from Rosa roxburghii in vitro[J]. Science and Technology of Food industry,29(2):94-96.]
赵一鹤,杨时宇,李昆. 2005. 酸角综合利用的现状及发展趋势[J]. 林产化学与工业,25(2):122-126. [Zhao Y H,Yang S Y,Li K. 2005. Comprehensive utilization of Ta-marindus indica Linn[J]. Chemistry and Industry of Fo-rest Products,25(2):122-126.]
Alpizar-Reyes E,Carrillo-Navas H,Gallardo-Rivera R,Varela-Guerrero V,Alvarez-Ramirez J,Pérez-Alonso C. 2017. Functional properties and physicochemical characteristics of tamarind(Tamarindus indica L.) seed mucilage powder as a novel hydrocolloid[J]. Journal of Food Enginee-ring,209:68-75.
Bhadoriya S S,Ganeshpurkar A,Narwaria J,Rai G,Jain A P. 2011. Tamarindus indica:Extent of explored potential[J]. Pharmacognosy Reviews,5(9):73-81.
Chawananorasest K,Saengtongdee P,Kaemchantuek P. 2016. Extraction and characterization of tamarind(Tamarind indica L.) seed polysaccharides(TSP) from three difference sources[J]. Molecules,21(6):775.
Izquierdo T,García-Tamayo F,Soto C,Castrillon L. 2007. A Tamarindus indica. Linn pulp polysaccharide inhibits fever in vivo,and IL-1β release by murine peritoneal exudate cells[J]. Pharmaceutical Biology,45(1):22-30.
Jia X,Zhang C,Qiu J,Qiu J F,Wang L L,Bao J L,Wang K,Zhang Y L,Chen M W,Su H X,Han J P, He C W. 2015. Purification,structural characterization and anticancer activity of the novel polysaccharides from Rhynchosia minima root[J]. Carbohydrate Polymers,132:67-71.
Khounvilay K,Sittikijyothin W. 2012. Rheological behaviour of tamarind seed gum in aqueous solutions[J]. Food Hydrocolloids,26(2):334-338.
Oliver C M,Kher A,Mcnaughton D,Augustin M A. 2009. Use of FTIR and mass spectrometry for characterization of glycated caseins[J]. Journal of Dairy Research,76(1):105-110.
Pan F, Su T J,Liu Y,Hou K,Chen C,Wu W. 2018. Extraction,purification and antioxidation of a polysaccharide from Fritillaria unibracteata var. wabuensis[J]. International Journal of Biological Macromolecules,112:1073-1083.
Razali N,Mat-Junit S,Abdul-Muthalib A F,Subramaniam S,Abdul-Aziz A. 2012. Effects of various solvents on the extraction of antioxidant phenolics from the leaves,seeds,veins and skins of Tamarindus indica L[J]. Food Che-mistry,131(2):441-448.
Ridley B L,O'Neill M A,Mohnen D. 2001. Pectins:Structure,biosynthesis,and oligogalacturonide-related signaling[J]. Phytochemistry,57(6):929-967.
Sharma R,Kamboj S,Khurana R,Singh G,Rana V. 2015. Physicochemical and functional performance of pectin extracted by QbD approach from Tamarindus indica L. pulp[J]. Carbohydrate Polymers,134(10):364-374.
Tsai S Y,Huang S J,Mau J L. 2006. Antioxidant properties of hot water extracts from Agrocybe cylindracea[J]. Food Chemistry,98(4):670-677.
Wang J Q,Hu S Z,Nie S P,Yu Q,Xie M Y. 2016. Reviews on mechanisms of in vitro antioxidant activity of polysa-ccharides[J]. Oxidative Medicine & Cellular Longevity,(64):1-13.
Wu F Y,Yan H,Ma X N,Jia J Q,Zhang G Z,Guo X J,Gui Z Z. 2012. Comparison of the structural characterization and biological activity of acidic polysaccharides from Cor-dyceps militaris cultured with different media[J]. World Journal of Microbiology & Biotechnology,28(5):2029-2038.
Xu Z,Li X,Feng S L,Liu J,Zhou L J,Yuan M,Ding C B. 2016. Characteristics and bioactivities of different mole-cular weight polysaccharides from camellia seed cake[J]. International Journal of Biological Macromolecules,91:1025-1032.
Zheng Y,Zhang S,Wang Q,Lu X,Lin L M,Tian Y T,Xiao J B,Zheng B D. 2016. Characterization and hypoglycemic activity of a β-pyran polysaccharides from bamboo shoot(Leleba oldhami Nakal) shells[J]. Carbohydrate Polymers,144:438-446.
(責任编辑 罗 丽)

