无乳链球菌对罗非鱼肠道菌群的影响
黎铭 马春霞 黎建斌 雷爱莹 李莉萍 李大列 陈福艳 陈明



黎銘(1980-),博士,副研究员,主要从事水产动物病害防治研究工作。主持完成siRNA感染抗对虾白斑病毒研究、鸡卵黄抗体抗对虾白斑病毒研究等8项省部级项目,参与完成国家自然科学基金项目“白斑综合症病毒编码的microRNA在病毒感染凡纳滨对虾过程中的作用”、广西自然科学基金项目“香港牡蛎三倍体养殖性状评估分析灾后恢复”等18项。现主持、参与国家自然科学基金项目、广西重点研发计划项目、广西自然科学基金项目等13项。获广西科学技术进步奖二等奖1项,水产新品种1项。在国内外期刊上发表论文40余篇,其中SCI一区10篇,中文核心期刊25篇。申报国家专利8项,获国家发明专利6项。研发的对虾抗菌肽已转企业生产,社会经济效益显著。
摘要:【目的】分析无乳链球菌对罗非鱼肠道菌群的影响,为揭示无乳链球菌与肠道菌群的相互作用机制提供参考依据。【方法】以无乳链球菌HN016强毒株的菌悬液经口灌胃吉富罗非鱼,采用实时荧光定量PCR及16S rRNA高通量测序技术分析无乳链球菌在罗非鱼肠道中的定植情况及对罗非鱼肠道菌群结构和多样性的影响。【结果】口服无乳链球菌HN016菌悬液的罗非鱼在24 h后出现链球菌病的典型症状,至口服后第3 d试验组罗非鱼全部死亡;口服12 h后罗非鱼肠道内的无乳链球菌HN016强毒株数量达峰值,但口服24 h后其数量显著下降(P<0.05)。口服无乳链球菌HN016菌悬液后罗非鱼肠道样品OTUs的数量和种类发生明显变化,表现为口服12 h后引起罗非鱼肠道菌群多样性明显降低,但口服24 h后出现反弹并高于初始水平,且肠道菌群多样性与无乳链球菌HN016强毒株在肠道中的含量呈明显负相关。口服无乳链球菌HN016菌悬液引起罗非鱼肠道菌群构成比例发生明显变化,门水平上排名前10位的变形菌门、拟杆菌门、广古菌门、互养菌门和软壁菌门细菌所占比例上升,厚壁菌门、梭菌门、放线菌门、奇古菌门和螺旋体门所占比例则呈下降趋势;在属水平上表现为罗非鱼肠道菌群排名前10位的优势菌属除了拟杆菌属和不动杆菌属呈上升趋势外,其他菌属如鲸杆菌属、乳球菌属和丙酸菌属等均呈下降趋势,即罗非鱼大部分肠道优势菌群已受到无乳链球菌HN016强毒株的抑制。【结论】无乳链球菌感染罗非鱼后肠道菌群构成及其多样性明显改变,可引起致病菌爱德华氏菌属和假单胞菌属细菌比例的增加,同时引起鲸杆菌属、丙酸菌属和乳球菌属等肠道有益细菌比例的减少,故推测迟缓爱德华氏菌和荧光假单胞菌继发感染在罗非鱼链球菌病的发生发展过程中起重要作用。
关键词: 罗非鱼;无乳链球菌;肠道细菌;菌群构成;多样性;16S rRNA高通量测序
中图分类号: S965.125 文献标志码: A 文章编号:2095-1191(2019)08-1647-10
Effects of Streptococcus agalactiae on intestinal flora of tilapia
LI Ming1, MA Chun-xia2, LI Jian-bin1, LEI Ai-ying1, LI Li-ping1,LI Da-lie1,
CHEN Fu-yan1*, CHEN Ming1*
(1Guangxi Institute of Fisheries/Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture, Nanning 530021, China; 2Guangxi Veterinary Research Institute/Guangxi Key Laboratory of Animal Vaccines and New Technology, Nanning 530001, China)
Abstract:【Objective】This study analyzed the influence of Streptococcus agalactiae on the intestinal flora of tilapia to provide reference for revealing the interaction mechanism between S. agalactiae and intestinal flora. 【Method】Experimental Tilapia mossambica were fed with bacterial suspension of S. agalactiae virulent strain HN016, and then real-time fluorescence quantitative PCR was used to analysis the amount of HN016 in gut and 16S rRNA high-throughput sequen-cing method was used to analyze the changes on structure and diversity of tilapia intestinal flora. 【Result】The results showed that the tilapia administrated with bacterial suspension of S. agalactiae virulent strain HN016 presented typical symptoms of streptococcal disease after 24 h, and all the tilapia in the positive group died on day 3 after oral administration. The amount of S. agalactiae virulent strain HN016 reached its peak in the intestinal tract after 12 h of oral administration and significantly decreased after 24 h(P<0.05). Great changes on the OTUs number and species of the intestinal sample were showed after oral administration. The intestinal flora diversity of tilapia decreased after 12 h of oral administration of HN016, but the diversity rebounded and was higher than the initial level after 24 h. The diversity of intestinal flora of tilapia was negatively correlated with the content of S. agalactiae virulent strain HN016 in the intestinal tract. Oral administration of HN016 caused obvious changes in the composition of intestinal flora of tilapia. The composition of intestinal flora in the top 10 was analyzed and found that the proportion of Proteobacteria, Bacteroidetes, Euryarchaeota, Synergistetes, Tenericutes increased obviously,and the proportion of Firmicutes, Fusobacteria, Actinobacteria, Thaumarchaeota, Spirochaetes decreased observably. On genus level, among the top 10 dominant bacteria in tilapia intestine, except for the proportion of Edwardsiella, Pseudomonas increased, the proportion of other bacteria such as Cetobacterium, Lactococcus and Propionibacterium decreased. It indicated that most dominant intestinal flora were inhibited by S.agalactiae virulent strain HN016. 【Conclusion】Oral administration of S. agalactiae HN016 strains results in changes in intestinal flora composition and diversity of tilapia, it also increases the proportions of Edwardsiella, Pseudomonas, and decreases the proportions of intestinal beneficial bacteria such as Cetobacterium, Propionibacterium and Lactococcus. Therefore, it is inferred that E. tarda and P. fluorescens secondary infection plays an important role in tilapia S. agalactiae.
Key words: tilapia; Streptococcus agalactiae; intestinal bacteria; flora composition; diversity; high throughput sequencing of 16S rRNA
0 引言
【研究意义】罗非鱼肉厚刺少、质嫩味美,且兼具生长快、病害少、适应力强的特点,现已发展成为全球广泛养殖的鱼类品种(林虹等,2013)。我国是全球最大的罗非鱼养殖和加工出口国,据统计,2015年我国罗非鱼产量达178万t,出口量达39万t。链球菌(Streptococcus)严重制约着罗非鱼的健康养殖,其累积死亡率可达30%~80%(李莉萍等,2015)。自2009年以来,我国多个地区暴发罗非鱼链球菌病,且呈全国蔓延趋势,给罗非鱼养殖业带来巨大经济损失,链球菌病已成为水产病害防控的重点对象(卢迈新,2010)。由于链球菌可在罗非鱼肠道潜伏感染,在特定条件下能大量繁殖而促使链球菌病暴发,因此,研究链球菌在罗非鱼肠道内的定植、繁殖及其与肠道屏障和机体免疫系统的相互作用规律,对有效防控罗非鱼链球菌病具有重要意义。【前人研究进展】相关数据表明,90%以上罗非鱼链球菌病临床菌株为无乳链球菌(S. agalactiae)(冯东岳,2010;李莉萍等,2015)。无乳链球菌的感染与季节和温度有关,热带地区高温季节更易导致罗非鱼链球菌病的暴发(林虹等,2013)。无乳链球菌主要通过胃肠道进入机体,其感染和致病过程一般可分为在盲肠或小肠内定植→小肠上皮细胞穿越→宿主免疫防御逃避3个阶段(黎源等,2017)。此外,无乳链球菌能在巨噬细胞内存活并增殖,借以突破血脑屏障,进入血液和中央神经系统,然后快速扩散至其他器官组织(祝璟琳等,2013,2014)。目前,抗生素仍是鱼类细菌性疾病防治最有效的方法,但生产环节中过量使用抗生素极易导致耐药菌株产生、食品质量安全及生态环境污染等一系列问题(程世亮等,2016)。据报道,2009年前使用抗生素还可有效控制部分链球菌病的病情,但自2010年之后抗生素对链球菌几乎不产生实际效果(李莉萍等,2013)。袁伟(2017)研究表明,我国罗非鱼源无乳链球菌对氨基糖苷类药物和磺胺类药物的耐药率均超过85.0%,对诺氟沙星的耐药率为14.2%,对洛美沙星的耐药率为82.8%,对依诺沙星的耐药率高达98.2%。黄艳华等(2018)研究表明,广西罗非鱼源无乳链球菌的耐药谱型呈多样性,谱型丰富度较高,且因来源地不同和年际变化存在一定差异性。梁静真等(2018)研究表明,广西罗非鱼源无乳链球菌存在tetM +tetO-tetL-tetS-和tetM-tetO-tetL-tetS-两种耐药基因型,携带tetM基因罗非鱼源无乳链球菌经体外诱导后对多西环素的耐药性大幅度提高。【本研究切入点】肠道细菌依赖宿主自身营养或分解肠道食物团而赖以生存,同时其代谢合成的维生素及胞外酶产物可被宿主利用,因此在宿主的营养消化吸收方面发挥着重要作用(Nayak,2010);此外,肠道常在菌群对病原菌定居和增殖起屏障作用,在一定程度上可保护宿主免受病原菌侵害(Thursby and Juge,2017)。虽然肠道菌群屏障对病原菌具有排斥作用,但仍有不少病原菌能顺利穿越肠道上皮细胞进入机体而导致疾病的发生和发展。随着高通量测序技术的快速发展和普及应用,使得肠道菌群的研究变得越来越方便,也为揭示病原菌与肠道菌群的相互作用机制提供了有利条件。【拟解决的关键问题】鉴于无乳链球菌对罗非鱼危害的严重性,通过实时荧光定量PCR及高通量测序技术等分析无乳链球菌对罗非鱼肠道菌群的影响,以期为揭示无乳链球菌与肠道菌群的相互作用机制提供参考依据。
1 材料与方法
1. 1 试验材料
供试吉富罗非鱼(Oreochromis niloticus)来自广西水产科学研究院国家级罗非鱼良种场,其平均体重30.15±2.60 g/尾。经脑组织和肾脏分离细菌,确认无细菌感染。罗非鱼暂养于800 L的养殖容器中,(30±4)℃下养2周。罗非鱼无乳链球菌HN016强毒株由广西水产遗传育种与健康养殖重点实验室分离保存。
1. 2 特异性引物和探针
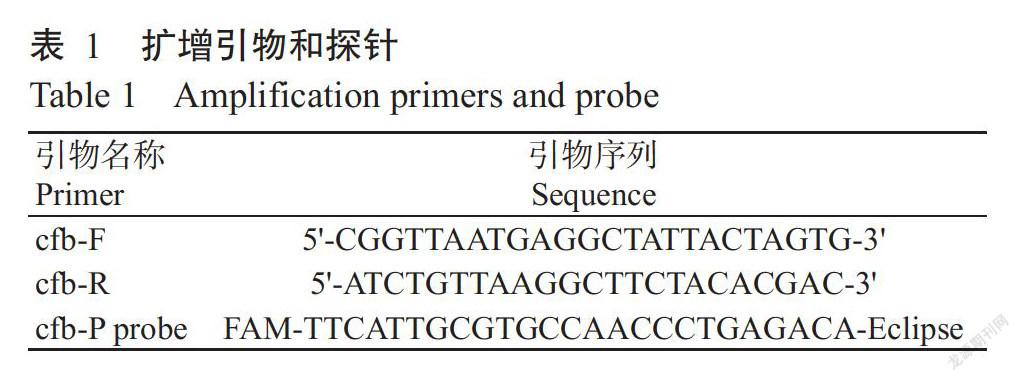
根据无乳链球菌保守基因cfb(GenBank登录号3686873)设计特异性引物cfb-F/cfb-R及探针cfb-P probe(表1),扩增长度113 bp。以上引物及探针均由宝生物工程(大连)有限公司合成。
1. 3 罗非鱼口服无乳链球菌
试验罗非鱼分为试验组和对照组,每组3个养殖容器(3个重复),每个容器35尾。使用灌胃器给试验组罗非鱼经口灌胃(口服)无乳链球菌HN016菌悬液,1.5×109 CFU/尾,对照组口服等量无菌PBS溶液。口服后观察和统计罗非鱼死亡情况,并在口服后12 h、24 h和3 d、7 d、15 d分别从每个养殖容器中随机挑选5尾罗非鱼用于肠道菌群检测。在无菌条件下采集被挑选罗非鱼的全肠样品,用镊子挤压方法清除肠道内容物,然后以无菌生理盐水冲洗肠道3遍。清理后的肠道按十二指肠、前肠、后肠和直肠剪断后,分类保存于-80 ℃冰箱备用。取出罗非鱼肠道样品快速置于液氮预冷的研钵中,研磨成粉末状,再加入溶菌酶溶液进行处理,然后按组织DNA抽提试剂盒[宝生物工程(大连)有限公司]说明进行DNA抽提,所得DNA以1.0%琼脂糖凝胶电泳检测其纯度和浓度,用于16S rRNA序列高通量测序分析及实时荧光定量PCR检测。
1. 4 实时荧光定量PCR检测无乳链球菌在罗非鱼肠道中的定植情况
参照王瑞等(2015)的研究方法,对无乳链球菌DNA样品进行10倍梯度稀释,分别获得浓度相当于108~101个/mL的8个梯度无乳链球菌DNA样品,然后测定实时荧光定量PCR扩增的最低模板浓度并建立标准曲线。按照 Real Time PCR/TaqMan检测试剂盒操作说明进行实时荧光定量PCR扩增,反应体系50.0 μL: DNA模板4.0 μL,cfb-F/cfb-R各1.0 μL,TaqMan探针(cfb-P probe)2.0 μL,Premix Ex Taq 25.0 μL,ROX Reference Dye II 0.5 μL,滅菌蒸馏水16.5 μL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行40个循环。每个样品设3个平行样,每次试验均包括空白对照(DNA模板用ddH2O代替)。PCR产物送至深圳华大基因股份有限公司测序。参照王瑞等(2015)的研究方法,根据扩增Ct值计算无乳链球菌数量,并采用SPSS 17.0进行统计分析。
1. 5 基于16S rRNA序列分析口服无乳链球菌前后罗非鱼肠道菌群变化
取适量DNA样品用无菌水稀释至1.0 ng/μL。以稀释DNA为模板,根据测序区域(16S rRNA的V3~V4区)选择,使用带Barcode的特异引物及高保真酶进行PCR扩增。以2.0%琼脂糖凝胶对PCR产物进行电泳检测;参照TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒说明构建文库,所得文库经Qubit和實时荧光定量PCR检测合格后,使用HiSeq2500 PE250进行上机测序。下机数据经拆分后,对获得的Tags进行过滤、去嵌合体序列,最后获得Effective Tags。采用Uparse v7.0.1001(http://drive5.com/uparse/)对全部Effective Tags进行聚类,按照97%的序列相似性将Effective Tags聚类成OTUs(Operational taxonomic units),筛选出现频数最高的序列作为代表序列。利用GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/nph-index.cgi)和RDP Classifier v2.2(http://sourceforge.net/projects/rdp-classifier/)对OTUs代表序列进行物种注释(阈值为0.8~1.0),并分别从界(Kingdom)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)和种(Species)分类水平统计各样本的群落组成。试验数据经均一化处理后进行多样性分析。
2 结果与分析
2. 1 无乳链球菌在罗非鱼肠道的定植分布情况
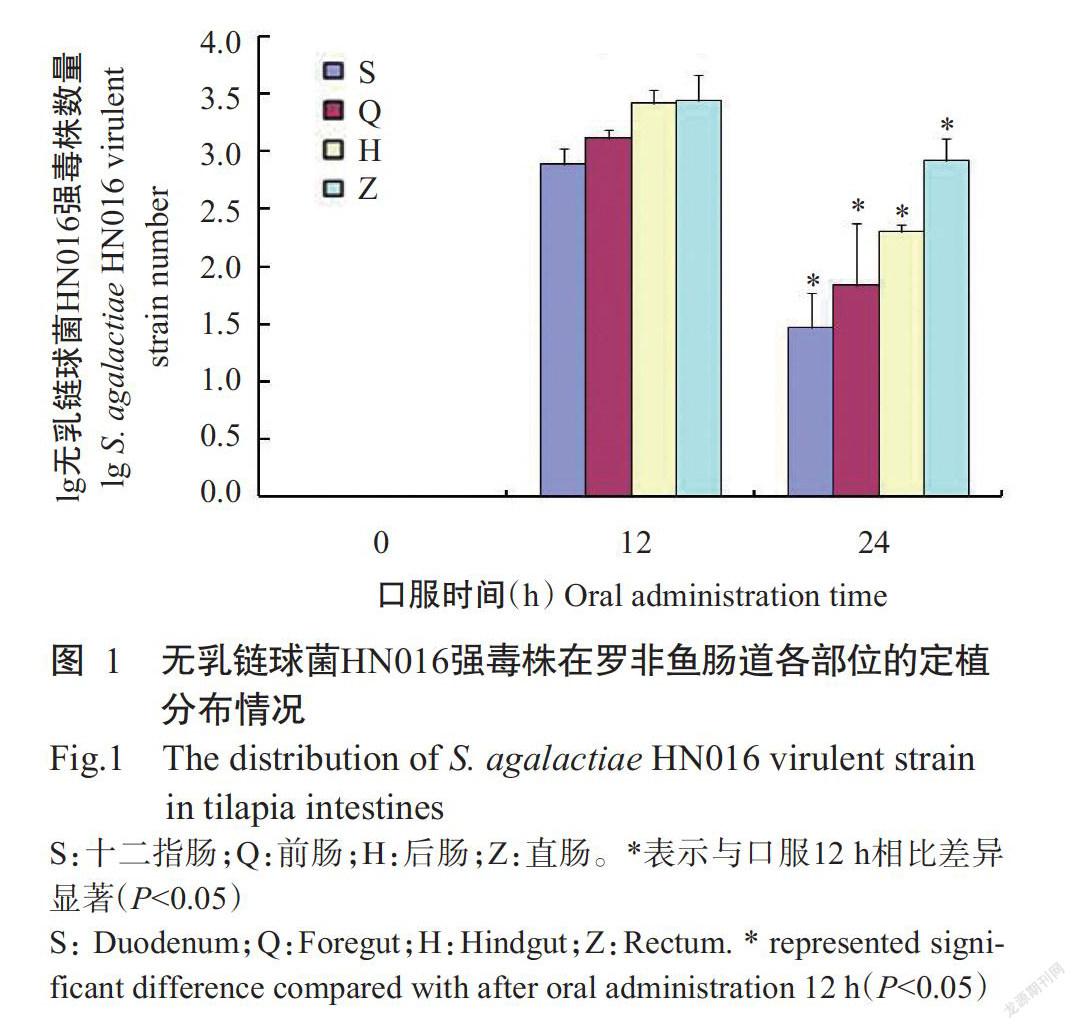
口服无乳链球菌HN016菌悬液的罗非鱼在24 h后出现链球菌病的典型症状:精神不振,游姿异常,体色发黑;至口服后第3 d试验组罗非鱼全部死亡,而对照组罗非鱼在整个试验周期均未出现死亡现象。使用实时荧光定量PCR检测口服0~24 h后罗非鱼肠道内的无乳链球菌HN016强毒株数量,结果(图1)表明,口服12 h后罗非鱼肠道内的无乳链球菌HN016强毒株数量达峰值,但口服24 h后其数量显著下降(P<0.05)。
2. 2 16S rRNA测序分析结果
通过HiSeq2500 PE250对12个罗非鱼肠道样品进行测序,结果共获有效Tags数量为67067条,获得注释的Tags数量为65236条。每个样品有效Tags数量为50992~67067条(图2),平均长度为405~426 nt。利用Uparse v7.0.1001对样品的有效Tags序列进行聚类分析,按照97%的序列相似性将这些序列聚类成OTUs,类聚和注释结果表明,12个罗非鱼肠道样品OUTs数量介于510~984个,平均为753个(图2)。
为了检验测序结果的合理性,对16S rRNA测序结果进行物种累积箱形图分析,结果显示,随着罗非鱼肠道样本量的增加,箱形图位置趋于平缓(图3),表明12个肠道样品测序结果已包含罗非鱼肠道绝大部分肠道菌群物种,即抽样充分。
2. 3 正常罗非鱼肠道各部位优势菌群的构成比例
对口服无乳链球菌HN016菌悬液前(0 h)罗非鱼肠道菌群测序结果进行分析,结果(图4)表明,在属水平上正常罗非鱼肠道排名前10位的菌属分别为鲸杆菌属(Cetobacterium,占15.3%)、乳球菌属(Lactococcus,占5.6%)、Romboutsia(占7.9%)、不动杆菌属(Acinetobacter,5.2%)、地杆菌属(Pedobacter,1.2%)、普氏菌属(Prevotella_9,占1.0%)、拟杆菌属(Bacteroides,1.0%)、Candidatus_Nitrosopumilus(占0.7%)、芽孢乳杆菌属(Sporolactobacillus,占0.7%)和嗜肽菌属(Peptoniphilus,占0.6%),其他菌属占60.5%。
2. 4 口服无乳链球菌后罗非鱼肠道菌群多样性的变化
为检验口服无乳链球菌是否会导致罗非鱼肠道菌群变化,对不同时间段罗非鱼肠道菌群进行比较分析。韦恩图分析结果(图5-A)表明,与口服无乳链球菌HN016菌悬液前(0 h)相比,口服无乳链球菌HN016菌悬液12和24 h后罗非鱼肠道样品的OTUs数量和种类发生明显变化,口服无乳链球菌HN016菌悬液前(0 h)罗非鱼肠道样品特有OTUs为313个,口服无乳链球菌HN016菌悬液12 h的特有OTUs为330个,口服无乳链球菌HN016菌悬液24 h的特有OTUs为542个。测序结果中OTUs数量即代表物种的数量。稀释曲线(图5-B)显示,口服无乳链球菌HN016菌悬液12 h后罗非鱼肠道样品菌群多样性降低,但24 h后其多样性呈上升状态,且高于口服无乳链球菌HN016菌悬液前的初始水平。Shannon指数(图5-C)和Simpson指数(图5-D)与稀释曲线结果一致,口服无乳链球菌HN016菌悬液12 h后罗非鱼肠道样品菌群多样性降低,但24 h后多样性呈上升趋势。
2. 5 口服无乳链球菌后罗非鱼肠道菌群结构的变化
为检验组间差异是否显著大于组内差异,对试验组和对照组罗非鱼肠道菌群构成进行单因素相似性(ANOSIM)分析,结果表明,各组间的R值均大于0(图 6),说明各组间罗非鱼肠道菌群构成差异显著,且组间差异大于组内差异。
口服无乳链球菌HN016菌悬液后罗非鱼肠道菌群中排名前10位的菌门(图7)分别是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、广古菌门(Euryarchaeota)、互养菌门(Synergistetes)、软壁菌门(Tenericutes)、厚壁菌门(Firmicutes)、梭菌门(Fusobacteria)、放线菌门(Actinobacteria)、奇古菌门(Thaumarchaeota)和螺旋体门(Spirochaetes),其中变形菌门、拟杆菌门、广古菌门、互养菌门和软壁菌门的占比呈上升趋势,而其他菌门呈下降趋势。
在属水平上,口服无乳链球菌HN016菌悬液12 h后可引起罗非鱼肠道菌群中拟杆菌属(Bacteroides)、寡养单胞菌属(Stenotrophomonas)、Romboutsia、不动杆菌属(Acinetobacter)、爱德华氏菌属(Edwardsiella)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、链球菌属(Streptococcus)、临单胞菌属(Plesiomonas)和梭菌屬(Clostridium_sensu_stricto_1)的相对丰度上升,同时引起鲸杆菌属(Cetobacterium)、丙酸菌属(Propionibacterium)、芽孢乳杆菌属(Sporolactobacillus)、Candidatus_Nitrosopumilus、乳球菌属(Lactococcus)、地杆菌属(Pedobacter)、Peptoniphilus、普氏菌属(Prevotella_9)和Blautia的相对丰度下降(图8-A);口服24 h后主要引起疣微菌属(Ruminococcaceae_UCG-014)、乳酸菌属(Lactobacillus)、Allobaculum、脱硫弧菌属(Desulfovibrio)、毛螺菌属(Lachnospiraceae_UCG-005)、vadinBC27_ was-tewater-sludge_group、罗斯氏菌属(Roseburia)、厌氧棒菌属(Anaerobaculum)、优杆菌属([Eubacterium]_coprostanoligenes_group)、unidentified_WCHB1-69、甲烷丝菌属(Methanosaeta)、疣微菌属(Ruminococcaceae_UCG-014)和热杆菌属(Methanothermobacter)的相对丰度上升,同时引起拟杆菌属(Bacteroides)、寡养单胞菌属(Stenotrophomonas)、Romboutsia、鲸杆菌属(Cetobacterium)和丙酸菌属(Propionibacterium)的相对丰度下降(图8-B)。
3 讨论
在长期的进化过程中,鱼类肠道形成其固有的菌群结构,而这些固有菌群除了参与宿主的营养代谢、辅助消化外,还具有屏障及免疫功能(Gómez and Balcázar,2008;Kelly,2010;Sommer and Bäckhed,2013;Xia et al.,2014)。本研究通过16S rRNA高通量测序技术对罗非鱼肠道菌群进行分析,结果发现正常罗非鱼肠道菌群在属水平上以鲸杆菌属、乳球菌属、Romboutsia、不动杆菌属、地杆菌属、普氏菌属、拟杆菌属、Candidatus_Nitrosopumilus、芽孢乳杆菌属和嗜肽菌属为优势菌群,而其他细菌占肠道菌群总量的60.5%。在种水平上,正常罗非鱼肠道也含有无乳链球菌(占肠道总菌种数量的0.32%)。说明无乳链球菌是罗非鱼的条件性致病菌,在正常情况下由于受机体免疫机能及其他肠道菌群的制衡而无法暴发致病。根据已有的文献报道可知,罗非鱼链球菌病多流行于高温季节,尤其水温在32 ℃以上时极易暴发流行(卢迈新,2010;陈家长等,2011;邓永强和汪开毓,2016)。在本研究中,罗非鱼在口服无乳链球菌HN016菌悬液后第3 d全部死亡,说明无乳链球菌HN016强毒株对罗非鱼具有很强的毒力。
虽然鱼类肠道固有菌群对病原微生物起屏障作用,但鱼类肠道菌群常因品种、年龄、环境、食物及疾病等因素的影响而发生改变(Gómez Balcázar,2008;Roeselers et al.,2010;Sommer and Bäckhed,2013)。在菌群失衡的情况下,某些病原菌得到过量繁殖,从而导致疾病发生,因此研究病原菌与肠道固有菌群的相互作用机制对防控条件性致病菌具有重要意义。本研究通过对正常罗非鱼经口灌胃无乳链球菌HN016菌悬液,发现口服12 h 后罗非鱼肠道内的无乳链球菌HN016强毒株数量达峰值,但口服24 h后其数量显著下降,说明此时已有部分口服菌株进入机体其他部位或通过肠道排除。此外,罗非鱼口服无乳链球菌HN016菌悬液后,其肠道菌群结构和多样性发生明显变化,Shannon指数、Simpson指数及稀释曲线均显示口服12 h后罗非鱼肠道菌群多样性降低,但至口服24 h后菌群多样性上升且高于初始水平,说明此时罗非鱼肠道菌群已失衡。类似案例在其他动物也有报道,如大熊猫感染犬瘟热病毒(Canine distemper virus,CDV)后其肠道内菌群构成发生改变,且微生物多样性呈升高趋势(Zhao et al.,2017)。人类的胃肠炎和糖尿病也与肠道细菌的丰度及多样性降低有关(Nishino et al.,2017;Jandhyala et al.,2017)。可见,菌群结构及其多样性改变是肠道菌群失衡的重要标志。
随着高通量测序技术的广泛应用,鱼类疾病对其胃肠道菌群的影响越来越受到关注。张正等(2015)通过研究皮肤溃疡病和腹水病发生对半滑舌鳎肠道菌群的影响,发现皮肤溃疡病的发生对半滑舌鳎肠道菌群结构几乎没有影响,但腹水病对半滑舌鳎肠道的优势细菌组成及相对丰度均产生明显影响。李东亮(2016)研究表明,当草鱼受到嗜水气单胞菌感染时,其肠道菌群中的主要优势菌门——厚壁菌门和变形菌门所占比例均随致病菌感染量的升高而降低,梭杆菌门所占比例则呈上升趋势;在属水平上,主要优势菌属——芽孢杆菌属和气单胞菌属所占比例随致病菌感染量的升高而降低,而鲸杆菌属所占比例呈上升趋势。本研究结果表明,罗非鱼口服无乳链球菌HN016菌悬液后其肠道菌群中的变形杆菌门、拟杆菌门、广古菌门、互养菌门和软壁菌门所占比例呈上升趋势,而厚壁菌门、梭菌门、放线菌门、奇古菌门和螺旋体门呈下降趋势。可见,细菌性疾病对鱼类肠道菌群的影响作用因病因或品种差异而不同。
口服无乳链球菌HN016菌悬液后罗非肠道菌群的变化还体现在属水平上,表现为正常罗非鱼肠道菌群排名前10位的优势菌属除了拟杆菌属和不动杆菌属呈上升之外,其他菌属如鲸杆菌属、乳球菌属和丙酸菌属等均呈下降趋势,说明罗非鱼肠道内大部分优势菌群已受到无乳链球菌HN016强毒株的抑制,但同时一些病原菌如链球菌属、爱德华菌属和假单胞菌属的构成比例呈上升趋势。刘志刚等(2018)研究发现,感染无乳链球菌尼罗罗非鱼肠道菌群中的链球菌属、分枝杆菌属和曼氏杆菌属等致病菌群相对丰度顯著高于健康尼罗罗非鱼,而乳球菌属、鲸杆菌属和红球菌属等益生菌相对丰度显著低于健康尼罗罗非鱼。说明无乳链球菌的感染能改变鱼类肠道优势菌群结构,引起肠道内潜在致病菌数量的增加。由于迟缓爱德华氏菌和荧光假单胞菌的感染症状与罗非鱼链球菌病典型症状极为相似,故推测迟缓爱德华氏菌和荧光假单胞菌继发感染在罗非鱼链球菌病的发生发展过程中起重要作用。
4 结论
无乳链球菌感染罗非鱼后肠道菌群构成及其多样性发生明显改变,可引起致病菌爱德华氏菌属、假单胞菌属细菌比例的增加,同时引起鲸杆菌属、丙酸菌属、乳球菌属等肠道有益细菌比例的减少,故推测迟缓爱德华氏菌和荧光假单胞菌继发感染在罗非鱼链球菌病的发生发展过程中起重要作用。
参考文献:
陈家长,臧学磊,胡庚东,瞿建宏,范立民,宋超. 2011. 氨氮胁迫下罗非鱼(GIFT Oreochromis niloticus)机体免疫力的变化及其对海豚链球菌易感性的影响[J]. 生态环境学报,20(4):629-634. [Chen J C,Zang X L,Hu G D,Qu J H,Fan L M,Song C. 2011. The immune response of GIFT Oreochromis niloticus and its susceptibility to Streptococcus iniae under stress in different ammonia[J]. Eco-logy and Environmental Sciences,20(4):629-634.]
程世亮,刘新风,郑文,黄艺丹,张君,郑建. 2016. 鱼类无乳链球菌病[J]. 动物医学进展,37(2):105-109. [Cheng S L,Liu X F,Zheng W,Huang Y D,Zhang J,Zheng J. 2016. Streptococcus agalactiae infection in fish[J]. Progress in Veterinary Medicine,37(2):105-109.]
邓永强,汪开毓. 2016. 鱼类无乳链球菌病的研究进展[J]. 中国畜牧兽医,43(9):2490-2495. [Deng Y Q,Wang K Y. 2016. Research progress on fish Streptococcus agalactiae disease[J]. China Animal Husbandry & Veterinary Medicine,43(9):2490-2495.]
冯东岳. 2010. 罗非鱼链球菌病研究概况[J]. 水产养殖,(11):43-44. [Feng D Y. 2010. Overview of research on streptococcus disease of tilapia[J]. Journal of Aquaculture,(11):43-44.]
黄艳华,马沙,韩书煜,黄伟德,韦慕兰,蒙兰丽,吕小丽,覃惠明,李德壮,梁静真,黄钧. 2018. 2011—2016年广西罗非鱼源无乳链球菌的耐药谱型分析[J]. 南方农业学报,49(5):1023-1031. [Huang Y H,Ma S,Han S Y,Huang W D,Wei M L,Meng L L,Lü X L,Qin H M,Li D Z,Liang J Z,Huang J. 2018. Antibiogram types of Streptococcus agalactiae strains isolated from Oreochromis spp. in Guangxi during 2011-2016[J]. Journal of Southern Agriculture,49(5):1023-1031.]
黎源,王蓓,汪志文,蔡小辉,汤菊芬,鲁义善,简纪常. 2017. 罗非鱼无乳链球菌传播途径与逃避宿主免疫防御策略[J]. 广东农业科学,44(7):132-140. [Li Y,Wang B,Wang Z W,Cai X H,Tang J F,Lu Y S,Jian J C. 2017. Transmission routes of Streptococcus agalactiae and the stra-tegy of immune evasion in tilapia[J]. Guangdong Agricultural Sciences,44(7):132-140.]
李东亮. 2016. 感染嗜水气单胞菌草鱼肠道菌群结构研究[D]. 杨凌:西北农林科技大学. [Li D L. 2016. Study of the intestinal flora structure of grass carp infection with Aeromonas hydrophila[D]. Yangling:Northwest Agriculture & Forestry University.]
李莉萍,王瑞,黄婷,黄维义,梁万文,李健,黄彦,雷爱莹,甘西,陈明. 2013. 广西罗非鱼链球菌病流行菌株PCR鉴定和PFGE基因型分析[J]. 水产学报,37(6):927-935. [Li L P,Wang R,Huang T,Huang W Y,Liang W W,Li J,Huang Y,Lei A Y,Gan X,Chen M. 2013. PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in Guangxi[J]. Journal of Fisheries of China,37(6):927-935.]
李莉萍,王瑞,梁万文,黄婷,罗永巨,雷爱莹,甘西,陈明. 2015. 罗非鱼无乳链球菌弱毒株与其母源株部分生物学特性及免疫原性比较研究[J]. 西南农业学报,28(5):2316-2322. [Li L P,Wang R,Liang W W,Huang T,Luo Y J,Lei A Y,Gan X,Chen M. 2015. Biological characteris-tics and immunization of live attenuated Streptococcus agalactiae strain for tilapia with parent[J]. Southeast China Journal of Agricultural Sciences,28(5):2316-2322.]
梁静真,黄立春,韦慕兰,马沙,黎姗梅,文衍红,蒙兰丽,黄维,黄松,黄钧. 2018. 广西罗非鱼源无乳链球菌耐药性及其四环素耐药基因检测[J]. 南方农业学报,49(10):2077-2086. [Liang J Z,Huang L C,Wei M L,Ma S,Li S M,Wen Y H,Meng L L,Huang W,Huang S,Huang J. 2018. Detection of antibiotics resistance and tetracycline resistance genes in Streptococcus agalactiae from tilapia in Guangxi[J]. Journal of Southern Agriculture,49(10):2077-2086.]
林虹,孙九峰,谈宇菲,邓小玲. 2013. 感染罗非鱼的无乳链球菌对人致病性的研究进展[J]. 华南预防医学,39(6):57-60. [Lin H,Sun J F,Tan Y F,Deng X L. 2013. Advan-ces in the research on human pathogenicity of Streptococcus agalactiae which also infected with tilapia[J]. South China Journal of Preventive Medicine,39(6):57-60.]
刘志刚,卢迈新,可小丽,王淼,张德锋. 2018. 尼罗罗非鱼肠道及养殖环境中菌群结构与链球菌病的相关性研究[J]. 水产学报,42(10):1635-1647. [Liu Z G,Lu M X,Ke X L,Wang M,Zhang D F. 2018. Correlation between microflora structure in intestinal tract and aquaculture environment of tilapia(Oreochromis niloticus) and streptococcicosis[J]. Journal of Fisheries of China,42(10):1635-1647.]
卢迈新. 2010. 罗非鱼链球菌病研究进展[J]. 南方水产,6(1):75-79. [Lu M X. 2010. Review of research on Streptococcusis in tilapia[J]. South China Fisheries Science,6(1):75-79.]
王瑞,李莉萍,黄婷,梁万文,梁聪,雷爱莹,陈明. 2015. 罗非鱼组织内无乳链球菌实时荧光定量PCR检测方法建立[J]. 南方水产科学,11(3):41-46. [Wang R,Li L P,Huang T,Liang W W,Liang C,Lei A Y,Chen M. 2015. Real-time quantitative PCR for detection of Streptococcus agalactiae from tilapia tissue[J]. South China Fishe-ries Science,11(3):41-46.]
袁伟. 2017. 中国罗非鱼源无乳链球菌流行特征及耐药性[D]. 上海:上海海洋大学. [Yuan W. 2017. Epidemiologi-cal characteristics and drug resistance of Streptococcus agalactiae isolated from tilapia in China[D]. Shanghai:Shanghai Ocean University.]
張正,李彬,王印庚,廖梅杰,王岚,荣小军. 2015. 基于高通量测序的池塘养殖半滑舌鳎消化道菌群的结构特征分析[J]. 水生生物学报,39(1):38-45. [Zhang Z,Li B,Wang Y G,Liao M J,Wang L,Rong X J. 2015. The microflora structure in digestive tract of half-smooth tongue sole(Cynoglossus semilaevis Günther) cultured in outdoor pond basing on high-through sequencing technique[J]. Acta Hydrobiologica Sinica,39(1):38-45.]
祝璟琳,柒壮林,李大宇,邹芝英,肖炜,乐贻荣,韩珏,杨弘. 2014. 罗非鱼海豚链球菌病的病理学观察[J]. 水产学报,38(5):722-730. [Zhu J L,Qi Z L,Li D Y,Zou Z Y,Xiao W,Yue Y R,Han J,Yang H. 2014. Pathological changes in tilapia(Oreochromis niloticus) naturally infec-ted by Streptococcus iniae[J]. Journal of Fisheries of China,38(5):722-730.]
祝璟琳,杨弘. 2013. 鱼源无乳链球菌致病机理研究进展[J]. 广东海洋大学学报,33(6):92-96. [Zhu J L,Yang H. 2013. Review on pathogenesis of Streptococcus agalactiae from fish[J]. Journal of Guangdong Ocean University,33(6):92-96.]
Gómez G D,Balcázar J L. 2008. A review on the interactions between gut microbiota and innate immunity of fish[J]. FEMS Immunology and Medical Microbiology,52(2):145-154.
Jandhyala S M,Madhulika A,Deepika G,Rao G V,Reddy D N,Subramanyam C,Sasikala M,Talukdar R. 2017. Altered intestinal microbiota in patients with chronic pancreatitis:Implications in diabetes and metabolic abnorma-lities[J]. Scientific Reports,7:43640. doi:10.1038/srep4 3640.
Kelly P. 2010. Nutrition,intestinal defence and the microbio-me[J]. The Proceeding of the Nutrition Society,69(2):261-268.
Nayak S K. 2010. Role of gastrointestinal microbiota in fish[J]. Aquaculture Research,41(11):1553-1573.
Nishino K,Nishida A,Inoue R,Kawada Y,Ohno M,Sakai S,Inatomi O,Bamba S,Sugimoto M,Kawahara M,Naito Y,Andoh A. 2017. Analysis of endoscopic brush samples identified mucosa-associated dysbiosis in inflammatory bowel disease[J]. Journal of Gastroenterology,53(1):95-106.
Roeselers G,Mittge E K,Stephens W Z,Parichy D M,Cavanaugh C M,Guillemin K,Rawls J F. 2010. Evidence for a core gut microbiota in the zebrafish[J]. The ISME Journal,5(10):1595-1608.
Sommer F,Bäckhed F. 2013.The gut microbiota—masters of host development and physiology[J]. Nature Reviews. Microbiology,11(4):227-238.
Thursby E,Juge N. 2017. Introduction to the human gut microbiota[J]. Biochemical Journal,474:1823-1836.
Xia J H,Lin G,Fu G H,Wan Z Y,Lee M,Wang L,Liu X J,Yue G H. 2014. The intestinal microbiome of fish under starvation[J]. BMC Genomics,15:266. doi: 10.1186/1471-2164-15-266.
Zhao N,Li M,Luo J,Wang S,Liu S,Wang S,Lyu W,Chen L,Su W,Ding H,He H. 2017. Impacts of canine distemper virus infection on the giant panda population from the perspective of gut microbiota[J]. Scientific Reports,7:39954. doi: 10.1038/srep39954.
(責任编辑 兰宗宝)

