一株野生粗毛纤孔菌的分类鉴定及其发酵上清液的抗肿瘤活性
唐少军 陈定安 邵晨霞 许隽 杨祎 靳磊 吴胜莲




摘要:【目的】對一株野生粗毛纤孔菌进行分类学鉴定,并分析其发酵上清液抗肿瘤活性,为粗毛纤孔菌的开发利用及抗肿瘤活性机制研究提供理论依据。【方法】通过形态特性观察、ITS序列分析及系统发育进化树构建等方法对一株野生粗毛纤孔菌(简称IH3菌株)进行分类学鉴定,并利用B16、Hep-3B、Hela、MCF-7、HCT-116和4T1 6种肿瘤细胞及正常细胞HUVEC分析该菌株发酵上清液的抗肿瘤谱。从石油醚、乙酸乙酯和正丁醇中筛选出萃取抗肿瘤活性物质的最佳有机溶剂,利用液相色谱分离技术分离抗肿瘤活性组分,并利用MTT(四唑盐)法分析活性组分对不同肿瘤细胞的半致死浓度(IC50)。【结果】IH3菌株的形态特性与粗毛纤孔菌相似,且其ITS序列与粗毛纤孔菌(MF183947.1)的相似度最高,为98%,鉴定为粗毛纤孔菌。系统发育进化树分析结果也显示,IH3菌株属于纤层孔菌属类群,与3个粗毛纤孔菌菌株的亲缘关系较近。IH3菌株的发酵上清液对不同肿瘤细胞的抑制活性排序为:B16>Hep-3B>Hela>MCF-7>4T1=HCT-116。正丁醇萃取的IH3菌株发酵上清液抗肿瘤活性组分对B16肿瘤细胞的抑制率最高,达80%,说明正丁醇对发酵上清液中抗肿瘤活性组分的萃取效果最佳。利用液相色谱分离方法可有效获得纯度较高的单一抗肿瘤活性组分(WIH3),该活性组分对B16、Hep-3B、Hela和MCF-7肿瘤细胞的半致死浓度(IC50)分别为29.322、37.387、47.029和58.009 µg/mL。【结论】IH3菌株被鉴定为粗毛纤孔菌,与已发表的粗毛纤孔菌菌株存在遗传差异,可能为粗毛纤孔菌的新亚种,其发酵上清液具有广谱的抗肿瘤活性。
关键词: 粗毛纤孔菌;鉴定;抗肿瘤活性;液相色谱分离;半致死浓度(IC50)
中图分类号: S718.81 文献标志码: A 文章编号:2095-1191(2019)08-1671-09
Classification and identification of a wild Inonotus hispidus and the antitumor activity of the fermentation supernatant
TANG Shao-jun1, CHEN Ding-an2, SHAO Chen-xia1, XU Jun1, YANG Yi1,
JIN Lei1, WU Sheng-lian1*
(1Hunan Microbiology Institute, Changsha 410009, China; 2 Agricultural Science Research Institute of Dingcheng District, Changde, Hunan 415102, China)
Abstract:【Objective】The wild Inonotus hispidus was classified and identified,and the antitumor activity of its fermentation supernatant was analyzed,which provided a basis for the development and utilization of this strain as well as research of antitumor activity mechanism. 【Method】A wild I. hispidus(IH3 fungi) was classified and identified through the morphology observation,ITS sequence and phylogenetic tree. The antitumor spectrum of the fermentation supernatant was analyzed by six kinds of tumor cells including B16, Hep-3B, Hela, MCF-7, HCT-116 and 4T1 and normal cell HUVEC. The optimal organic reagent was selected from petroleum ether, acetic ether and normal butanol. The antitumor active component was isolated by liquid chromatography, and medial lethal concentration(IC50) of different tumor cells was ana-lyzed by MTT(tetrazolium salt). 【Result】IH3 fungi was similar to I. hispidus in morphology,its ITS sequence was the closest to the I. hispidus strain MF183947.1 with the similarity of 98%. It was preliminarily identified as I. hispidus.The phylogenetic tree analysis indicated that IH3 fungi belonged to Inonotus, and had close relationship with three I. hispidus strains. Inhibition activity of IH3 fungi fermentation supernatant to the tumor cells was: B16>Hep-3B>Hela>MCF-7>4T1=HCT-116. The inhibition rate of antitumor active component of IH3 strain fermentation supernatant extracted from normal butanol to B16 tumoe cell was the highest(80%),indicating that normal butanol had the best extraction effect on antitumor active substances in fermentation supernatant. A single antitumor active component(WIH3) with high purity was obtained by liquid chromatography. Its IC50 to tumor cells B16,Hep-3B,Hela and MCF-7 were 29.322,37.387,47.029,58.009 µg/mL, respectively. 【Conclusion】The IH3 strain was identified as I. hispidus,which is different from the published I. hispidus strains genetically,it may be a new subspecies of I. hispidus,and its fermentation supernatant has a broad spectrum of antitumor activity.
Key words: Inonotus hispidus; identification; antitumor activity; liquid chromatography; medial lethal concentration
0 引言
【研究意义】粗毛纤孔菌(Inonotus hispidus)主要生长在水曲柳、桑树、榆树、杨树和日本槐等树种的活立木上,偶尔生长在其倒木上(王婷等,2016;Markakis et al.,2017)。该菌是一种重要的药用真菌,在我国东北地区常用于治疗消化不良等胃病,新疆南部等地区常用于治疗癌症、糖尿病等疑难疾病(崔宝凯等,2009;甄占萱等,2013),但其菌种资源较少,主要采集野生的子实体入药。因此,丰富粗毛纤孔菌的菌种资源,筛选分离出药效成分含量高、活性强的新菌株,对粗毛纤孔菌的开发利用具有重要意义。【前人研究进展】目前,有关粗毛纤孔菌的研究主要集中在药用价值方面(Awadh et al.,2003;Gründemann et al.,2016;Liu et al.,2019a)。陈志娜等(2018)研究发现,粗毛纤孔菌甲醇提取物中的总多酚和总黄酮含量最高,抗氧化活性和抑菌活性最强,是天然抗氧化剂的良好来源。Liu等(2019b)研究发现,粗毛纤孔菌子实体和菌丝体中的多糖成分能显著延长小鼠的醉酒时间及缩短醒酒时间,并减缓由酒精引起的肝指数、谷丙转氨酶(ALT)活性、谷草转氨酶(AST)活性和丙二醛(MDA)含量的升高,提高乙醇脱氢酶(ADH)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性,对急性酒精肝损伤小鼠具有一定的保护作用。此外,粗毛纤孔菌子实体中含有多种抗肿瘤活性成分,如inonotusin A对人乳腺癌细胞MCF-7、inoscavin C对肝癌细胞HepG-2和卵巢癌细胞skov3均具有一定的抑制作用(Zan et al.,2011;昝立峰等,2013);子实体多糖成分具有抗肿瘤活性,可抑制H22荷瘤小鼠的肿瘤生长(张媛和包海鹰,2014);丁炔二醇丙氧基化合物(BMP)对HepG2肝癌细胞有明显的抑制作用,且诱导肿瘤细胞凋亡(杨树东等,2019);HDE[(4S,5S)-4-羟基-3,5-二甲氧基环己烯-2-烯酮]可通过增强caspase-3和caspase-8蛋白的表达而抑制小鼠肝癌细胞H22增长(Yang et al.,2019);Hispolon可通过阻碍细胞形成NF-κβ复合体而抑制肿瘤生长(Paul et al.,2019)。【本研究切入点】虽然已有大量研究证实粗毛纤孔菌子实体具有良好的抗氧化、抗病毒和提高免疫力的作用,应用潜力巨大,但其菌种资源匮乏,鲜见鉴定野生粗毛纤孔菌菌株并测定其发酵液抗肿瘤活性的研究报道。【拟解决的关键问题】通过形态特性观察、ITS序列分析及系统发育进化树构建等方法对一株野生粗毛纤孔菌进行分类学鉴定;利用B16、Hep-3B、Hela、MCF-7、HCT-116和4T1 6种肿瘤细胞及正常细胞HUVEC分析该菌株发酵上清液的抗肿瘤谱;利用液相色谱分离技术分离抗肿瘤活性组分;利用MTT(四唑盐)法分析活性组分的半致死浓度(IC50),通过体外细胞实验分析活性组分的药用价值,为粗毛纤孔菌的药用开发提供重要理论依据。
1 材料与方法
1. 1 试验材料
小鼠黑色素瘤细胞B16、肝癌肿瘤细胞Hep-3B、人宫颈癌肿瘤细胞Hela、人乳腺癌肿瘤细胞MCF-7、小鼠乳腺癌肿瘤细胞4T1、人结肠癌肿瘤细胞HCT-116和人脐静脉血管内皮正常细胞HUVEC均购自中国典型培养物保藏中心(CCTCC)。供试的野生粗毛纤孔菌采摘于湖南省桑植县的活杨树主干上,由湖南省微生物研究院实验室保藏(保藏编号IH3,NCBI登录号MK583675.1),以下简称为IH3菌株。rTaq DNA聚合酶、T载体和连接酶均购自生工生物工程(上海)股份有限公司。色谱甲醇购自美国FISHER公司,其他试剂均为国产分析纯,购自北京化工厂。胎牛血清(FBS)购自杭州四季青生物工程有限公司。
主要仪器设备:N-1000v-W型旋转蒸发仪(瑞士Büchi公司)、XDS-3型倒置生物显微镜(意大利Optika公司)、C18反相色谱柱、酶标仪(美国Bio-Rad公司)和Agilent 1260高效液相色谱仪(安捷伦科技有限公司)。
1. 2 试验方法
1. 2. 1 菌株分离纯化 将采集的子实体用75%酒精消毒表面,以无菌手术刀纵切,从纵切面的中心位置切取黄豆大小的菌块,置于PDA固体培养基表面,26 ℃培养箱正置培养,待菌丝萌发后,挑取菌丝至新的PDA培养基,反复3次后,将菌丝转接至PDA斜面培养基进行留种。
1. 2. 2 形态学鉴定 采用插片法观察分离菌株的菌丝形态:将纯化菌丝接种于PDA固体培养基,在离接种点2 cm处45º斜插盖玻片,26 ℃培养7 d后,取出布有菌丝的盖玻片,置于载玻片上,在XDS-3型倒置生物显微镜下观察菌丝形态。
1. 2. 3 ITS序列扩增 供试菌株接种至PDA固体培养基上,待菌丝长满后取适量菌丝,利用真菌基因组提取试剂盒提取其DNA,参照吴胜莲等(2018)的方法,采用ITS1和ITS4通用引物PCR扩增其ITS序列,用1%琼脂糖凝胶电泳检测PCR产物,并送至生工生物工程(上海)股份有限公司进行测序。
1. 2. 4 系统发育进化树构建 将ITS序列测序结果提交至NCBI数据库进行BLAST比对,从中获取与供试菌株亲源关系较近的模式菌株ITS序列,并选取在分类上易与粗毛纤孔菌混淆的桑黄菌属和针层孔菌属的ITS序列,运用ClustalX 1.81进行多重序列比对。最后,利用MEGA 3.1的鄰接法(N-J)构建系统发育进化树(Replications=1000,Bootstrap值取百分比)。
1. 2. 5 菌株发酵上清液的抗肿瘤谱分析 将PDA固体培养基上的菌丝用打孔法接种到PDA液体培养基中,每100 mL液体培养基接种4个菌丝块,置于26 ℃摇床培养箱(130 r/min)中培养10 d,用无菌纱布过滤出菌丝球后即可获得发酵上清液。将发酵上清液用2 μm滤膜过滤除菌后4 ℃保存。用含10% FBS的RPMI-1640培养基培养肿瘤细胞,在96孔板中接种B16、Hep-3B、Hela、MCF-7、HCT-116和4T1肿瘤细胞及正常细胞HVUEC,每孔1×103 cells/100 µL,置于5% CO2培养箱中,37 ℃培养12 h,分别加入5、10、15、20、30和35 µL发酵上清液作为药物组,以加入同体积的无菌水作为对照,调零组只加细胞培养基不加细胞和样品,以上均设4个重复。培养48 h后,观察细胞形态变化,每孔加5 mg/mL MTT 10 μL,培养3 h后,吸除MTT和培养基,每孔加入100 μL Formazan溶解液,振荡15 min后,490 nm波长下测定OD,从而计算出发酵上清液对肿瘤细胞的抑制率:细胞抑制率(%)=(药物组-对照组)/(调零组-对照组)×100(张连茹等,2010)。
1. 2. 6 抗肿瘤活性成分萃取分离 收集6 L菌株发酵上清液,用旋转蒸发仪浓缩体积至600 mL,再分装成3份,各200 mL,分别用石油醚、乙酸乙酯和正丁醇3种有机溶剂对发酵上清液进行萃取(体积比为有机溶剂∶发酵上清液=3∶1),分别萃取3次,用旋转蒸发仪去除有机溶剂后,分别用10 mL无菌水复溶。在96孔板中接种B16肿瘤细胞,分别加入30 µL的萃取样品,培养48 h后计算发酵上清液对肿瘤细胞的抑制率,跟踪检测活性成分,以筛选出萃取抗肿瘤活性物质的最佳有机溶剂。
1. 2. 7 液相色谱分离 首先对正丁醇萃取的抗肿瘤活性成分进行分子筛色谱分离(色谱柱Sephadex LH-20,流动相0.08 mol/L NaH2PO4溶液,流速1.0 mL/min,检出波长250 nm,洗脱时间30 min),收集色谱主峰洗脱液,对其进行抗肿瘤活性检测,检出活性峰。然后对收集的活性峰进行反相色谱分离(C18反相色谱柱,流动相A为无菌水,流动相B为乙腈,流速0.5 mL/min,5%~95%无菌水进行梯度洗脱,洗脱时间25 min,检出波长250 nm),收集每个峰洗脱液,用旋转蒸发仪去除有机溶剂后,用10 mL无菌水复溶,对其进行抗肿瘤活性检测,检出活性峰。
1. 2. 8 MTT法分析活性组分 将液相色谱分离得到的活性组分配制成不同浓度梯度溶液(10、20、30、40、50、60、70和80 μg/mL)。在96孔板中接种B16、Hela、Hep-3B和MCF-7肿瘤细胞及正常细胞HUVEC,每孔1×103 cells/100 µL,分别加入30 µL不同浓度梯度的活性组分溶液,以30 µL无菌水为对照,5% CO2培养箱中分别培养24、48和60 h后,每孔加5 mg/mL MTT 10 μL,培养3 h后,吸除MTT和培养基,每孔加入100 μL Formanzan溶解液,振荡15 min,490 nm波长下测定OD,计算活性组分对肿瘤细胞的抑制率及半致死浓度(IC50)。
1. 3 数据分析
肿瘤细胞的抑制率采用GraphPad Prism 5进行分析并制图,IC50采用SPSS 13.0进行分析并制图。
2 结果与分析
2. 1 IH3菌株的形态学鉴定结果
IH3菌株的子实体呈平伏状,木栓质,长13 cm,宽8 cm,厚3 cm,上部分为青色褶皱状,无粗毛,边缘有褐色粗毛,下部分为金黄色并生长有粗毛,粗毛间有孔隙(图1-A)。该菌株菌丝在PDA固体培养基上以接种块为中心呈辐射状扩张生长,呈绒毛状,生长前期为白色,后期变为金黄色,在棉蓝试剂中不变色,在PDA液体培养基中菌丝呈黄色球型,可貼壁生长,菌丝直径约5 μm,极少分枝,有不明显的分隔(图1-B、图1-C和图1-D)。担孢子呈椭圆形,表面光滑,平均长度为8.8 μm,宽6.1 μm,形态特征与《中国真菌志》(张小青和戴玉成,2005)粗毛纤孔菌相似。
2. 2 IH3菌株的分子生物学鉴定结果
对IH3菌株ITS序列的PCR产物双向测序后,将测序结果进行拼接,发现ITS序列的长度为810 bp,将其提交至NCBI数据库中进行BLAST比对,结果发现,其与粗毛纤孔菌(MF183947.1)ITS序列的相似度为98%。结合该菌株的形态学特征,最终确定IH3菌株为粗毛纤孔菌(I. hispidus)。
从NCBI选取与IH3菌株同源性较高的3个粗毛纤孔菌菌株、纤孔菌属5个模式菌种及在分类上易与粗毛纤孔菌混淆的针层孔菌属和桑黄菌属模式菌种的ITS序列,采用邻接法构建系统发育进化树,结果如图2所示。系统发育进化树明显分为三大类群,Group 1为桑黄孔菌属(Sanghuangporus),Group 2为针层孔菌属(Phellinus),Group 3为纤层孔菌属(Inonotus)。IH3菌株属于Group 3(纤孔菌属),与3个粗毛纤孔菌菌株的亲缘关系较近,尤其是与粗毛纤孔菌(MF183947.1)的亲缘关系最近,进一步证实IH3菌株为粗毛纤孔菌。但该菌株在系统发育进化树上形成独立分支,且与亲缘关系最近的菌株ITS相似度仅为98%,说明IH3菌株与已发表的粗毛纤孔菌存在遗传差异,可能是粗毛纤孔菌的新亚种。虽然粗毛纤孔菌的形态与桑黄菌属和针层孔菌属菌株类似,但三者分别属于不同类群,存在明显的遗传差异。将IH3菌株的ITS序列提交NCBI数据库,登录号为MK583675.1。
2. 3 IH3菌株发酵上清液的抗肿瘤谱分析结果
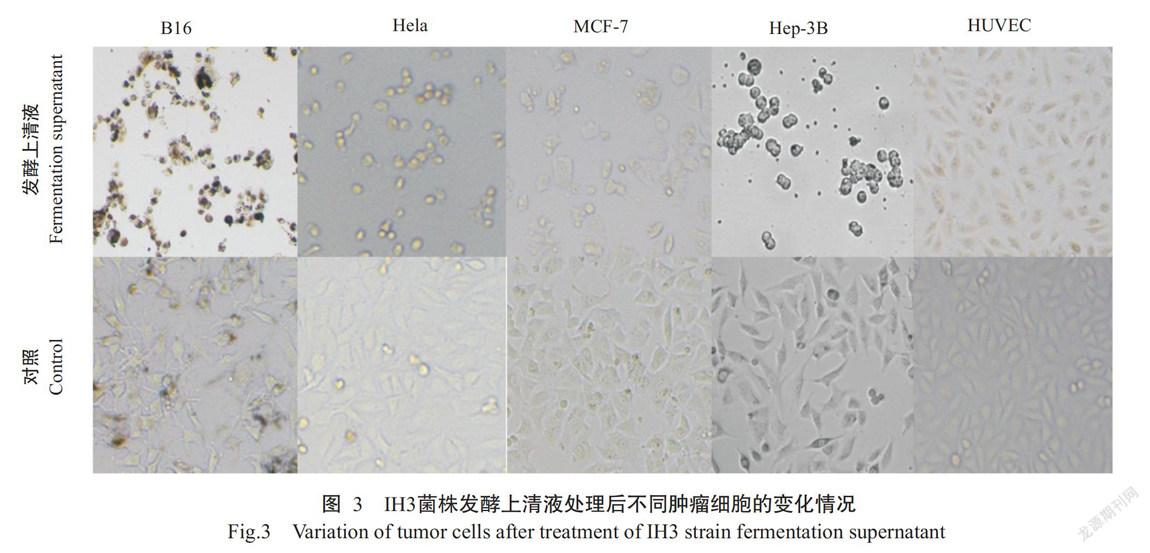
由图3可知,对照组的肿瘤细胞形态规则且致密贴壁生长,药物组的肿瘤细胞明显变形,细胞变圆稀疏,甚至漂浮。正常细胞HUVEC的对照组与药物组几乎没有差别。由图4可知,随着发酵上清液体积的增加,B16、Hela、MCF-7和Hep-3B肿瘤细胞的抑制率明显增加,但4T1和HCT肿瘤细胞及正常细胞HUVEC的抑制率增加不明显;IH3菌株发酵上清液对不同肿瘤细胞的抑制活性排序为:B16>Hep-3B>Hela>MCF-7>4T1=HCT-116,说明IH3菌株的发酵上清液具有广谱的抗肿瘤活性。
2. 4 发酵上清液中肿瘤活性成分的萃取分离结果
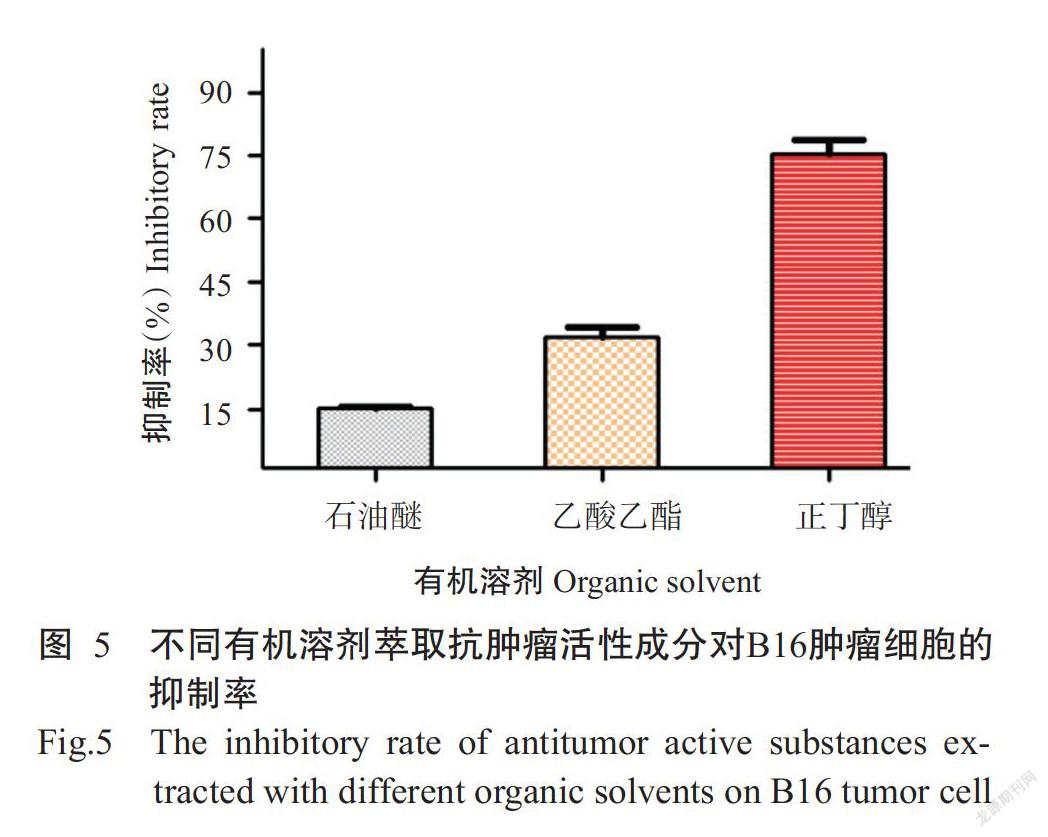
分别用石油醚、乙酸乙酯和正丁醇对浓缩后的发酵上清液进行萃取,以筛选出萃取抗肿瘤活性物质的最佳有机试剂,结果如图5所示。正丁醇萃取抗肿瘤活性成分对B16肿瘤细胞的抑制率最高,达80%,说明正丁醇对发酵上清液中抗肿瘤活性成分的萃取效果最佳。
2. 5 液相色谱分离活性物质
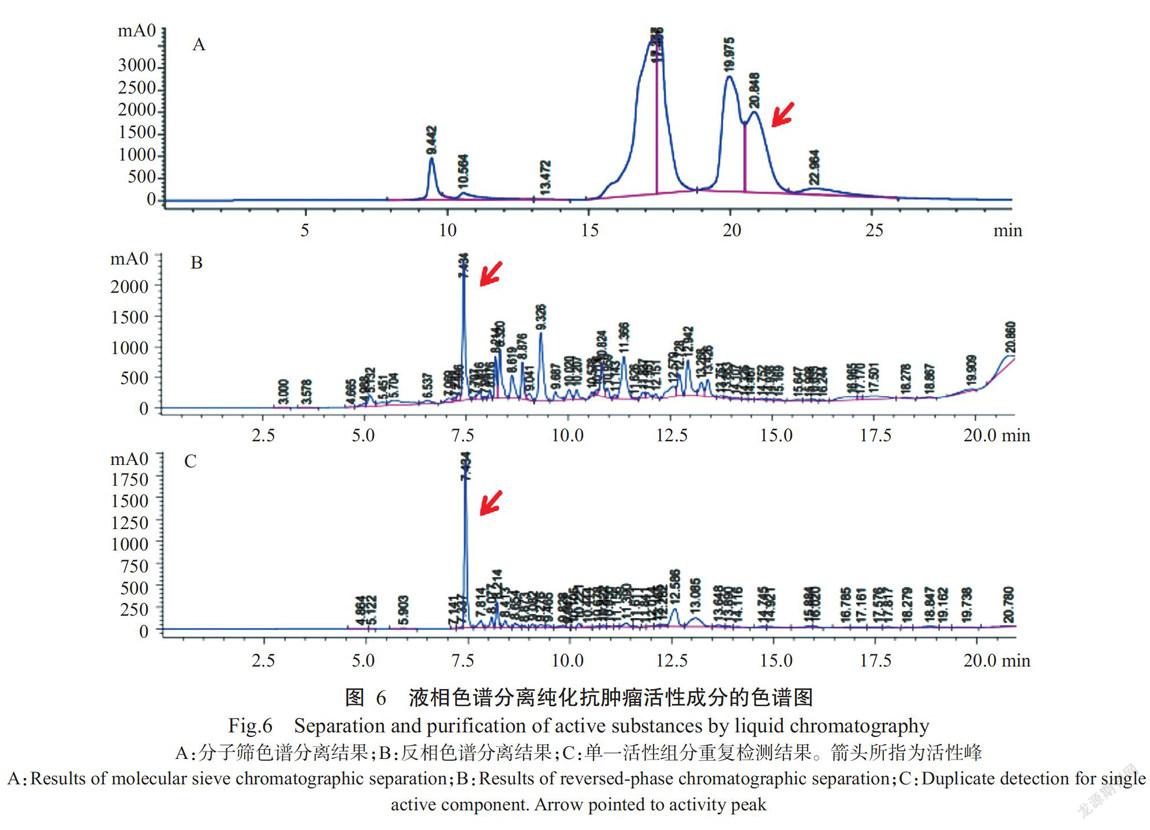
对正丁醇萃取的抗肿瘤活性成分进行分子筛色谱分离,结果如图6-A所示。共得到3个色谱主峰,分别对3个主峰的收集液进行抗肿瘤活性检测,结果发现19~23 min的色谱峰为活性峰。对分子筛收集到的活性峰进行反相色谱分离,结果如图6-B所示。7.6 min的色谱峰为活性峰,收集该活性峰的洗脱液,蒸发浓缩后用10 mL无菌水复溶,再用C18反相色谱柱进行重复上样检测,结果如图6-C所示。仅获得单一活性峰,峰度较高,峰型对称,纯度达90%。可见,利用上述液相色谱分离方法可有效获得纯度较高的单一抗肿瘤活性组分,将该单一组分命名为WIH3。
2. 6 WIH3活性组分的IC50测定结果
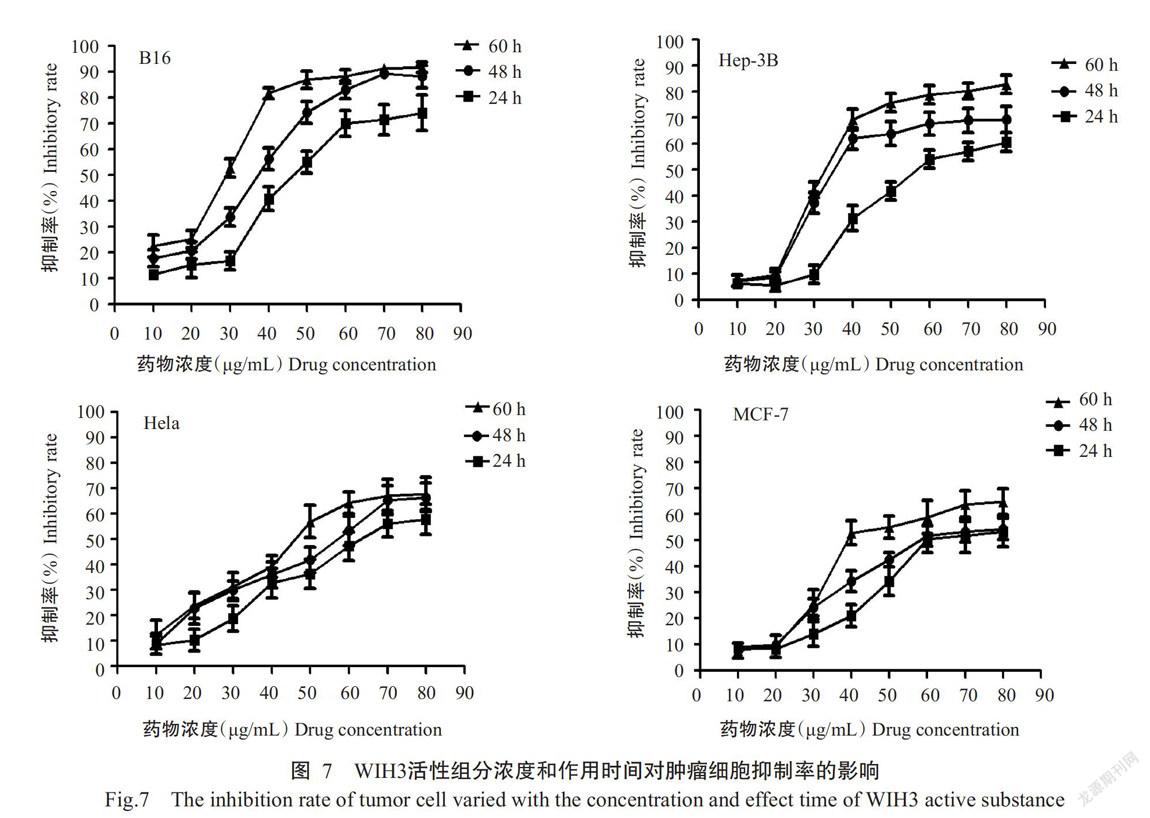
将WIH3活性组分配制成不同浓度梯度的溶液,用于检测其对不同肿瘤细胞的抑制活性,结果如图7所示。随着WIH3活性组分浓度的增加,对B16、Hep-3B、Hela和MCF-7肿瘤细胞的抑制率均逐渐增大,说明该活性组分对这4种肿瘤细胞具有较强的抑制活性;当WIH3活性组分浓度相同情况下,随着作用时间的增加,肿瘤细胞的抑制率也相应增大。
利用SPSS 13.0统计分析WIH3活性组分对不同肿瘤细胞作用48 h的IC50,结果发现该活性组分对肿瘤细胞B16、Hep-3B、Hela和MCF-7的IC50分别为29.322、37.387、47.029和58.009 µg/mL(表1),说明WIH3活性组分具有广谱高效的抗肿瘤活性。
3 讨论
对大型真菌的鉴定主要依据形态特征,包括子实体、菌丝和孢子的形态。本研究结果表明,从野外采摘的IH3菌株在子实体形态上与粗毛纤孔菌和桑黄相似,但大型真菌子实体形态易受生长环境和生长时期等客观因素的影响,且形态性状的判断易受主观因素的影响,因此,仅从子实体形态无法对其进行准确鉴定。利用分子生物学手段如ITS序列分析等对大型真菌进行鉴定,准确度和灵敏度更高,且能更简便、快速、客观地揭示其遗传关系(Li et al.,2008;Alaei et al.,2009)。因此,本研究对IH3菌株进行ITS序列分析,结果发现其与粗毛纤孔菌(MF183947.1)的ITS序列相似度最高,为98%,结合该菌株的形态学特征,最终确定IH3菌株为粗毛纤孔菌(I. hispidus)。但该菌株在系统发育进化树上形成独立分支,且与亲缘关系最近的菌株相似度仅为98%,推测IH3菌株是粗毛纤孔菌的新亚种。
由于粗毛纤孔菌的子实体形态和生长环境与药用真菌桑黄类似,在新疆南部等地区将其作为桑黄入药(崔宝凯等,2009;甄占萱等,2013)。目前,仍有大量学者对粗毛纤孔菌和桑黄的分类学地位产生争议。崔宝凯等(2009)研究认为,粗毛纤孔菌不是桑黄,二者子实体存在差异,粗毛纤孔菌较明显的特征表现为子实体表面有大量褐色粗毛。Wu等(2012)通过研究分析桑黄的子实体形态和ITS序列得出桑黄为一个新种的结论,并命名为Inonotus sanghuang。Zhou等(2015)研究发现,针层孔菌属中与桑黄相关种不属于同一类群,将相关种类组合成新的属——桑黄孔菌属(Sanghuangporus),且粗毛纤孔菌不属于该属。包海鹰等(2017)从生长环境、形态特征和药用功效等方面對现代药用真菌粗毛纤孔菌和桑黄进行比较,结果发现,古代中药所指的“桑黄”不是单一的一个物种,而是包括来自针层孔菌属(Phellinus)、纤层孔菌属(Inonotus)和嗜蓝孢孔菌属(Fomitiporia)等菌种的木腐菌子实体。综上所述,更多的学者认为粗毛纤孔菌不是桑黄。本研究也发现,桑黄孔菌属、针层孔菌属和纤层孔菌属分属于不同的三大类群,IH3菌株属于纤层孔菌属类群,而不属于桑黄孔菌属类群。
粗毛纤孔菌是一种珍贵的药用真菌,其子实体富含多种活性成分,主要为多糖和三萜类等抗肿瘤活性物质,应用潜力巨大,但野生粗毛纤孔菌资源缺乏,且受季节限制。已有研究发现,通过液体发酵可得到大量粗毛纤孔菌菌丝,菌丝体也同样含抗肿瘤活性物质(李德海等,2018;刘鑫等,2018b)。且从发酵液中分离胞外次级代谢产物具有重复性好、样本量大等优点,是发现抗肿瘤新药前导分子的重要手段。本研究从IH3菌株的发酵上清液中萃取获得抗肿瘤活性成分后,利用Sephadex LH-20色谱柱对其进行分子筛色谱分离,发现活性峰出现时间较晚,说明活性成分分子量偏小,再用C18反相色谱柱将收集到的活性峰洗脱液进行反相色谱分离,即可得到纯度较高的单一组分WIH3,具有广谱高效的抗肿瘤活性。刘鑫等(2018a)从粗毛纤孔菌的发酵液粗提物中检测到2种新物质,其中一种活性物质为鸟苷,具有抗乳腺癌活性,与本研究发现WIH3活性组分能抑制人乳腺癌细胞MCF-7的结论相似。因此,后续应对WIH3活性组分进行结构鉴定及抗肿瘤机制分析。
4 结论
IH3菌株被鉴定为粗毛纤孔菌,与已发表的粗毛纤孔菌菌株存在遗传差异,可能为粗毛纤孔菌的新亚种,其发酵上清液具有广谱的抗肿瘤活性。
参考文献:
包海鹰,杨烁,李庆杰,图力古尔,李玉. 2017. “桑黄”的本草补充考证[J]. 菌物研究,15(4):265-270. [Bao H Y,Yang S,Li Q J,Bau T,Li Y. 2017. Supplementary textual research on “Sanghuang”[J]. Journal of Fungal Research,15(4):265-270.]
陈志娜,许嘉敏,叶韬,周江雯,孙雨晨,解昕媛,余璟,刘宇. 2018. 粗毛纤孔菌(Inonotus hispidus)的鉴定及其子实体不同溶剂提取物的抗氧化活性与抑菌活性研究[J]. 食品工业科技,39(23):99-104. [Chen Z N,Xu J M,Ye T,Zhou J W,Sun Y C,Xie X Y,Yu J,Liu Y. 2018. Identification of Inonotus hispidus and antioxidant and antimicrobial activities of different solvent extracts from its fruiting bodies[J]. Science and Technology of Food Industry,39(23):99-104.]
崔宝凯,戴玉成,杨宏. 2009. 药用真菌粗毛纤孔菌概述[J]. 中国食用菌,28(4):6-7. [Cui B K,Dai Y C,Yang H. 2009. Notes on the medicinal fungus of Inonotus hispidus[J]. Edible Fungi of China,28(4):6-7.]
戴玉成,杨祝良. 2008. 中国药用真菌名录及部分名称的修订[J]. 菌物学报,27(6):801-824. [Dai Y C,Yang Z L. 2008. A revised checklist of medicinal fungin China[J]. Mycosystema,27(6):801-824.]
李德海,杜令娟,康宁,顾嘉林,王占斌. 2018. 提取技术对粗毛纤孔菌三萜类化合物制备及体外降血脂作用的影响[J]. 食品科学,39(10):291-297. [Li D H,Du L J,Kang N,Gu J L,Wang Z B. 2018. Effect of extraction techniques on the extraction and hypolipidemic activity in vitro of triterpenoids from Inonotus hispidus[J]. Food Science,39(10):291-297.]
刘鑫,侯若琳,金珊珊,戚梦,胡开辉,郑明锋,傅俊生. 2018a. 药用真菌粗毛纤孔菌的分子甄别及其发酵液抗乳腺癌活性研究[J]. 菌物学报,37(2):215-225. [Liu X,Hou R L,Jin S S,Qi M,Hu K H,Zheng M F,Fu J S. 2018a. Molecular screening of medicinal fungus Inonotus hispidus and antibreastcancer activities of its submerged fermentation broth[J]. Mycosystema,37(2):215-225.]
刘鑫,侯若琳,麦梦贤,吴小平,林文雄,郑明锋,傅俊生. 2018b. 粗毛纤孔菌子实体与菌丝体粗多糖改善小鼠急性酒精肝损伤的比较研究[J]. 菌物学报,37(11):1532-1539. [Liu X,Hou R L,Mai M X,Wu X P,Lin W X,Zheng M F,Fu J S. 2018b. Comparison of effects of crude polysaccharide from fruiting body and mycelia of Inonotus hispidus on acute alcoholic liver injury in mice[J]. Mycosystema,37(11):1532-1539.]
王婷,包海鷹,图力古尔,李玉. 2016. 寄生于蒙古黄榆上的粗毛纤孔菌生物学特性及驯化栽培[J]. 菌物学报,35(6):694-704. [Wang T,Bao H Y,Bau T,Li Y. 2016. Biological characteristics and cultivation of Inonotus hispidus parasitizing on Ulmus macrocarpa var. Mongolica[J]. Mycosystema,35(6):694-704.]
吴胜莲,唐少军,靳磊,邵晨霞,杨祎,贺月林. 2018. 不同茯苓菌株的质量评价及遗传关系鉴定[J]. 南方农业学报,49(1):8-13. [Wu S L,Tang S J,Jin L,Shao C X,Yang Y,He Y L. 2018. Quality evaluation and genetic relation identification for different Poria cocos strains[J]. Journal of Southern Agriculture,49(1):8-13.]
杨树东,包海鹰,王辉. 2019. 粗毛纤孔菌的化学成分及抗肿瘤活性成分[J]. 菌物学报,38(1):127-133. [Yang S D,Bao H Y,Wang H. 2019. Chemical components and anti-tumour compounds from Inonotus hispidus[J]. Mycosystema,38(1):127-133.]
昝立峰,包海鹰,图力古尔,李玉,朱艳萍. 2013. 粗毛纤孔菌子实体化学成分[J]. 菌物学报,32(1):150-156. [Zan L F,Bao H Y,Bau T,Li Y,Zhu Y P. 2013. Chemical composition in fruiting body of Inonotus hispidus(Hymenochaetales,Basidiomycota)[J]. Mycosystema,32(1):150-156.]
張连茹,易玉婷,陈俊杰,张伟,黄耀坚,郑忠辉,宋思扬,沈月毛. 2010. 基于抗肿瘤活性化合物MED烟酸类衍生物的设计及作用靶点[J]. 高等学校化学学报,31(6):1184-1189. [Zhang L R,Yi Y T,Chen J J,Zhang W,Huang Y J,Zheng Z H,Song S Y,Shen Y M. 2010. Probing target and designing nicotinoid derivatives for antitumor leading compound MED[J]. Chemical Journal of Chinese Universities,31(6):1184-1189.]
张小青,戴玉成. 2005. 中国真菌志(第二十九卷)锈革孔菌科[M]. 北京:科学出版社:44-45. [Zhang X Q,Dai Y C. 2005. Chinese fungi(vol. 29) Hymenochaetaceae[M]. Bei-jing:Science Press:44-45.]
张媛,包海鹰. 2014. 四种多孔菌子实体粗多糖抗肿瘤活性的比较研究[J]. 菌物学报,33(1):114-120. [Zhang Y,Bao H Y. 2014. A comparative study on antitumor activities of polysaccharides from four species of Polyporaceae[J]. Mycosystema,33(1):114-120.]
甄占萱,李云祥,王晖,杨贵明,宋永学. 2013. 野生桑黄的生长发育及环境调查[J]. 蚕业科学,39(2):333-339. [Zhen Z X,Li Y X,Wang H,Yang G M,Song Y X. 2013. An investigation on development and growth environment of wild Phellinus linteus[J]. Science of Sericulture,39(2):333-339.]
Alaei H D,Backer M,Nuytinck J. 2009. Hylogenetic relationships of Puccinia horiana and other rust pathogens of Chrysanthemum morifolium based on rDNA ITS sequence analysis[J]. Mycological Research,113(6/7):668-683.
Awadh A N A,Mothana R A A,Lesnau A,Pilgrim H,Linde-quist U. 2003. Antiviral activity of Inonotus hispidus[J]. Fitoterapia,74(5):483-485.
Gründemann C,Arnhold M,Meier S,Bäcker C,Garcia-Käufer M,Grunewald F,Steinborn C,Klemd A M,Wille R,Huber R,Lindequist U. 2016. Effects of Inonotus hispidus extracts and compounds on human immunocompetent cells[J]. Planta Medica,82(15):1359-1367.
Li Z,Feng X,Lu S,Zhang F,Wang F,Huang S. 2008. Mole-cular phylogeny of Pneumocystis based on 5.8S rRNA gene and the internal transcribed spacers of rRNA gene sequences[J]. Science in China Series C:Life Sciences,51(5):445-452.
Liu X,Hou R,Xu K,Chen L,Wu X,Lin W,Zheng M,Fu J. 2019a. Extraction,characterization and antioxidant activity analysis of the polysaccharide from the solid-state fermentation substrate of Inonotus hispidus[J]. International Journal of Biological Macromolecules,23(15):468-476.
Liu X,Hou R,Yan J,Xu K,Wu X,Lin W,Zheng M,Fu J. 2019b. Purification and characterization of Inonotus hispidus exopolysaccharide and its protective effect on acute alcoholic liver injury in mice[J]. International Journal of Biological Macromolecules,4(129):41-49.
Markakis E A,Kavroulakis N,Ntougias S,Koubouris G C,Sergentani C K,Ligoxigakis E K. 2017. Characterization of fungi associated with wood decay of tree species and grapevine in Greece[J]. Plant Disease,101(11):1929-1940
Paul M,Panda M K,Thatoi H. 2019. Developing Hispolon based novel anticancer therapeutics against human(NF-κβ) using in silico approach of modelling,docking and protein dynamics[J]. Journal of Biomolecular Structure & Dyna-mics,37(15):3947-3967.
Wu S H,Dai Y C,Hattori T,Yu T W,Wang D M,Parmasto E,Chang H Y,Shih S Y. 2012. Species clarification for the medicinally valuable “Sanghuang” mushroom[J]. Botanical Studies,53:135-149.
Yang S,Bao H,Wang H,Li Q,2019.Anti-tumour effect and pharmacokinetics of an active ingredient isolated from Ino-notus hispidus[J]. Biological & Pharmaceutical Bulletin,42(1):10-17.
Zan L F,Qin J C,Zhang Y M,Yao Y H,Bao H Y,Li X,2011.Antioxidant hispidin derivatives from medicinal mushroom Inonotus hispidus[J]. Chemical and Pharmaceutical Bulletin,59(6):770-772.
Zhou L W,Josef V,Cony D,Assefa A,Stenlid J,Abate D,Wu S,Dai Y C. 2015. Global diversity and taxonomy of the Inonotus linteus complex(Hymenochaetales,Basidiomycota):Sanghuangporus gen. nov.,Tropicoporus excentrodendri and T. guanacastensis gen. et spp. nov.,and 17 new combinations[J].Fungal Diversity,77(1):335-347.
(責任编辑 陈 燕)

