替罗非班致急性重度血小板减少症2例
张强 吴彩凤 徐日新
1 临床资料
病例1 患者 男,60岁。因“突发胸痛1 h”于2014年8月6日就诊于苏北人民医院。入院1 h前患者突发胸痛,伴胸骨段灼烧感及左肩部疼痛,伴大汗,持续不缓解。既往有高血压病,冠心病,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)史。入院查体:血压140/100 mmHg(1 mmHg=0.133 kPa),神志清,双肺呼吸音清,未闻及啰音;心界无扩大,心率58次/分,律齐,各瓣膜听诊区未及杂音,周围血管征阴性;腹部无阳性体征,双下肢无水肿。入院心电图示:窦性心动过缓,Ⅲ、aVF导联异常Q波。心肌损伤标志物正常。初步诊断:非ST段抬高型心肌梗死,Killip心功能分级Ⅰ级,冠心病,PCI术后,高血压病2级(很高危)。血常规示:白细胞计数6.68×109/L、红细胞计数4.47×1012/L、血红蛋白148 g/L、血小板计数204×109/L,血糖5.81 mmol/L,三酰甘油1.93 mmol/L,总胆固醇5.78 mmol/L,高密度脂蛋白胆固醇0.71 mmol/L,低密度脂蛋白胆固醇4.25 mmol/L,凝血常规、肝肾功能正常。入院后给予负荷剂量阿司匹林300 mg、氯吡格雷300 mg,之后长期给予阿司匹林100 mg、氯吡格雷75 mg,每日1次双联抗血小板治疗,阿托伐他汀20 mg、每晚1次,单硝酸异山梨酯40 mg、每日1次,呋塞米20 mg、每日2次,螺内酯20 mg、每日2次。入院第2天,查肌钙蛋白I 1.0 ng/ml,肌酸激酶同工酶23.5 ng/ml,肌红蛋白78.1 ng/ml。8月7日经右侧桡动脉入径行冠状动脉造影示:左前降支近段闭塞,前向血流心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级0级;回旋支远段90%节段性狭窄;右冠状动脉近段完全闭塞,TIMI血流分级0级,左主干正常。后于右冠状动脉置入3.5 mm×33 mm支架(Firebird)一枚,前向TIMI血流分级Ⅲ级,尝试开通左前降支未成功。术中使用普通肝素10000 U。术后常规抗血小板治疗,阿司匹林100 mg、氯吡格雷75 mg,均每日1次,同时给予依诺肝素4000 U,每12 h 1次;术后替罗非班0.12 μg/(kg · min)持续泵入。术后12 h复查血常规示血小板计数减少至16×109/L,遂停用替罗非班及依诺肝素。患者未见出血,为预防支架内血栓形成,未停用抗血小板药物,继续原剂量服用阿司匹林、氯吡格雷。停用替罗非班8 d复查血小板计数恢复正常(表1)。

表1 病例1患者住院期间血常规主要指标变化
病例2 患者 男,69岁。因“突发剑突下疼痛10 h”于2018年12月31日就诊于苏北人民医院。患者晨起后无明显诱因下出现剑突下疼痛不适,持续时间约30 min后缓解,伴大汗、恶心呕吐。既往有高血压病、脑梗死病史,具体用药情况不详。查体:血压156/94 mmHg,神志清,双肺呼吸音粗,未闻及啰音;心界无扩大,心率65次/分,律齐,各瓣膜听诊区未及杂音,周围血管征阴性;腹部无阳性体征,双下肢无水肿。入院心电图示:窦性心律伴交界性逸搏心律,完全性房室分离,Ⅲ度房室传导阻滞,完全性右束支传导阻滞,急性下壁心肌梗死可能,T波改变。心肌损伤标志物示:肌钙蛋白Ⅰ14.23 ng/ml,肌酸激酶同工酶46.68 ng/ml,肌红蛋白378.70 ng/ml。初步诊断:急性下壁心肌梗死,Killip心功能分级Ⅰ级,冠心病,Ⅲ度房室传导阻滞,高血压病3级(很高危)。急诊查血常规示:白细胞计数8.45×109/L、红细胞计数4.92×1012/L、血红蛋白142g/L、血小板计数206×109/L,血糖14.49 mmol/L,三酰甘油2.32 mmol/L,总胆固醇4.06 mmol/L,高密度脂蛋白胆固醇0.65 mmol/L,低密度脂蛋白胆固醇2.56 mmol/L,凝血常规、肝肾功能正常。急诊予负荷剂量阿司匹林300 mg、替格瑞洛180 mg。遂行急诊冠状动脉造影示:左前降支近段80%狭窄,远端斑块,TIMI血流分级Ⅲ级;回旋支斑块;右冠状动脉近段60%狭窄伴血栓影,远段完全闭塞,TIMI血流分级0级,左主干正常。开通右冠状动脉,予球囊扩张后,造影见血管内血栓负荷重,以替罗非班0.75 mg冠状动脉内缓慢注射,继而以0.12 μg/(kg · min)静脉泵入维持,并在右冠状动脉置入3.0 mm×24 mm支架(EXCEL)一枚,前向TIMI血流分级Ⅲ级,拟择期处理左前降支。术中使用普通肝素11000 U,术后予阿司匹林100 mg、氯吡格雷75 mg,每日1次,双联抗血小板治疗,同时给予依诺肝素6000 U,每12 h 1次;继续予替罗非班0.12 μg/(kg · min)持续泵入。术后12 h复查血常规示血小板计数减少至2×109/L,遂立即停用替罗非班及所有抗凝抗血小板药物。停用替罗非班6 d复查血小板计数恢复正常,为预防支架内血栓形成,当血小板计数恢复至20×109/L时继续服用阿司匹林、氯吡格雷,并动态监测血小板(表2)。术后1周再次于左前降支行PCI,术中使用肝素抗凝,术后监测血小板计数正常,1周后顺利出院。
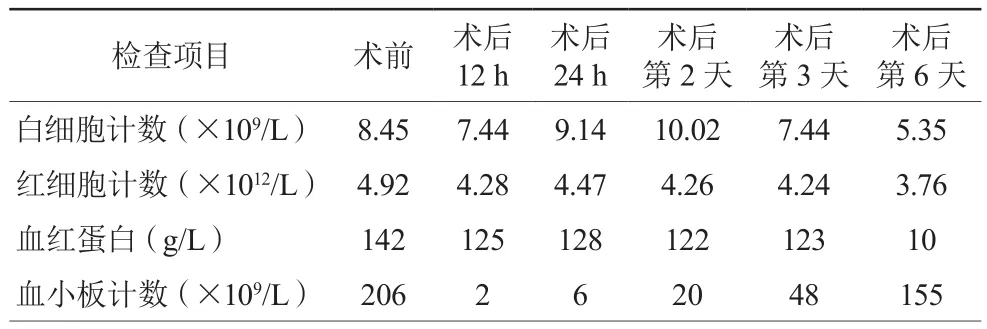
表2 病例2患者住院期间血常规主要指标变化
2 讨论
血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂(glycoprotein Ⅱb/Ⅲa receptor antagonist,GPRA)均可以引起血小板减少症。替罗非班为临床常用的一种GPRA。已有不少文献报道替罗非班诱导的血小板减少症(Tirofiban induced thrombocytopenia,TIT)[1-5]。血小板计数<150×109/L称血小板减少,根据减少程度,又分为轻度(100~149)×109/L;中度(50~99)×109/L;重度<50×109/L[1]。本文报告两例患者均引起重度血小板减少。血小板减少的原因需考虑以下几种情况:(1)假性血小板减少,指血液标本置于乙二胺四乙酸(EDTA)抗凝管中诱导血小板聚集从而导致人为的血小板计数减少[2],上述两例报道均经外周血涂片计数证实血小板成簇未见,散在少见,故排除此种可能。(2)肝素诱导的血小板减少症(heparin induced thrombocytopenia,HIT),其机制为抗血小板因子4(platelet factor 4,PF4)的自身抗体与肝素结合,从而激活血小板引起广泛的动静脉血栓形成及血小板减少[3]。HIT分为Ⅰ型与Ⅱ型,Ⅰ型多发生于应用肝素24~48 h后,且血小板下降轻微;Ⅱ型则于初次接触肝素4~14 d才会发生严重的血小板减少[4],同时HIT4Ts评分仅2分,HIT诊断不成立。(3)GPRA(替罗非班)诱导的免疫性血小板减少。
关于TIT的病理生理学机制目前知之甚少,多认为有以下两种原因:(1)血液中预先存在血小板表面抗体,GPRA可以诱导血小板表面血小板糖蛋白受体的构象发生变化,导致产生新的抗原决定簇,从而被在血浆中已经存在的抗体识别。如果患者血液中预先形成抗体和新的抗原决定簇产生交叉反应,血小板可以被免疫球蛋白包裹,而被从循环中清除。(2)血小板的再分布。替罗非班与血小板糖蛋白Ⅱb/Ⅲa 受体结合后导致血小板糖蛋白Ⅱb/Ⅲa受体空间构象改变,产生新的抗原决定簇,此抗原决定簇被肝识别,诱导肝摄取和从循环中清除血小板。血液中药物浓度减少,被肝摄取的血小板可重新回到循环中[5]。应用替罗非班最主要不良反应之一是血小板减少症,发生率在0.5%~5.6%;其中替罗非班所致的轻、重度血小板减少症发生率分别2.3%和0.3%,罕见极重度血小板减少症。多数研究将极重度血小板减少症定义为血小板<20×109/L[6]。血小板减少症发生的平均时间在24 h内,TIT缓解时间平均2.1(l~6)d。TIT可发生在初次用药的2 h内[6]。本文报告两例考虑系TIT。
近年来,有关TIT的病例时有报道,TIT发生率为1.0%~2.0%,重度TIT(血小板计数<50×109/L)发生率为0.1%~0.5%[7-8]。临床医师应特别关注TIT这一严重不良反应,建议在用药后的2 h、6 h、12 h和24 h内严密监测血小板计数,既可尽早发现,也不会漏诊。一旦发现血小板减少,立即停用所有抗血小板和抗凝药物,并动态监测血小板计数,同时注意观察有无临床出血情况。多数患者停药后血小板计数能短期恢复正常,若患者有危及生命的出血,如脑出血、肺出血或血性心包积液时,或血小板计数<1×109/L时,推荐输注血小板,必要时也可以采用血液透析或血浆置换。如果血小板计数已经降低而鉴别诊断一时不能明确,可以临时考虑使用比伐芦定直至确诊[9]。有报道发现,PCI术后,TIT患者使用血小板生成素(EPO)后出现支架内再狭窄形成[10],提示使用EPO血栓风险可能较输注血小板大,故应谨慎使用。

