体外膜肺氧合联合主动脉内球囊反搏在高危经皮冠状动脉介入治疗中的应用
高好考 陈根锐 程亮 夏陈海 谢伟炜 王琼 陶凌 李成祥
对于高龄、重度心力衰竭和(或)左心室射血分数(left ventricular ejection fraction,LVEF)降低和(或)合并症较多的冠心病患者,因其往往伴有复杂冠状动脉病变如多支血管病变或无保护左主干病变,由于围术期高死亡率和发病率,不适宜进行外科血管重建术。因此即使存在较高技术难度和手术风险,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)可能是此类患者唯一的治疗方法[1]。高危PCI(high risk PCI, HR-PCI)术中非常短期的心肌缺血也会导致低血压和心脏输出量下降进而导致冠状动脉低灌注、心力衰竭等,最终血流动力学崩溃。而在复杂冠状动脉病变PCI术临床实际情况下,为获得最佳病变结果,可能需要旋磨、长时间高压力扩张,因此目前HR-PCI术中经皮机械循环辅助设备(percutanous mechanical circualtory support devices,PMCSD)成为必备的治疗手段并逐渐开展[2-5]。
PMCSD包括主动脉内球囊反搏(intra-aortic balloon counterpulsation,IABP),左心室辅助装置(percutaneous ventricular assist device,pVAD,如TandemHeart 和 Impella LP 2.5)和体外膜肺氧合(extracorporeal membrane oxygenation,ECMO),其作用是保证重要器官灌注,降低心脏充盈压(充血和肺水肿)、左心室容量、室壁压力和氧耗,增加心输出量和心脏指数[4],因此能在HR-PCI术中预防血流动力学紊乱。目前国内pVAD Impella和Tandem Heart系统应用较少。IABP是最常用于心肌梗死后或PCI术中出现并发症时的血流动力学支持装置[6]。最近一项Meta分析证明HR-PCI术应用IABP能改善患者长期存活率[7]。然而,IABP只是轻-中度增加心输出量和冠状动脉血流,依赖于患者的左心室功能,而对完全性血流动力学崩溃的患者无效。ECMO可降低死亡率,是一种中短期心肺辅助技术。当患者的心功能严重受损时,血泵可以代替心脏输血功能,维持血液循环[8-9]。但ECMO逆向无搏动血流可能会增加心脏后负荷和心肌耗氧,因此IABP联合股静脉-股动脉(veno-arteial,V-A)ECMO在原理上可以起到协同互补的作用[10-11]。本研究总结10例患者在ECMO联合IABP循环支持下行HR-PCI术临床资料,探讨其并发症预防及相关治疗经验。
1 对象与方法
1.1 研究对象
收集2018年5-8月空军军医大学第一附属医院心血管内科ECMO联合IABP循环支持下行HR-PCI术的10例患者。所有患者均给予常规冠心病药物治疗特别是双联抗血小板治疗(阿司匹林和氯吡格雷/替格瑞洛),如患者伴有心力衰竭给予地高辛和利尿剂等。HR-PCI患者定义为存在左心室功能受损(LVEF<35%)及广泛多支病变或严重左主干狭窄或目标血管存在侧支循环来代偿另一支闭塞血管,因而供应40%以上的心肌供血。10例患者术前冠状动脉造影均示冠状动脉左主干和(或)三支病变,狭窄达到 85%以上,甚至完全闭塞。超声心动图示左心室不同部位、范围运动减弱,左心室增大,LVEF降低;频繁发作心绞痛,需药物干预或机械辅助,及合并高血压病或糖尿病和(或)肾功能不全等其他脏器疾病。EuroSCORE评分5分以上,行冠状动脉旁路移植术(coronary artery bypass grafting,CABG)风险极高。
1.2 研究方法
1.2.1 IABP的应用 所有患者均选择经股动脉入径置入IABP球囊,以Seldinger法经皮穿刺股动脉并置入导丝,根据患者身高选取合适球囊(30~40 ml),并沿导丝送至降主动脉近端,球囊体外端与皮肤缝合固定,并连接IABP机;应用肝素盐水(普通肝素4000 U+生理盐水500 ml) 定时冲洗压力传感导管;采用心电触发模式,反搏比率为1∶1或1∶2。PCI术后继续辅助,当患者循环稳定,心功能恢复,血管活性药物较小时则予撤除 IABP。IABP 撤除标准:(1) 平均动脉压>70 mmHg(1 mmHg=0.133 kPa),且无需应用升压药物;(2) 尿量>1 ml · kg/h ;(3) 无心力衰竭、恶性心律失常;(4) 血流动力学稳定,周围循环良好;(5) 降低反搏比率至 1∶3,上述指标维持稳定。IABP应用禁忌证:(1) 重度主动脉瓣关闭不全;(2) 主动脉夹层、主动脉窦瘤破裂及周围血管病变;(3) 凝血功能障碍、脑出血;(4) 不可逆脑损伤及晚期恶性肿瘤。
1.2.2 ECMO建立方法及管理 (1) 采用Medtronic-560型离心机,美敦力公司定制肝素涂层一体化套装管路(含离心泵及膜式氧合器),及肝素涂层股动、静脉插管,空氧混合器(塞克瑞斯)等。(2) ECMO插管:所有患者均在清醒状态下采用局部麻醉下切开暴露右股动、静脉,并在直视下经股动、静脉入径插入15~17 Fr(6 cm)和19~21 Fr(7.5 cm)肝素涂层插管 (美敦力公司),建立V-A ECMO。(3) ECMO管理:患者均在清醒状态下行ECMO辅助,辅助采用低流量20~40 ml/(kg · min);通过IABP置管测压,维持平均动脉压(mean arterial pressure,MAP)>70 mmHg,术中进行冠状动脉操作时可能出现一过性低血压,如MAP>60 mmHg且时间<1 min不予处理,否则应加大辅助流量以维持足够灌注。空氧混合器供氧浓度50%~60%,维持膜肺后氧分压150~200 mmHg,膜肺通气血流比 0.6∶1,维持膜肺后二氧化碳分压35~45 mmHg,患者自身经鼻导管吸氧,氧流量2.0 L/min。辅助期间维持体温36.5℃~37.3℃。中心静脉测压监测患者容量负荷,压力维持4~10 mmHg。每小时测定活化凝血时间(activated coagulation time,ACT),PCI术中ACT维持在350~450 s。ECMO管道应用肝素生理盐水进行预充(约700 ml),术中为维持ECMO的灌注量需补充晶体液和胶体液(血浆或代血浆),可能会稀释血液,术中血气检查维持血细胞比容(hematocrit,HCT)≥30%,根据结果补充红细胞。撤除ECMO时,管道中约700 ml血液不能输回体内,可能会引起患者少量失血,血色素下降,术后根据血常规补充红细胞和血浆,维持血红蛋白≥90 g/L。 (4) ECMO撤除:术毕冠状动脉造影示PCI术成功,病变血管血流通畅,心功能良好[多巴胺≤5 μg/(kg · min),收缩压≥90 mmHg],可逐步减少ECMO辅助流量至1.0 L/min以下观察5~10 min后停机,患者血流动力学稳定,无不适,可撤除ECMO,继续行IABP辅助。
1.3 观察指标
(1) 术中和术后住院期间主要不良心血管事件(major adverse cardiovascular events,MACE):急性ST段抬高型心肌梗死、急性支架内血栓形成、急诊血运重建、恶性心律失常(室性心动过速/心室颤动)、急性左心衰竭、心脏压塞、致命性出血事件、卒中、穿刺部位血肿、假性动脉瘤、心脏性猝死、对比剂肾病;(2) ECMO相关机械并发症、下肢缺血、伤口感染。
1.4 统计学分析
所有数据采用SPSS 13.0进行统计学分析。符合正态分布的计量资料用(-x±s)表示,组间比较采用配对t检验;不符合正态分布的计量资料以中位数(四分位数间距)表示。计数资料用例(比)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床基线资料情况
10例患者均属于HR-PCI人群,其中男性8例,女性2例,平均年龄51~84(70.3±11.1)岁,6例(6/10)合并高血压病,2例(2/10)合并糖尿病需胰岛素治疗,1例(1/10)合并慢性肾功能不全需透析。8例(8/10)入院诊断为不稳定型心绞痛,2例(2/10)诊断为陈旧性心肌梗死;4例(4/10)患者纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅲ/Ⅳ级,1例(1/10)诊断为急性左心衰竭,3例(3/10)患者既往有PCI术史。10例患者EuroSCORE平均评分4~13(7.0±2.7)分,均为高危患者,行CABG风险极高(表1)。
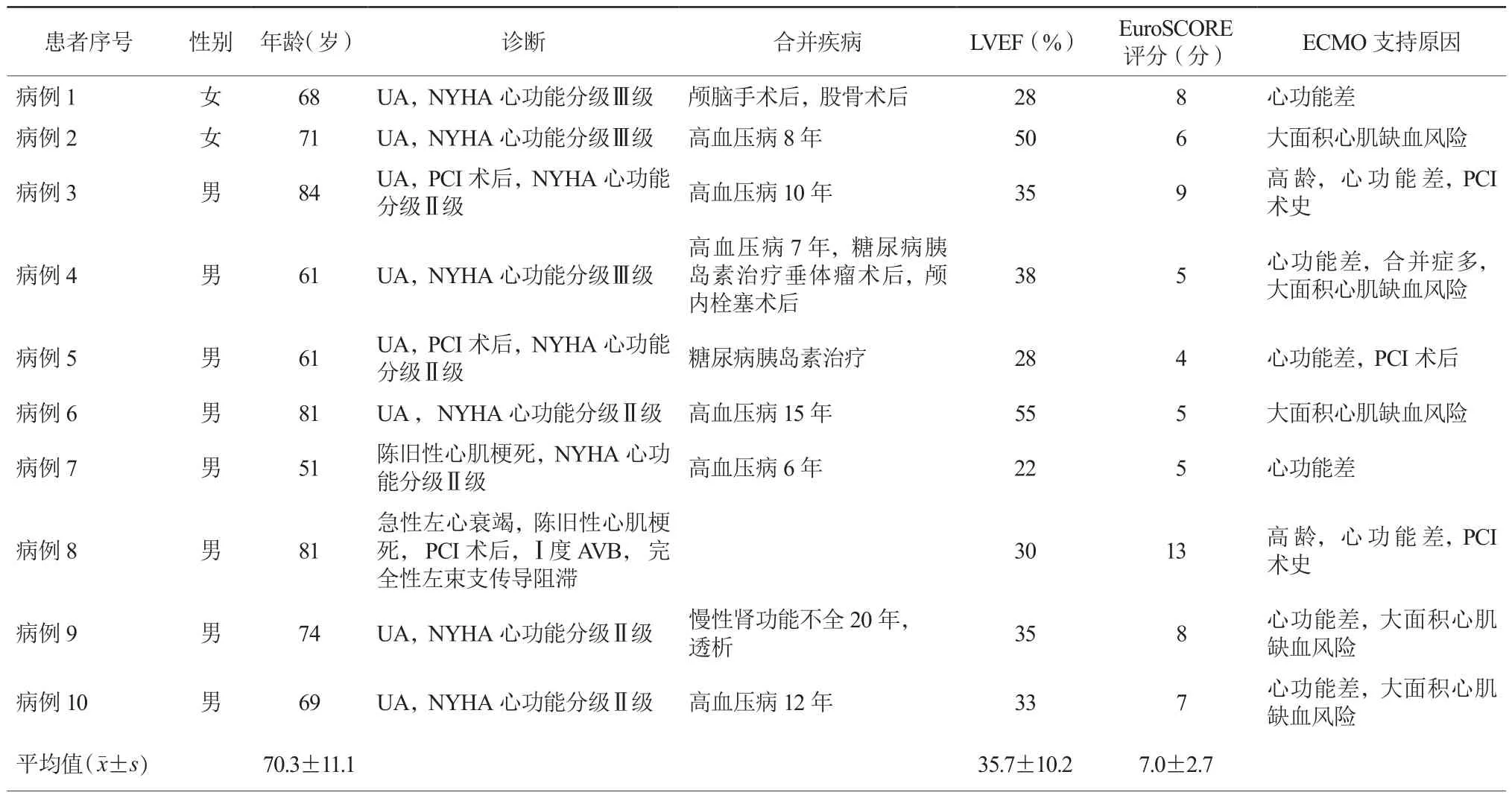
表1 10例患者临床基线资料情况
2.2 ECMO联合IABP循环支持下行PCI术
10例患者均为严重三支病变:左主干病变7例(7/10),其中合并右冠状动脉(right coronary artery,RCA)慢性完全闭塞(chronic total occlusio,CTO)病变5例,左前降支(left anterior descending,LAD)CTO病变2例;其余3例(3/10)中2例为RCA和LAD近、中段CTO病变,1例为RCA CTO病变合并LAD/左回旋支(left circumflex artery,LCX)严重病变。在ECMO支持下7例左主干病变患者中先处理左主干病变6例,1例处理了RCA CTO和LAD重度狭窄;其余3例中2例RCA和LAD近、中段CTO病变均先处理了LAD CTO病变,另1例RCA CTO病变合并LAD/LCX严重病变患者先进行了RCA CTO处理(表2)。10例患者均应用ECMO支持成功完成PCI术,术后在手术室顺利脱离ECMO辅助。PCI处理靶血管数1~2支,平均冠状动脉血管病变长度40~110(77.0±23.8)mm,置入支架2~5(3.3±0.8)枚,平均PCI术总时间1.5~3(2.2±0.5)h,平均ECMO总运行时间2~3.5(3.4±0.7)h,平均对比剂总量200~400(286.0±70.0)ml。IABP辅助时间1~3(1.6±0.7)d,住院时间6~12(8.2±1.9)d,均康复出院。

表2 10例患者HR-PCI手术情况
2.3 血流动力学改变情况
10例患者术前或术中安装IABP后再行ECMO安装,均采用局部麻醉,股、动静脉切开后穿刺术,患者面罩或鼻导管吸氧。术中ECMO管道预充采用约700 ml含有肝素的生理盐水,因此术中血气监测血红蛋白水平,如HCT<30%,则需要输入红细胞。MAP低于65 mmHg,均给予多巴胺和(或)去甲肾上腺素维持并提高ECMO流量。ECMO开始运转灌注流量为1.3~1.5(1.45±0.07)L/min,手术操作如切割球囊长时间多次扩张引起冠状动脉缺血血压下降,MAP<60 mmHg时提高ECMO流量维持血流动力学稳定。ECMO术前收缩压为 (118.3±17.9)mmHg,术后为(110.0±15.4)mmHg;舒张压术前为(67.9±10.4)mmHg,术后为(63.0±11.2)mmHg;术前和术后收缩压、舒张压及心率比较,差异均无统计学意义(均P>0.05,表3)。
表3 10例患者血流动力学情况(±s)
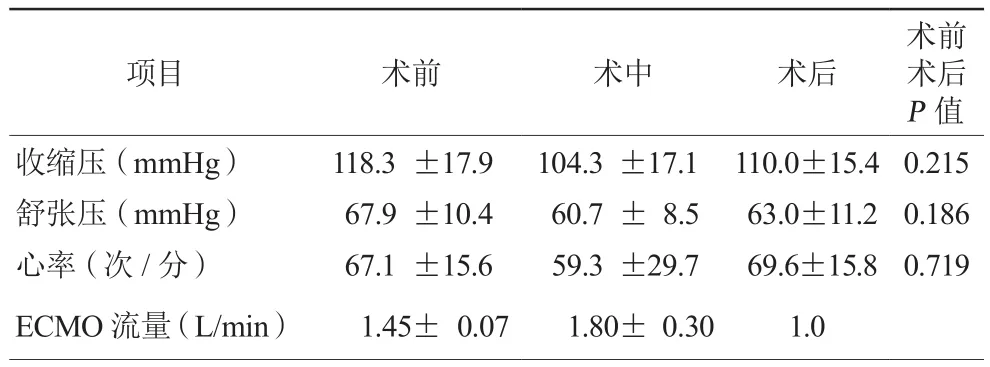
表3 10例患者血流动力学情况(±s)
注:ECMO,体外膜肺氧合;1 mmHg=0.133 kPa
项目 术前 术中 术后术前术后P值收缩压(mmHg) 118.3 ±17.9 104.3 ±17.1 110.0±15.4 0.215舒张压(mmHg) 67.9 ±10.4 60.7 ± 8.5 63.0±11.2 0.186心率(次 /分) 67.1 ±15.6 59.3 ±29.7 69.6±15.8 0.719 ECMO流量(L/min) 1.45± 0.07 1.80± 0.30 1.0
2.4 术后并发症情况
10例患者中1例PCI术操作中出现心搏骤停,患者意识清楚,未实施心肺复苏,给予肾上腺素并立即提高ECMO灌注流量3 L/min,维持收缩压70~90 mmHg,直到血流动力学稳定;2例患者术中可见IABP穿刺部位血肿可能继发于长时间静脉肝素应用;术后1例患者发生尖端性扭转室性心动过速和心室颤动,除颤治疗并给予补钾和硫酸镁后未再发作。术中发生IABP穿刺部位血肿的2例患者回病房后拔除IABP进行加压包扎,其中1例患者发生假性动脉瘤,给予超声心动图引导下凝血酶治疗,加压后血肿消退恢复正常。无ECMO管道机械性问题及下肢缺血、感染等并发症发生。
3 讨论
目前心血管介入医师面对越来越多复杂病变合并临床严重疾病的冠心病患者,手术目的是改善心功能,提高存活率和生活质量,因此血流动力学支持设备迅速发展,辅助手术成功实施[12]。HR-PCI术时“预防性装置”血流动力学支持设备主要目的是降低心肌缺血和血流动力学崩溃风险。三类冠心病患者循环支持下行HR-PCI术将从中获益:(1) 左主干或多支血管病变行HR-PCI患者;(2) 急性心肌梗死伴有心原性休克;(3) 由于急性心肌梗死引起的失代偿心力衰竭或缺血进展引起的慢性严重心力衰竭[13-15]。目前经皮血流动力学支持设备有三种装置类型:IABP、Impella 系统及Tandem Heart代表的pVAD、ECMO[16]。IABP、Impella 系统和Tandem Heart用于危重患者的PCI 辅助临床研究较多。
IABP是最常用于心肌梗死后或PCI术中出现并发症时的血流动力学支持装置。但IABP仅能提高心输出量10%~20%,约为 0.5 L/(min · m2),不能完全代偿缺血引起的严重心输出量下降[6-7]。因此对HR-PCI患者不是较好的选择,其疗效及应用时机同样存在分歧,但由于安置方便,价钱相对最低,并发症较少,故其仍是目前临床应用最广泛的机械循环辅助装置。
HR-PCI时具有潜在选择的循环辅助装置是Impella 2.5系统。美国食品药品监督管理局已经批准Impella LP 2.5系统用于择期HR-PCI术中的血流动力学支持。Impella系统对循环血流动力学改善作用优于IABP[17-18]。PROTECT Ⅱ研究[19]是一项前瞻性、多中心、随机对照试验,在非急诊HR-PCI患者中对比研究Impella 2.5系统和IABP的安全性和有效性,共入选了452例患者,结果发现,相比IABP,Impella 2.5系统降低了心脏及血管病风险的33%,如死亡、心肌梗死、卒中、再血管化治疗和30 d内肾功能不全,同时90 d研究结果发现,Impella 2.5组较IABP支持组患者主要不良心脑血管事件有明显下降趋势(40.6%比49.3%,P=0.066)。Tandem Heart系统也可提供较高流量、MAP及心输出量,在有经验的中心HR-PCI术中应用是可行[20-21]。但其穿刺导管直径较大,需要采用穿房间隔技术,技术复杂性限制了其临床应用。目前仍需要前瞻性、多中心随机试验来明确两种pVAD在HR-PCI中提供循环支持的安全性和有效性。
1989年Taub等[22]报道了ECMO在HR-PCI患者中使用的临床观察性研究,共有7例患者接受了ECMO辅助,其中有1例死亡。其他临床小样本短期和长期研究结果显示,在HR-PCI术时行ECMO支持临床能够获益[8,23-24]。同时短期使用ECMO与pVAD比较,在住院生存率(49.2%比50.0%)、脱机成功率(19.7%比33.3%)、下肢并发症发生率(13.1%比22.2%)等方面比较,差异均无统计学意义(均P>0.05)[25]。因此,ECMO在辅助高危患者完成PCI术是安全可靠的,可能与 ECMO辅助时间通常较短有关。《中国经皮冠状动脉介入治疗指南(2016)》[26]建议:ECMO等pVAD可降低危重复杂患者PCI病死率,有条件时可选用。
既往研究表明,根据工作原理,ECMO和IABP具有协调和互补作用[10-11]。ECMO和IABP联合应用,可以降低后负荷,改善血流动力学状况,同时也能提供符合生理的搏动性血流。因此本研究中10例患者均为严重三支病变:其中左主干病变7例,7例中合并RCA CTO病变5例,LAD CTO病变2例;剩余3例中2例为RCA和LAD近、中段CTO病变,1例为RCA CTO病变合并LAD/LCX严重病变,因此均属HR-PCI术,术中发生血流动力学崩溃风险较高,需要循环支持。本研究中10例患者均在ECMO和IABP支持下成功行PCI术,术后ECMO均成功脱机。1例术中出现心搏骤停,ECMO高流量循环支持血流动力学,直到其恢复正常;2例术中继发于静脉肝素应用发生IABP穿刺部位血肿,回病房后拔除IABP进行加压包扎,其中1例患者发生假性动脉瘤。1例患者术后发生尖端性扭转室性心动过速和心室颤动,除颤治疗并给予补钾和硫酸镁后未再发作。本研究中ECMO管道预充应用生理盐水700 ml,撤机时管道的血液约700 ml未引流患者体内,因此术中和术后可能会引起稀释性和失血性血色素下降,术中和术后根据情况补充红细胞。所有患者无ECMO管道机械性并发症及下肢缺血、感染等并发症发生,并均正常出院。
通过10例ECMO联合IABP支持下行HR-PCI初步经验,我们制定了具体操作流程以降低并发症发生率:(1)患者术前留置深静脉置管,术前维持中心静脉压4~10 mmHg,术中监测利于液体量补充,避免术中ECMO流量低补充较多胶体或血浆,增加急性左心衰竭风险;(2)术中留置导尿管,监测尿量;(3)穿刺左侧股动脉置入IABP,术中注意IABP穿刺部位有无血肿;(4)术中监测血气结果,维持酸碱平衡和HCT≥30%;(5)术中监测ACT,维持PCI术中为350~450 s;(6)术后注意复查血常规、肾功能和心肌酶。
本研究存在的局限性有:(1)研究人群较少,高度选择患者,因而不能排除选择偏倚;(2)缺乏对照组,不能得出有意义性结论;(3)本研究只是单中心观察ECMO支持下HR-PCI术的可行性,下一步本中心将继续纳入较多研究患者,观察其长期临床效果。综上所述,对于高危冠心病患者,ECMO循环辅助下行PCI的方案提供了一种新思路,值得推广,但须严格把握适应证,避免无意义的 ECMO治疗增加患者负担。

