云南金花茶SSR-PCR反应体系的建立与优化
李显煌 ,高丽云 ,王 娟 ,张贵良 ,唐军荣 ,叶 鹏 ,雷 瀚 ,辛培尧
(1.西南林业大学 a.西南山地森林资源保育与利用教育部重点实验室;b.云南省高校林木遗传改良与繁育重点实验室;c.国家林业和草原局西南地区生物多样性保育重点实验室,云南 昆明 650224;2.毕节市林业科学研究所,贵州 毕节 551700;3.云南省大围山国家级自然保护区河口管理分局,云南 河口 661399)
云南金花茶Camellia fascicularisH.T.Chang是山茶科Theaceae山茶属Camellia金花茶组Sect.Chrysantha的一个种,又称簇蕊金花茶、云南显脉金花茶,是云南特有的极小种群植物[1]。云南金花茶花大,且呈金黄色,形态美观,具有极高的观赏价值,是培育茶花优良品种的重要种质资源,且有较好的食用和药用价值[2]。张贵良等[3]人调查研究显示,云南金花茶仅分布于云南省个旧、河口、马关 3县市,海拔 360~1 000 m 的沟谷或山坡热带雨林中。野生状态下的云南金花茶已经为数不多,而且这些野生资源的数量正在逐年锐减。现已被列入云南省珍稀树种。同时也是云南省2010—2015年极小种群物种拯救保护紧急行动计划中涉及的物种之一。
SSR(Simple sequence repeat)简单重复序列,又称为微卫星序列,是广泛分布于真核生物基因组中的以几个核苷酸(多为 2~4个)为单位串联重复组成的 DNA 序列。该技术是基于 PCR 技术的一种分子标记技术[4],被广泛应用于植物遗传多样性检测、遗传图谱构建、基因定位以及种质鉴定等[5-10]研究领域 。因为不同的植物材料对SSR反应体系的要求有所不同,有时这种差异表现非常明显。因此,在利用SSR分子标记对不同种植物进行SSR遗传研究时,必须先建立该种植物的SSR-PCR反应体系。目前,所见云南金花茶的相关报道,多为资源调查[3]、无性繁殖[11]以及茎、叶和花的矿质元素分析[12-13]等,而在分子水平方面研究相对缺乏。本研究以云南金花茶嫩叶为实验材料,利用不同的3种方法提取其DNA,继而对影响 SSR-PCR 体系的 Mg2+、 Taq DNA聚合酶、dNTP、引物及模板 DNA 这 5个因素进行正交实验,最终对其 PCR产物进行检测,以期获得最佳云南金茶花SSR-PCR体系。云南金茶花SSR-PCR体系的建立与优化,可为研究云南金花茶的遗传多样性、阐明云南金花茶种群内的遗传变异状况及其遗传改良提供理论依据,同时也可为云南金花茶的濒危机制研究及其保护奠定基础。
1 材料与方法
1.1 材 料
实验材料采集于云南省个旧市、河口县及马关县云南大围山国家级自然保护区共 6份具有代表性的云南金花茶个体(表1),用于基因组DNA的提取。采集的材料均为无病虫害、新鲜的幼嫩叶片,分别按单株放入自封袋,并用变色硅胶迅速干燥固定,分别做好标记和编号,备用。

表1 云南金花茶的采样信息Table1 Sampling information of Camellia fascicularis
1.2 方 法
1.2.1 最佳DNA提取方法的筛选
1.2.1.1 DNA提取方法
实验采用 Ezup 柱式植物基因组 DNA 抽提试剂盒法(上海生工生物工程有限公司,以下简称试剂盒法)、SDS 法[14-15]和 CTAB法[14-15]提取云南金花茶DNA,进行云南金花茶 DNA的提取。比较3种方法的最终提取效果,并筛选出最佳的提取方法。
1.2.1.2 DNA 样品的检测方法
对提取的全部 DNA 样品,分别用 0.8%琼脂糖凝胶电泳和超微量紫外分光光度计检测其质量和浓度。
1.2.2 引物初筛
以云南金花茶叶片DNA为模板,利用西南林业大学林木遗传育种实验室经转录组测序并设计、合成的4对云南金花茶 EST-SSR引物进行PCR 扩增(表2),将扩增产物在1%琼脂糖凝胶上进行电泳, 扩增产物经凝胶成像系统检测和拍照相,初筛出条带清晰、单一的引物对用于云南金花茶SSR-PCR体系建立。
1.2.3 PCR反应体系及程序
以提取得到的云南金花茶 DNA 为模板,利用1.2.2中所筛选引物,针对影响SSR-PCR 反应的 5个因素:引物(A)、Mg2+(B)、dNTP(C)、Taq DNA 聚合酶(D)及模板 DNA(E)进行 L16(45)正交实验[16]。每因素设4 个水平(表3),2 个重复,共 32 个处理,按表4添加不同体积试剂于 PCR 管中并进行标记,除此之外每管还应加入 2 μL Taq Buffer 缓冲液[17],用 ddH2O 补足反应体系总体积到20 μL。PCR 扩增反应程序为:在95 ℃预变性5 min;94 ℃变性45 s,55~60 ℃(根据引物Tm而异)退火45 s,72 ℃延伸1 min,40个循环;然后72 ℃最终延伸10 min,保存于4 ℃。

表2 用于PCR扩增的云南金花茶SSR引物序列Table2 SSR primers of Camellia fascicularis used for PCR amplification
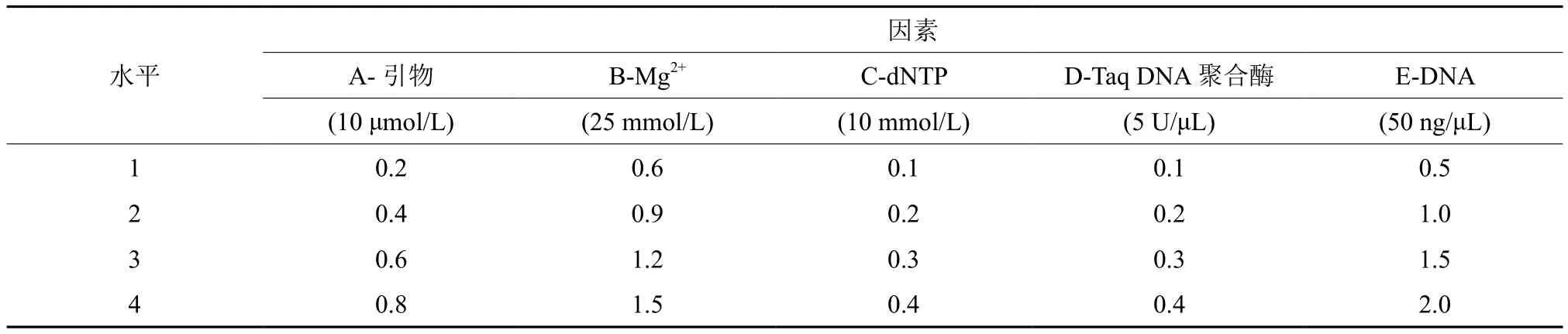
表3 正交实验因素与水平Table3 Factors and levels of orthogonal experiment

表4 SSR-PCR 正交实验 L16(45)试剂及其用量Table4 Reagents and its dosage used for SSR-PCR orthogonal experiment L16(45)
1.2.4 PCR 扩增产物检测
PCR扩增完成的产物用1%琼脂糖凝胶电泳检测[15],图片用相机拍照保存。
1.2.5 数据的整理与分析
参照何正文等[18]的统计方法,根据扩增条带明亮度,背景清晰程度及是否有特异性条带等条件对2次重复的正交实验结果进行独立打分,最佳处理计为 16分,最差的处理计为1分,分为 1~16 个等级。根据 2 次打分的结果计算每个因素在同一水平下的实验值之和Ki及每一个因素同一水平下的平均值ki,并计算出每一因素不同水平下的极差R,极差R的大小反映出 5 个因素对 SSR-PCR 反应体系的影响程度,在假设不考虑交互作用的情况下,R值越大,则证明该因素对反应的影响越显著,反之,则影响较小;ki值越大则表明反应体系越好。2次重复打分结果均利用SPSS19.0 软件进行多因素方差分析。
1.2.6 PCR反应体系通用性的验证
选取西南林业大学林木遗传育种实验室经转录组测序并设计、合成的6对SSR引物(表5)对云南金花茶DNA进行PCR扩增,用来验证反应体系的通用性。

表5 云南金花茶SSR引物信息Table5 Information of SSR primers for Camellia fascicularis
2 结果与分析
2.1 DNA 提取结果
2.1.1 3种方法提取云南金花茶 DNA 浓度检测结果
3种方法提取的云南金花茶 DNA 浓度及纯净度经超微量紫外分光光度计检测后进行比较。其中试剂盒法提取的 DNA 浓度在 89.3~626.9 ng/μL,A260/A280在 1.80~2.13,A260/A230>2.0,DNA条带清晰较完整、无降解现象,可以用于后续实验;
SDS 法提取的 DNA 浓度在 87.0 ~ 238.0 ng/μL,A260/A280在 1.95~2.12 之间,A260/A230>2.0,说明得到的DNA较纯净,可用于后续实验;
CTAB 法提取的DNA 浓度在323.8~809.1 ng/μL,A260/A280在 2.01 ~ 2.21,A260/A230<2.0, 表明存在蛋白质或者酚类物质的影响,不能用于实验。
2.1.2 琼脂糖凝胶电泳检测结果
采用3种方法提取云南金花茶DNA,并对其提取效果利用琼脂糖凝胶电泳进行检测,结果如图1 所示,试剂盒法提取得到的目的条带明亮,清晰,无明显尾带; SDS 法得到的目的条带明亮但不整齐,无尾带;CTAB 法得到的目的条带明亮度一般,不清晰,有明显拖尾现象。因此,试剂盒法提取的云南金花茶DNA效果最好。

图1 3种方法提取云南金花茶 DNA 琼脂凝胶电泳结果Fig.1 Results of agarose gel electrophoresis for Camellia fascicularis DNA extracted by three methods
2.2 引物初筛结果
以试剂盒法提取的 DNA为模板,对 CJ1、CJ2、CJ3、CJ4 这 4 对引物进行初筛, 经 1%琼脂糖凝胶电泳检测,其结果如图2所示。
由图2可以看出,4对引物中,仅CJ3(F:5′-CACCACCACTCACAAGGGAG-3′,R:5′-GCTTTCCGAGGAGGGTTTGA-3′) 引物能得到清晰明亮条带,因此选该对引物进行云南金花茶SSR-PCR 体系优化及建立。
2.3 PCR 正交结果分析
2.3.1 PCR 正交实验直观分析

图2 云南金花茶 EST-SSR 引物初筛结果Fig.2 Preliminary screening results of EST-SSR primers in Camellia fascicularis

图3 云南金花茶 SSR-PCR 正交实验电泳结果(引物 CJ3)Fig.3 Results of agarose gel electrophoresis of SSR-PCR for Camellia fascicularis (Primer CJ3)
根据正交实验L16(45)进行 PCR 反应,其结果如图3所示,不同用量的 Mg2+、Taq DNA聚合酶、dNTP、引物和模板 DNA 组成的体系都会导致PCR 扩增效果出现明显差异。在 16 个处理中,处理 13扩增条带较弱,其他各处理均扩增出不同亮度的条带,处理 8、10、12、16 效果较好,条带清晰,明亮,无明显弥散现象。对 SSR-PCR正交实验 16 个处理进行打分,分别为:3、3、5、9、3、7、11、16、3、13、10、14、1、12、4、16;3、4、8、9、3、7、10、16、3、13、11、14、1、12、5、15。 由 表6可知,各因素的主次顺序为:RB>RA>RD>RC>RE,即 5 个因素对云南金花茶 SSR-PCR反应体系的影响由大到小依次为:Mg2+、引物、Taq DNA 聚合酶、dNTP、模 板 DNA。A 因素 4 个水平对云南金花茶SSR-PCR反应体系的影响主次顺序为:A3>A2>A4>A1, 即引物用量在 0.6 μL时扩增效果最好;B 因素 4 个水平对云南金花茶SSR-PCR 反应体系的影响主次顺序为:B4>B2>B3> B1,即 Mg2+用量在 1.5 μL 时扩增效果最好;C因素 4个水平云南金花茶SSR-PCR 反应体系的影响主次顺序为:C3>C1>C4>C2,即dNTP量在0.3 μL 时扩增效果最好;D 因素 4 个水平对云南金花茶 SSR-PCR 反应体系的影响主次顺序为:D1>D3>D2>D4,即 Taq DNA 聚合酶用量在0.1 μL 时扩增效果最好;E 因素 4 个水平对云南金花茶 SSR-PCR 反应体系的影响主次顺序为:E1>E4> E2> E3,即 DNA 用量在 0.5 μL 时扩增效果最好。kB4值最大为 13.625,所以该值对应的反应体系最好,该值对应的体系为处理 4、8、12、16组成的体系。
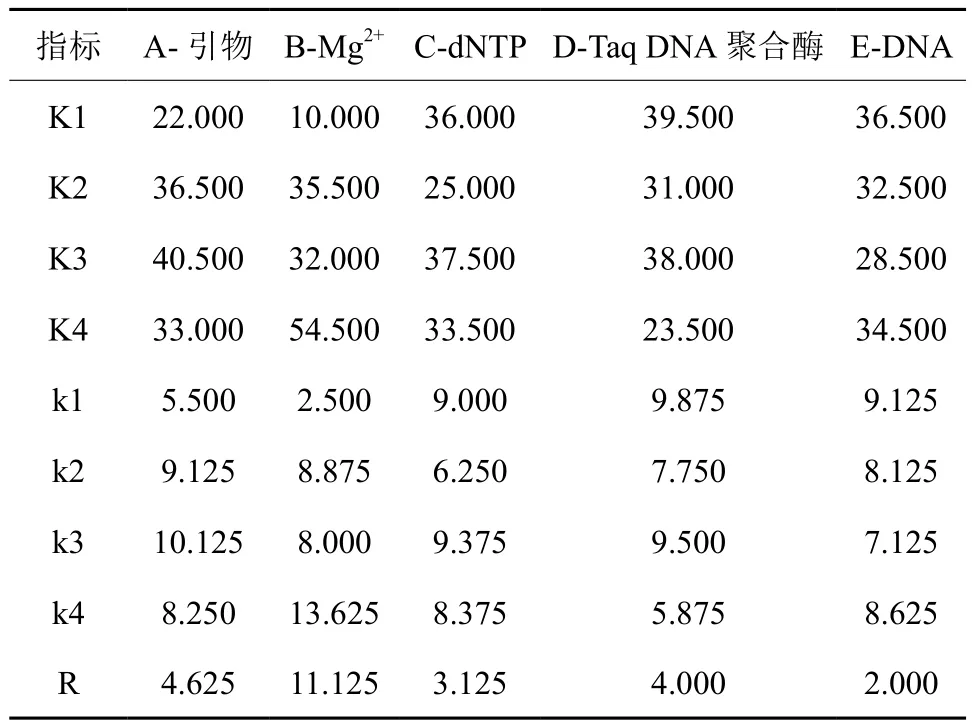
表6 正交实验直观分析结果Table6 Intuitive analysis results of orthogonal experiment
2.3.2 PCR 正交实验方差分析结果
根据方差分析表(表7)可知不同用量的引物、Mg2+、dNTP、Taq DNA 聚合酶和模板DNA对云南金花茶 SSR-PCR 反应体系的影响均达极显著水平。用方差分析中P值的大小判断各因素对PCR扩增反应影响的显著性。结果表明引物、Mg2+、Taq DNA聚合酶、模板DNA和dNTP的P值均小于0.01,说明各因素不同水平间的差异极其显著,因此需要对每个因素的不同水平进行多重比较分析。因为分析结果中的P值均小于0.01,所以由方差分析中F值的大小判断各因素对反应效果的影响程度。由正交实验方差分析表(表7)可以分析出:FB>FA>FD>FC>FE,其中Mg2+的F值最大,说明Mg2+对PCR反应的影响程度最大;模板DNA的F值最小,影响程度也最小。各因素对反应效果的影响程度依次为:Mg2+>引物>Taq DNA聚合酶>dNTP>模板DNA,这一结果与直观分析结果一致。
2.3.3 各因素不同水平间比较
方差分析结果显示各因素的不同水平间均达到极显著差异,因此需进行多重比较。由表8可得,引物在水平 2(0.4 μL)时其分值大于其他3个水平,且与其他3个水平存在显著差异,说明水平2(0.4 μL)是引物的最佳用量。Mg2+用量在水平 4(1.5 μL)时其分值大于其他3个水平,且与其他3个水平差异显著,说明Mg2+的用量在 1.5 μL时评分结果最高。dNTP 用量在水平 3(0.3 μL)和水平 1(0.1 μL)的分值大于水平4(0.4 μL)和水平 2(0.2 μL),且水平1和水平3差异不显著,说明dNTP在水平1和水平3的用量均适用。Taq DNA 聚合酶用量在水平 1(0.1 μL)和2(0.2 μL)时分值显著大于水平 3(0.3 μL)和水平 4(0.4 μL),且前两者间差异不显著,说明Taq DNA 聚合酶的用量在 0.1 μL和0.2 μL时均可获得较佳的试验效果。DNA 用量在水平 1(0.5 μL)和 4(2.0 μL)时,其分值大于水平 2(1.0 μL)和水平 3(1.5 μL),而水平4与1之间不存在显著差异,说明DNA的用量在0.5 μL和2.0 μL时试验效果均佳。

表7 云南金花茶 SSR-PCR 正交实验方差分析†Table7 Variance analysis of SSR-PCR orthogonal experiment for Camellia fascicularis
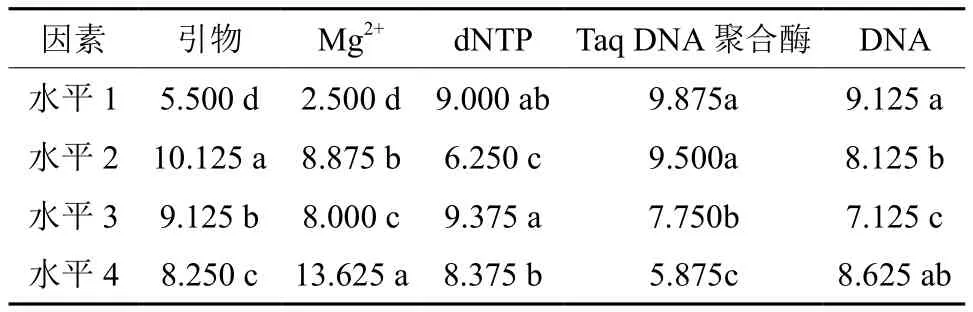
表8 各因素不同水平间多重比较结果†Table8 Multiple comparison results between different levels of each factor
2.4 云南金花茶SSR-PCR反应体系通用性的验证
根据正交实验,对 PCR反应体系中的引物、Mg2+、dNTP、Taq DNA 聚合酶及模板 DNA用量进行分析,获得稳定、效果佳的云南金花茶SSRPCR 反 应 体 系 为:2.0 μL Taq Buffer、1.5 μL 的Mg2+(25 mmol/L)、0.3 μL 的 dNTP(10 mmol/L)、0.2 μL 的 Taq DNA 聚合酶(5 U/μL)、前后引物各 0.4 μL(10 μmol/L)、0.5 μL 的模板DNA(50 ng/μL)、14.7 μL 的 ddH2O。采用上述建立的SSR扩增体系对6对SSR引物进行PCR扩增,进行反应体系通用性的验证实验。结果表明(图4):引物CJ5、CJ6、CJ8扩增出明显的目的条带,CJ8出现条带弥散;CJ9能扩增出目的条带,但条带较弱;CJ7、CJ10扩增的目的条带不明显。通过验证实验表明已建立的云南金花茶SSR-PCR体系具有一定的通用性,能扩增出大多数SSR引物的目的条带。

图4 6对SSR引物的PCR扩增电泳结果Fig.4 Results of agarose gel electrophoresis of 6 paires SSR primers’ PCR products
3 讨论与结论
SSR-PCR 反应体系的建立是SSR 标记技术应用的前提,目前主要通过单因素实验和正交实验来研究 SSR 体系的建立或优化。通过正交表将各个因素与水平进行组合形成不同的体系,既能快速找到最佳体系而且经济高效,省时省力[19-22]。同时还可以通过直观分析或利用 SPSS 等软件分析不同因素对体系的影响程度,也是目前建立 SSRPCR 反应体系最常用的方法。
由于云南金花茶的濒危,有关云南金花茶 SSR遗传分析的研究鲜有报道。本实验采用 L16(45)正交实验对云南金花茶 SSR-PCR 体系进行建立和优化,通过对SSR-PCR反应体系中的模板DNA、Taq DNA聚合酶浓度、dNTP、Mg2+、引物和引物退火温度进行了分析,从而获得稳定、可靠的云南金花茶 SSR-PCR 最佳反应体系。方差分析结果显示, 5个因素的不同水平间均存在显著差异。一般来说,Mg2+对 Taq DNA 聚合酶具有激活作用,体系中 Mg2+浓度过低会降低酶的效率,浓度过高会造成 Taq DNA 聚合酶扩增出的特异性产物降低,所以选择适宜的 Mg2+浓度是十分重要的。直观分析结果与多重比较都表示 Mg2+在 1.5 μL 时扩增效果最好,所以本次实验 Mg2+(25 mmol/L)用量为1.5 μL。引物浓度对 PCR 稳定性也有很大的影响,引物浓度过低时得到的扩增条带不清晰或较少,过高时容易引起错配和非特异性产物出现以及产生引物二聚体。本实验得出的结论为引物对云南金花茶 SSR-PCR 反应体系的影响程度仅次于Mg2+,这与湛欣等[23]的研究结果一致。虽然直观分析表示引物用量在 0.6 μL时扩增效果最好,但多重比较结果说明0.4 μL是引物的最佳用量,且实验过程中引物用量在 0.4 μL时扩增效果最为理想,因此引物(10 μmol/L)用量为 0.4 μL最适宜。Taq DNA 聚合酶对反应体系的影响主要表现在浓度过高会产生非特异性条带,浓度过低则不能很好的与产物结合使扩增条带不清晰。为防止 Taq聚合酶浓度过低导致扩增产物效果较低,结合直观分析确定 Taq DNA 聚合酶(5 U/μL)用量在 0.2 μL 最适宜。dNTP 在 PCR 反应过程中会与 Mg2+结合,从而降低Mg2+浓度进而减少 Taq DNA 聚合酶的催化剂影响最终扩增效果。直观分析表示dNTP用量在0.3 μL时扩增效果最好,多重比较结果说明dNTP用量在0.1 μL和0.3 μL时均适用,综合考虑,本实验 dNTP(10 mmol/L)用量为 0.3 μL。DNA 在本次实验中对反应体系的影响程度最小,这与对川山茶Camellia japonicaL.[24],二月兰Orychophragmus violaceusL.[25]等植物的相关SSR 体系建立时的相关研究结论相一致。多重比较结果说明DNA的用量在0.5 μL和2.0 μL时试验效果均佳,直观分析表示 DNA的用量在0.5 μL时扩增效果最好,二者结合考虑,且从经济角度出发,DNA(50 ng/μL)用量选择为 0.5 μL 最适宜。综合分析得到的反应体系与直观分析中最佳反应体系基本一致。试验认为,云南金花茶 SSR-PCR 最佳反应体系(20 μL)为:2.0 μL Taq Buffer、1.5 μL 的 Mg2+(25 mmol/L)、0.3 μL 的 dNTP(10 mmol/L)、0.2 μL 的 Taq DNA 聚合酶(5 U/μL)、前后引物各 0.4 μL(10 μmol/L)、0.5 μL 的模板 DNA(50 ng/μL)、14.7 μL 的 ddH2O。
吴帆等[26]在传统的CTAB法及试剂盒法的基础上,利用DNA提取缓冲液作为样品预处理液,配合其他操作步骤的优化,设计出针对樱亚属植物基因组DNA的新型提取方法。预实验中3种提取DNA的方法均进行了加预处理液与未加预处理液的对照组实验,实验结果表明,改进后的SDS法、CTAB法及试剂盒法均能有效地去除样品中含有的多糖、色素、黄酮等杂质,其中,以试剂盒法提取的DNA纯度和质量均高于CTAB法和SDS法。可见,加预处理液后的3种方法均能提高云南金花茶DNA的提取质量,该法具有较高的通用性,可以尝试用于其他物种DNA的提取工作中。
在实验过程中不可避免地存在误差,且通过直观分析正交实验结果存在一定的主观成分。所以,本实验还利用 SPSS 软件进行方差分析和多重比较,方差分析与直观分析各因素对云南金花茶SSR-PCR 体系建立的影响程度一致,多重比较与直观分析中各因素最佳用量也基本一致,说明本次实验结果是可靠的。

