急性左心衰合并肺部感染患者心房利钠肽前体A基因多态性和炎性标志物水平分析
胡金成 张黎军
急性心力衰竭的主要发生机制为左室收缩功能严重受损,目前已成为年龄超过65岁患者住院的主要原因[1]。心房利钠肽前体A(NPPA)基因遗传多态性与心血管疾病的关系已成为临床研究的热点[2]。但有关左心衰患者NPPA基因多态性与感染关系的报道所见尚少。本文回顾性分析急性左心衰是否合并肺部感染时NPPA基因多态性分布差异以及感染状态患者不同基因型的炎症标记物降钙素原(PCT)和C反应蛋白(CRP)水平,为进一步认识NPPA基因与急性左心衰及其感染的关系提供参考。
1 资料与方法
1.1 病例和分组
2014-03—2016-04,本院心内科收治急性左心衰患者120例,其中60例患者未合并肺部感染,作为左心衰组,60例患者合并肺部感染,作为左心衰感染组。另选同期来本院进行体检的非左心衰或非左心衰合并感染人群60例作为对照组。三组一般资料比较见表1。其性别、年龄、吸烟史、高血压史和糖尿病史分布差异均无统计学意义(P>0.05)。
急性左心衰诊断标准参照中华医学会心血管分会制定的《急性心力衰竭诊断和治疗指南》[3],NYHA分级III—IV级。常见临床表现为呼吸困难,严重者出现进行性肺水肿和心源性休克。肺部感染根据X光常规胸片、血液学分析、痰液和血液细菌培养等结果确定。排除合并肺部以外感染及合并休克、出血患者;排除合并肾功能衰竭、肺栓塞、恶性肿瘤患者;排除合并内分泌疾病患者。符合上述诊断和排除标准的患者纳入本研究,并签署知情同意书。

表1 各组一般资料比较(各组总例数均为60)
1.2 主要试剂和仪器
主要试剂:DNA kit(批号:AS1290,Promega,美国),Platinum TaqDNA聚合酶(批号:C10966-018,TaKaRa,日本),Ager powder(批号:A8190,北京生物有限公司),DNA Marker(批号:C18702,pEASY北京全金生物技术公司),SYBR SAFE DNA GEL STAIN Biosystem(批号:S33102,上海天科生物有限公司)。实时定量PCR试剂盒(批号:480II,美国罗氏)。CRP检测试剂盒(批号:96T/48T,上海康朗生物科技有限公司)。PCT检测试剂盒(批号:kt99293,武汉默沙原生物科技有限公司)。
主要仪器:恒温水浴箱(型号:HSW-600,上海永生医疗器械公司),紫外线照相分析仪(型号:UV 2000,上海天能科技有限公司)。电化学免疫发光仪(型号:2010,美国罗氏)。全自动生化分析仪(型号:TBA-40FR,日本东芝)。基因扩增仪(型号:EDC-10,东胜创新生物科技有限公司)。PCR仪(型号:T100,美国伯乐)。基因测序仪(型号:PrFlexTM3×3.2-well,赛默飞世尔科技有限公司)。
1.3 检测指标和方法
所有患者均空腹8-12h,于入院次日清晨抽取肘静脉血5ml,一部分置于EDTA抗凝管中,混匀进行NPPA基因检测;其余置于带分离胶促凝管中,分离血清,测定PCT、CRP水平。
1.3.1NPPA基因检测:(1)DNA提取:血液样本经裂解、蛋白质沉淀等步骤提取DNA,当蛋白质团块出现后,离心5min吸取上清0.7ml,滴入异丙醇,混合后可见DNA沉淀物,离心5min后弃上清。滴入乙醇(70%)0.7ml,洗涤DNA沉淀物并晾干。滴入DNA溶解液60μl,65℃水浴30min,进行电泳,测定A260吸光光度值,测定DNA浓度,-20℃冰箱保存。(2) 引物设计:由南京金思特科技有限公司合成,引物序列见表2。(3)PCR扩增与测序:总反应量25μl,包括PCR缓冲液(稀释10倍)2.5μl,氯化镁(50mmol/L)0.8μl,dNTP混合液(10mmol/L)0.5μl,上下游引物各1μl,DNA模板1μl,PlatinumTaq聚合酶0.2μl,双蒸水18μl。将样品混匀,置于PCR仪中进行扩增,完成扩增后吸取PCR产物进行凝胶电泳。PCR反应条件:预变性(94℃,2min),变性(95℃,30s),退火(50℃,30s),延伸(72℃,40s),循环30次,4℃保存。经琼脂糖凝胶鉴定,并利用Sanger原理进行测序分析。 PCR扩增与测序由南京金思特科技有限公司完成。

表2 单核苷酸多态性位点引物序列
1.3.2PCT水平测定:采用电化学免疫发光法,使用电化学发光仪和配套试剂,严格按照说明书步骤操作。
1.3.3CRP水平测定:采用免疫散射比浊法,使用全自动生化分析仪和配套试剂,严格按照说明书步骤操作。
1.4 统计学处理
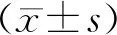
2 结 果
2.1 各组NPPA基因型分布比较
三组间NPPA的rs5063、rs5065之AA基因型、GG基因型分布均存在明显统计学差异(P<0.05或P<0.01),而AG基因型分布差异无统计学意义(P>0.05);左心衰组、左心衰感染组rs5063、rs5065的AA基因型患者比例明显高于对照组(P<0.01),GG基因型患者比例明显低于对照组(P<0.01)。且病例组间rs5063、rs5065的AA、GG基因型患者比例无明显统计学差异(均P>0.05)。见表3。
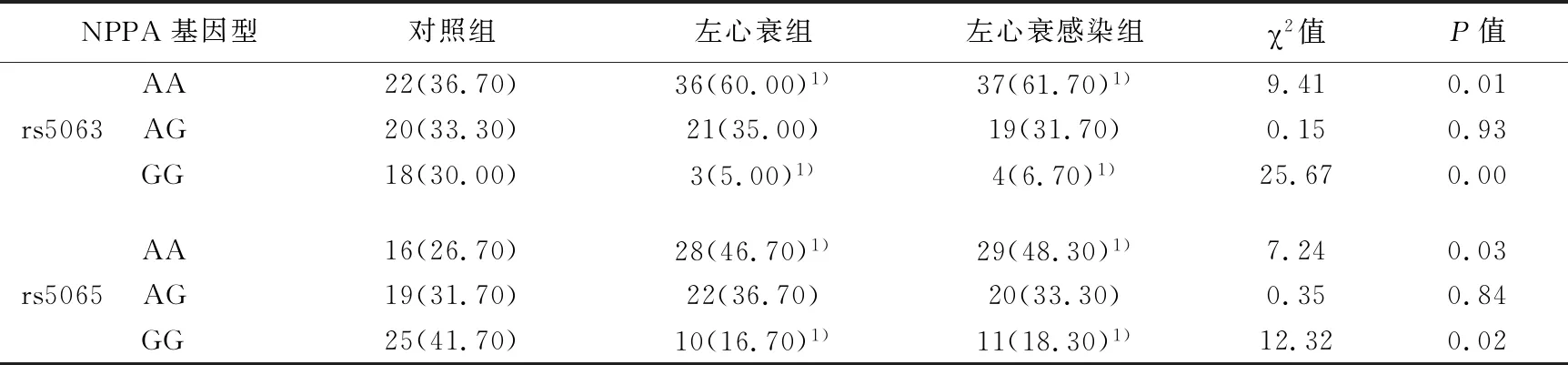
表3 三组各60例患者NPPA基因多态性分布比较(n,%)
注:与对照组比较,1)P<0.01
2.2 急性左心衰合并肺部感染患者NPPA不同基因型PCT、CRP水平比较
左心衰感染组患者NPPA基因(rs5063、rs5065)的AA、AG、GG基因型患者血清PCT、CRP水平差异均无统计学意义(P>0.05),见表4。
3 讨 论
急性心力衰竭是由于急性心脏变异导致的心排血量显著降低,组织器官灌注不足,畸形体循环/肺循环瘀血综合征,近年随国人老龄化加快,其发病率急剧上升[4]。
NPPA基因是编码心房利钠肽前体的基因,定位于人染色体lp36.22,包括3个外显子和2个内含子[5],利钠肽系统相关基因的遗传多态性与心血管疾病的相关关系已成为临床研究的热点。较多观察业已证实,NPPA基因多态性与心力衰竭、原发性高血压、中风、房颤、心律失常等疾病的发生存在显著相关性[6-8]。Mahmoodzadeh等[9]报道,rs5063和rs5065基因型与中风的患病风险有关;李文安等[10]认为,NPPA作为急性左心衰非离子通道的致病基因,在急性左心衰的发病过程中发挥重要作用。均表明NPPA基因是心血管疾病的致病基因。但有关NPPA基因多态性与急性左心衰及有否合并肺部感染的关系研究尚少。
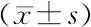
表4 左心衰感染组患者NPPA不同基因型PCT、CRP水平比较
本研究结果表明,急性左心衰、急性左心衰伴肺部感染及无心衰/感染各组间NPPA基因(rs5063、rs5065)的AA、GG基因型患者比率存在明显统计学差异。急性左心衰患者的AA基因型的患者比率明显高于对照组,GG基因型患者患者比率明显低于对照组。说明NPPA基因多态性在急性左心衰患者中存在一定特异性。支持相关研究认为NPPN基因多态性可在某种程度上决定心功能,成为急性左心衰的独立危险因素之一[11]的结论。
进一步比较合并肺部感染患者与未合并感染患者间NPPA基因型的分布差异,结果显示两组患者rs5063、rs5065的AA、GA、GG基因型分布均无明显差异;而且感染标志物PCT和CRP水平的检测结果也显示两组患者NPPA基因(rs5063、rs5065)的AA、AG、GG基因型患者之间亦无明显统计学差异。说明感染多为患者后天对感染源(细菌和病毒感染)的接触所导致,并不具有基因型的特异性。
综上所述,位于NPPA基因的单核苷酸rs5063、rs5065多态性在急性左心衰患者中存在特异性表现,这对于临床上急性左心衰的诊断、治疗具有一定的意义,对于研究药物治疗的靶点具有重大价值。

