1型糖尿病模型大鼠白细胞介素-17A和B细胞活化因子水平变化及其作用分析*
陈小奇 徐焱成 刘胜武 陈 敏 万茜茜
1型糖尿病(Type 1 Diabetes Mellitus,T1DM)是自身免疫反应参与的以胰岛β细胞损害为特征的疾病,多种免疫细胞参与了疾病的发生过程。CD4+T细胞在促进胰岛细胞免疫损伤、加重疾病进展过程中起主导作用。Th17细胞是CD4+T细胞亚型,有研究表明T1DM患者外周血Th17细胞升高,通过分泌白细胞介素-17A (IL-17A)发挥免疫炎症效应,与多种自身免疫性疾病的发生、发展有关[1-4]。 除了T细胞,B淋巴细胞也可以通过抗原提呈、分泌自身抗体及细胞因子如B细胞活化因子(BAFF)等参与多种自身免疫性疾病的发病过程[5]。但T、B淋巴细胞及其相关因子在自身免疫性疾病包括T1DM的表现和相互作用的研究报道较为少见。本文检测分析T1DM模型大鼠血清和脾脏组织中IL-17A和BAFF等的水平变化,初步了解Th17细胞与B细胞对T1DM发生的作用。
1 材料与方法
1.1 实验动物和分组处理
雄性SPF级成年健康SD雄性大鼠15只,质量180g-200g,购于武汉大学A3动物实验室,在本院实验动物中心分笼适应性饲养3天后,随机分为三组:(1)1型糖尿病大鼠组(T1DM组,n=5): 采用基础饲料(蛋白质21%,脂肪6%,碳水化合物55%)喂养5周后,连续5天低剂量腹腔注射链脲佐菌素(Streptozotocin,STZ,美国sigma公司产品,浓度0.4%,40mg/kg/天)进行自身免疫诱导。每周剪尾取血,应用拜安易血糖仪(德国拜耳,氧化酶法)检测血糖浓度,以高于16.67mmol/L为成模标准[6]。(2)2型糖尿病大鼠组(T2DM组,n=5):先以高脂饲料(能量比为:蛋白质15%、碳水化合物33%、脂肪52%)喂养5周后,按上述方法注射低剂量STZ一次,此后连续4天亦腹腔注射等量生理盐水,72h后按上法取血和测量血糖浓度,亦以高于16.67mmol/L为成模标准[7]。两组大鼠均全部成模。(3)另5只大鼠为正常对照组(CON组):以基础饲料喂养5周后,连续5天腹腔注射与上述制模大鼠等量生理盐水。最后将三组大鼠于SPF环境喂养,自由饮水摄食,并行空腹称重、测血糖(FBG),取内眦静脉血,测定C肽(FCP)、IL-17A和BAFF浓度。采用颈椎脱臼法处死各组大鼠,迅速摘取脾脏,检测脾组织IL-17A、BAFF蛋白表达和抗凋亡基因Bcl-2 mRNA水平。
1.2 检测指标和方法
1.2.1FBG和FCP水平检测:FBG检测方法如上。FCP检测:取大鼠内眦静脉血于非抗凝剂管内,室温下2 000r/min ×5min分离血清,采用放射免疫法(试剂盒购自中国原子能科学研究院)检测,步骤严格按照说明书,根据γ放射免疫计数器(中国科大中佳公司)给出的相关参数和标准曲线,得到样品浓度。
1.2.2血清IL-17A和BAFF检测:采用ELISA,试剂盒为美国R&D公司产品,按要求在酶标板上分别加入标准品和样品(样品制备方法同FCP),加入生物素标记液,37°C孵育1h、洗板后加入终止液,30°C暗盒反应20min,在酶标仪450nm波长读数,采用CurveExpert 1. 3软件给出的标准曲线和公式,计算待测样品中IL17A和BAFF浓度。
1.2.3脾脏IL-17A和BAFF蛋白表达:采用Western blot法,IL-17A抗体和BAFF抗体分别购自美国SANT CRUZ和英国ABCAM公司。脾组织裂解后离心取上清置于离心管用于电泳,经转膜、封闭、一抗二抗孵育后,将印迹膜与发光底物工作液孵育1-5min,在暗室中曝光胶片,立即显影、定影,使用Bandscan软件分析样品和内参灰度值,并计算灰度比值(OD),用以反映蛋白表达水平。
1.2.4脾脏Bcl-2基因表达: 采用实时荧光定量PCR。取脾脏组织100mg,Trizol一步法提取RNA。使用逆转录试剂盒(日本Toyobo公司)合成cDNA模板,反应体系20μl,包括5×逆转录缓冲液4μl,三磷酸脱氧核苷酸混合溶液2μl,类似引物1μl,无RNA酶的水1μl,RNA酶抑制剂1μl,逆转录酶1μl,RNA 10μl。反应条件为42℃ 逆转录20 min,95℃ 灭活5min,4℃冷却5min。在基因库中检索大鼠Bcl-2基因序列,采用Premier 5.0软件设计并选择最佳的引物如下,交由上海生工生物工程技术服务有限公司合成:Blc-2 F:ACG GTG GTG GAG GAA C;Blc-2 R:CAG CCA GGA GAA ATC AAA。β-actin内参引物序列为:β-actin F:CCC ATC TAT GAG GGT TAC GC;β-actin R:TTT AAT GTC ACG CAC GAT TTC。
检测Bcl-2 mRNA:反应体系由灭菌水4μl,SYBR Green Realtime PCR Master Mix (日本Toyobo公司)10μl,上游引物(10μM)0.8μl,下游引物(10μM)0.8μl,模板RNA 1μl组成。PCR反应条件: 95℃ 15s,56℃ 15s,72℃ 45s,40个循环。实时PCR产物从72℃缓慢而均匀地升至95℃,温度每升高0.2℃读一次荧光值,循环阈值(Ct)的设置为3-15个循环荧光信号强度标准偏差的10倍。循环结束后在SLAN软件系统自动绘制扩增动力曲线。由SLAN荧光定量分析软件自动绘制熔解曲线,通过熔解曲线分析反应产物的纯度以判断实验的特异性。调整基线和阈值,读出各反应孔Ct值。基因表达水平差异的比较用变化倍率表示。变化倍率=2-△△Ct,△△Ct=(Ct目的基因-Ct内参基因)-(Ct阴性对照-Ct内参基因)。
1.3 统计学处理
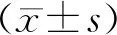
2 结 果
2.1 各组间FBG、FCP和BW比较
三组间FBG、FCP和BW存在显著差异(P<0.01)。两两比较T1DM组和T2DM组FBG显著高于CON组(P<0.01),且T1DM组高于T2DM组(P<0. 05);T1DM组FCP显著低于CON组和T2DM组,T2DM组FCP高于CON组(均P<0.01);T1DM组和T2DM组大鼠BW均低于CON组(P<0. 01),T1DM组更轻(P<0.01)。见表1。

表1 三组大鼠FBG、FCP和BW比较均=5)
注:与CON相比,1)P<0.01;与T2DM组相比,2)P<0.01
2.2 各组间血清IL-17A和BAFF水平比较
三组间血清IL-17A 水平有显著性差异(P<0.01)。T1DM组和T2DM组均显著高于CON组(t=-5.10,P<0.01 ,t=3.11,P<0.05),且T1DM组显著高于T2DM组(t=-3.03,P<0.01)。三组间血清BAFF水平亦有显著性差异(P<0.01)。T1DM组和T2DM组均显著高于CON组(t=-13.05,P<0.01;t=-5.54,P<0.01),T1DM组显著高于T2DM组(t=5.79,P<0.01)。见表2。

表2 三组间血清IL-17A 和BAFF比较均=5)
注:与CON组相比,1)P<0.01;与T2DM组相比,2)P<0.01

注:与CON组比较, * P<0.01;与T2DM组比较,# P<0.01
2.3 各组间脾组织IL-17A蛋白和BAFF蛋白水平比较
三组间脾组织IL-17A和BAFF蛋白水平与其血清水平的变化趋势一致,其蛋白电泳条带见图1A。两指标的三组间差异均有统计学意义(F=66.03、33.87,P<0.01)。IL-17A在T1DM组(2.03±0.09)和T2DM组(1.40±0.07)显著高于CON组(0.99±0.11)(t=-10.76、-4.49,P<0.01),且T1DM组明显高于T2DM组(t=-6.27,P<0.01),见图1B。BAFF在T1DM组(2.41±0.06)
和T2DM组(1.67±0.06)均显著高于CON组(1.00±0.12)(t=-20.26、-5.87,P<0.01),且T1DM组显著高于T2DM组(t=-5.87,P<0.01),见图1C。
2.4 各组间脾组织Bcl-2 mRNA水平比较
三组大鼠间脾组织 Bcl-2 mRNA表达水平有显著差异(F=17.10,P<0.01)。T1DM组(17.57±0.70)和T2DM组(11.68±3.27)显著高于CON组(8.18±1.15)(t=-6.83、-4.74,P<0.01),且T1DM组高于T2DM组(t=3.94,P<0.05)。见图2。

注:与CON组比较,* P<0.01;与T2DM组比较,# P<0.01
3 讨 论
BAFF是肿瘤坏死因子(TNF)超家族成员,是由炎性细胞分泌、维持B细胞免疫平衡的关键因素。通过促进B细胞的分化、增殖和存活、辅助自身反应性B细胞的选择及类型转换,参与自身免疫性疾病的发生及发展[8,9]。BAFF与其受体结合可促进Bcl-2基因转录,发挥减少B细胞凋亡效应。Bcl-2基因高表达有利于增加B细胞存活和扩增,加重免疫反应[10]。
IL-17A是Th17细胞分泌的特异细胞因子和主要的效应分子,也是Th17细胞的重要分子标志。Th17细胞通过IL-17A参与多种自身免疫性疾病的发生[4,11-14],是多种自身免疫性疾病的主要效应细胞。尽管Th17细胞在T1DM发生中的作用已经被认识[2,15],但具体机制并不清楚。T1DM免疫损伤是由多种细胞因子及免疫细胞参与的免疫网络综合作用的结果, 新近文献报道IL-17和γ干扰素(IFN-γ) 、IL-12 可能促进T1DM的自身免疫反应和β细胞损伤,而IL-4、IL-6和IL-13水平下调对疾病有预防作用[16]。
脾脏是成熟T、B淋巴细胞的定居场所和自身免疫反应的主要参与者,也是免疫干预的重要靶器官[17]。脾脏组织细胞炎性分子表达的研究对于阐明免疫反应的发生机制具有更好的指导作用。
本研究检测STZ诱导的T1DM大鼠IL-17A、BAFF在外周血和脾脏表达水平,以及BAFF下游的Bcl-2基因在脾脏的表达,结果显示正常大鼠外周血IL-17A和BAFF水平极低,而T1DM和T2DM大鼠两指标水平均明显升高,以T1DM大鼠升高最为显著。三组大鼠脾脏组织中IL-17A和BAFF蛋白表达结果亦显示,T1DM组两指标表达水平均显著高于CON组和T2DM组,与外周血表现一致。提示IL-17A和BAFF均与T1DM发生、发展有关,通过血清浓度变化与脾组织蛋白表达趋势一致,提示可以将二者作为疾病免疫炎症监测的生物标志。在T2DM大鼠也可以看到BAFF和IL-17A水平的升高,但显著低于T1DM组,提示低滴度炎症反应在T2DM的发病过程中具有重要作用,与文献报道结果一致[18]。进一步研究脾脏Bcl-2基因表达时发现,Bcl-2 mRNA水平在T1DM大鼠的脾脏也显著高于CON组和T2DM组,Bcl-2受BAFF调节,促进B淋巴细胞存活和增殖[19], Bcl-2高表达为B细胞参与T1DM发生提供了有力的佐证。
对于IL-17A和BAFF在参与T1DM发生时,二者是否存在相互作用尚待进一步研究。以往有报道IL-17A和BAFF协同参与系统性红斑狼疮的发生发展[20]。近期又发现BAFF和Th17细胞在斑秃的发病中具有协同作用[21]。在慢性胃炎中,幽门螺旋杆菌感染诱导巨噬细胞分泌的BAFF可刺激Th17细胞反应[22]。另外,在T1DM的发生过程中,BAFF能否通过Bcl-2促进Th17细胞存活,进而增加IL-17的分泌亦待进一步研究证实。
总之,T1DM的发生与IL-17A和BAFF有关,BAFF可能通过Bcl-2促进自身和B淋巴细胞的活化,参与T1DM的发生。对于B淋巴细胞和Th17细胞在T1DM发生中的相互作用及其免疫损伤机制尚需进一步研究论证。

