消糖灵片和消糖灵胶囊中格列本脲含量及含量均匀度测定
贺凡珍,黄财顺,杨 娟,李 哲,许润娟
(中山市食品药品检验所,广东 中山 528437)
消糖灵片和消糖灵胶囊均为治疗糖尿病的中西药复方制剂,其处方由黄芪、白芍、人参等十一味中药和化学药格列本脲组成。现行消糖灵片质量标准[1]有性状、黄芪甲苷薄层鉴别、人参皂苷Re和人参皂苷Rg1鉴别、黄连对照药材鉴别、格列本脲含量均匀度检查、格列本脲含量测定、芍药苷含量测定等项目;消糖灵胶囊质量标准[2]仅有性状、黄连对照药材鉴别、人参皂苷Re和人参皂苷Rg1鉴别项目。现有文献对消糖灵片和消糖灵胶囊的研究较少,有少数文献报道对消糖灵胶囊中芍药苷、盐酸小檗碱的成分进行含量测定[3-5],针对其中的化学药成分格列本脲,左宏笛[6]采用高效色谱法(HPLC)测定消糖灵片中格列本脲的含量,刘淑花等[7-12]对消糖灵胶囊中化学药品成分格列本脲进行含量测定,但没有文献报道对其进行含量均匀度检查。本文参照消糖灵片质量标准中格列本脲的含量测定及含量均匀度检查方法,建立消糖灵胶囊中格列本脲的含量测定及含量均匀度测定方法,并同时测定消糖灵片和消糖灵胶囊中格列本脲的含量及含量均匀度,比较两种剂型对格列本脲成分的控制。
1 仪器与材料
1.1 仪器
Waters eAlliance e2695-2998高效液相色谱仪(美国沃特世公司);超声波清洗机(天津瑞普);Millipore Integral-5超纯水机(德国默克公司)。
1.2 材料
消糖灵片(广东先通药业,批号:20171005,20171004,20171006,20171003,20171103,20171104,20171106,20171105,20171107,20171108);消糖灵胶囊(辽宁绿丹药业,批号:20161209,20170310,20161107,20170204,20161004,20170306,20170302,20170401,20161205,20160966,20170402);消糖灵胶囊(烟台中亚医药保健酒公司,批号:170229,170230,170123,160917,170301,160713,170403,160609,170506);消糖灵胶囊(湖南正清制药集团,批号:1702203,1706212);格列本脲对照品(中国食品药品检定研究院,批号:100135-201105);甲醇(色谱纯,德国默克公司);甲醇(分析纯,广州化学试剂厂)。
2 方法
2.1 色谱条件
色谱柱:Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm);流动相:甲醇-磷酸二氢铵溶液(取磷酸二氢铵1.725 g,加水300 ml使溶解,用磷酸调pH 3.5)(68:32),流速:1.0 ml/min,检测波长:230 nm;进样量:20 μl。
2.2 溶液的制备
2.2.1 对照品溶液的制备
2.2.1.1 片剂对照品溶液的制备 精密称取格列本脲对照品12 mg,置入50 ml量瓶,加甲醇12 ml,超声处理使溶解,放冷,加流动相至刻度,摇匀。精密量取5 ml置入50 ml量瓶,加流动相至刻度,摇匀,滤过,即得(每1 ml相当于格列本脲24 μg)。
2.2.1.2 胶囊对照品溶液的制备 精密称取格列本脲对照品14 mg,置入50 ml量瓶,加甲醇12 ml,超声处理使溶解,放冷,加流动相至刻度,摇匀。精密量取5 ml,置入100 ml量瓶,加流动相至刻度,摇匀,滤过,即得(每1 ml相当于格列本脲14 μg)。
2.2.2 供试品溶液的制备
2.2.2.1 片剂供试品溶液的制备 取格列本脲片10片,除去薄膜衣,精密称定,研细,混匀,取约0.8 g,精密称定,置入具塞锥形瓶,精密加入流动相50 ml,密塞,称定重量,超声处理(功率100 W,频率40 kHz)30 min,取出,放冷,称定重量,用流动相补足减失的重量,摇匀,滤过,即得。
2.2.2.2 胶囊供试品溶液的制备 取胶囊内容物,混合均匀,研细,取约0.4 g,精密称定,置入具塞锥形瓶,精密加入流动相25 ml,密塞,称定重量,超声处理(功率100 W,频率40 kHz)30 min,取出,放冷,称定重量,用流动相补足减失的重量,摇匀,滤过,即得。
3 方法学考察
3.1 专属性试验
精密量取对照品溶液、消糖灵胶囊供试品溶液、消糖灵胶囊缺格列本脲阴性供试品溶液各20 μl,按2.1项色谱条件进样分析,格列本脲与相邻成分达基线分离,且阴性对照无干扰(见图 1~3)。

图1 格列本脲对照品溶液色谱图

图2 消糖灵胶囊供试品溶液色谱图

图3 消糖灵胶囊缺格列本脲阴性供试品溶液色谱图
(因阴性供试品为自制,各味药材的品种和来源可能与企业原料有所不同,导致阴性供试品与消糖灵胶囊供试品其他峰差别较大)
3.2 定量限
精密吸取逐级稀释得到的格列本脲对照品溶液(2.88311 μg/ml),按2.1项色谱条件进样测定。信噪比约为10:1时,对应的格列本脲的进样量为0.057662 μg,即本方法中格列本脲的定量限为0.057662 μg。
3.3 线性试验
精密称取格列本脲对照品约14 mg,置入50 ml量瓶,加甲醇12 ml,超声处理使溶解,放冷,加流动相至刻度,摇匀,精密量取适量,分别稀释制成每1 ml约含2.8,7.0,14,28,42,56 μg的系列浓度的溶液,按2.1项色谱条件进样测定,以浓度(μg/ml)与其峰面积进行线性回归,回归方程为:Y=63 586X+12 151,r=1.000,线性范围为2.91~58.26 μg/ml。
3.4 精密度试验
精密量取格列本脲对照品溶液(14 μg/ml)20 μl,按2.1项色谱条件,连续进样分析6次,计算格列本脲峰面积的RSD(n=6)为0.1 %,试验结果表明本方法的精密度良好。
3.5 重复性试验
取批号为20170310的消糖灵胶囊样品6份,按2.2.2.2项方法制备供试品溶液,按2.1项色谱条件进样测定,结果消糖灵胶囊中格列本脲的平均含量(n=6)为标示量的112.0 %,RSD为1.1 %。
3.6 稳定性试验
取消糖灵胶囊3.5项下重复性试验样品,按2.1项色谱条件,在0,2,4,8,12,24 h依法测定格列本脲的峰面积,结果RSD(n=6)为0.2 %,表明溶液中格列本脲在24 h内稳定。
3.7 耐用性试验
3.7.1 不同品牌色谱柱对分离度的影响 分别采用Shiseido CAPCELL PAK C18MG Ⅱ(4.6 mm×250 mm,5 μm),Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm),Shimadzu Inertsil ODS-SP(4.6 mm×250 mm,5 μm)为色谱柱进行检测。结果表明,各色谱柱的分离效果均良好,分离度均>4.5。
3.7.2 柱温对分离度的影响 对比了20.0,25.0,30.0 ℃ 3个不同温度下各色谱峰的分离情况。结果表明,3个不同柱温下,除色谱峰的保留时间稍有差别外,各峰的分离度均>3.9。
3.7.3 流动相比例对分离度的影响 对比了甲醇-磷酸二氢铵(72:28),甲醇-磷酸二氢铵(65:35),甲醇-磷酸二氢铵(68:32)对分离效果的影响。结果显示,采用不同比例的甲醇-磷酸二氢铵为流动相,各峰的峰型及分离度均良好。最终选择出峰时间适宜的甲醇-磷酸二氢铵(68:32)为流动相。
3.8 加样回收试验
采用加样回收法,精密称取同批号一样品(批号20170310)9份,平均分为3组,按低、中、高浓度(0.8,1,1.2倍)分别加入适量格列本脲对照品,按2.2项方法制备供试品溶液,按2.1项色谱条件进样测定,结果格列本脲的平均回收率(n=9)为99.9 %,RSD为1.2 %,结果见表1。
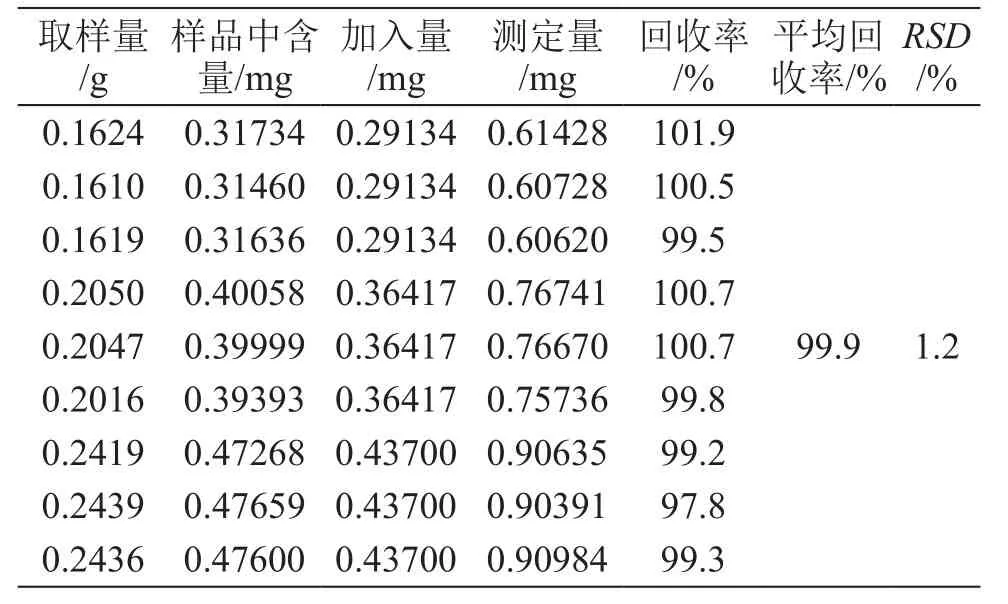
表1 加样回收试验结果(n=9)
4 样品测定
4.1 含量测定
4.1.1 片剂含量测定 参照消糖灵片质量标准中含量测定项,测定10批消糖灵片的含量,结果以相对于标示量的百分比表示,以下同,见表2。
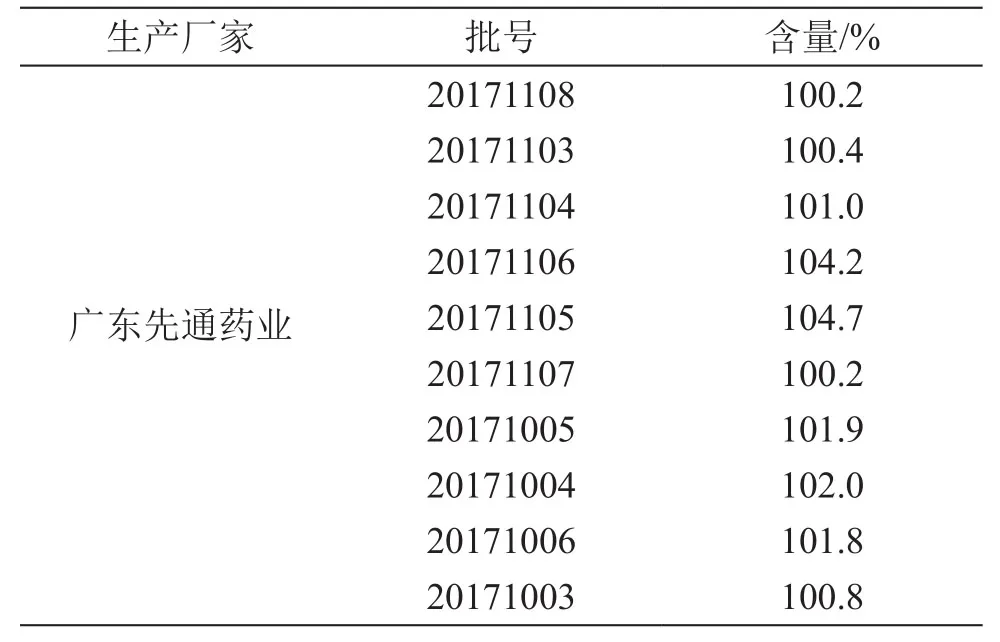
表2 消糖灵片中格列本脲含量测定结果
4.1.2 胶囊含量测定 精密称取22批消糖灵胶囊样品各约0.4 g,按2.2项方法制备供试品溶液,按2.1项色谱条件进样测定,以外标法计算格列本脲含量,结果见表3。

表3 消糖灵胶囊中格列本脲含量测定结果
4.2 含量均匀度测定
《中国药典》2015年版四部0941含量均匀度检查法规定[13]:除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂量标示量小于25 mg或主药含量小于每一个单剂量重量25 %者均需检查含量均匀度。消糖灵片每片含格列本脲1.05 mg,消糖灵胶囊每粒含格列本脲仅0.7 mg,两种剂型均为中西药复方制剂且符合进行含量均匀度检查的要求,西药成分的含量不均匀将造成药品无效或药品蓄积,使副作用增加,针对胶囊剂的质量标准中尚无含量均匀度项的现状,参照已有的片剂质量标准中的含量均匀度项,进行测定。
4.2.1 片剂含量均匀度测定 参照消糖灵片质量标准,取消糖灵片1片,置入具塞锥形瓶,精密加入格列本脲含量测定项下的流动相50 ml,密塞,称定重量,超声处理(功率100 W,频率40 kHz)至片剂完全崩解,取出,放冷,称定重量,用流动相补足减失的重量,摇匀,滤过,取续滤液作为供试品溶液,按含量测定项下方法测定,计算结果,结果见表4。
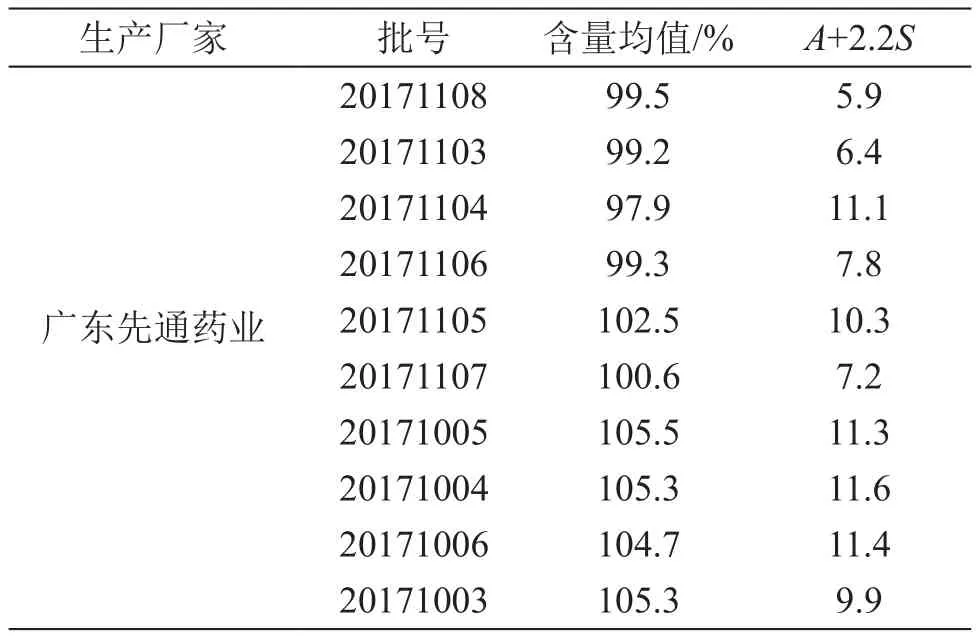
表4 消糖灵片中格列本脲含量均匀度测定结果
4.2.2 胶囊含量均匀度测定 应用本文建立的HPLC含量测定方法,进行消糖灵胶囊中格列本脲含量均匀度检查。取消糖灵胶囊1粒,置入具塞锥形瓶,精密加入流动相25 ml,密塞,称定重量,超声处理(功率100 W,频率40 kHz)至胶囊完全崩解,取出,放冷,称定重量,用流动相补足减失的重量,摇匀,滤过,作为供试品溶液,平行处理10份,照含量测定项下的方法测定,计算结果,结果见表5。
5 讨论
5.1 检测波长的选择
根据格列本脲对照品溶液紫外扫描结果,格列本脲的最大吸收波长在230 nm和300 nm附近,其中230 nm处主峰的响应值高,灵敏度较好,故选择230nm为检测波长。

表5 消糖灵胶囊中格列本脲含量均匀度测定结果
5.2 提取溶剂考察
分别采用甲醇和流动相作为提取溶剂,结果发现二者提取效率相当,为了节约成本和减少环境污染,采用流动相作为提取溶剂。
6 小结
由含量结果可见,消糖灵片中的格列本脲含量均为标示量的90.0 %~ 110.0 %,含量均匀度A+2.2S≤15.0,均符合现行质量标准要求。消糖灵胶囊中格列本脲含量相差悬殊,不同厂家、甚至同一厂家不同批次间的含量都不稳定。由于两个品种的质量标准不同,导致不同品种规格的消糖灵制剂的质量存在差异,且市售两个品种的价格也存在较大差异。特别是消糖灵胶囊为一种中西药复方制剂,无化学药成分的含量测定要求,容易造成该品种的化学药含量不均匀或超出合理的使用范围,从而影响药品的安全性,严重者甚至造成患者使用后的化学药积蓄过量,副作用增加。因此建立制剂中的格列本脲含量测定及含量均匀度测定方法,对药品的质量控制有重要作用。

