腹腔致敏途径下的大鼠被动皮肤过敏试验影响因素研究
王 萍,王功霞,曹 冲*
(1.山东医药技师学院,山东 泰安 271016;2.山东省药学科学院 山东省化学药物重点实验室,山东 济南250101)
被动皮肤过敏试验是《药物刺激性、过敏性和溶血性研究技术指导原则》[1]规定的检测注射剂药物过敏性的试验方法之一,通常选用大鼠为试验动物,阳性对照组给予牛血清白蛋白或卵白蛋白或已知致敏阳性物质,致敏给药方法可选择静脉、腹腔或皮下注射液等,共给药3~5次,末次致敏后第10~14天制备致敏血清。
研究发现[2-5],以卵白蛋白为致敏原进行大鼠被动皮肤过敏试验时,加入佐剂条件下动物对抗原更为敏感,免疫效果较好,常用的佐剂为氢氧化铝凝胶佐剂,但配制方法较繁琐,对pH值要求较高。大鼠抗体产生阶段,致敏给药方法多选用皮下注射,由于佐剂的吸收速度慢,导致皮下注射后易形成肿块,且有些受试物临床给药途径明确指出禁止皮下给药。针对以上问题,本试验以卵白蛋白为致敏原,佐剂选择Sigma公司生产的油佐剂──弗氏完全佐剂,致敏给药方法选择腹腔注射,研究不同给药剂量,不同致敏次数,末次致敏后不同制备血清时间等因素条件对大鼠被动皮肤过敏试验免疫应答结果的影响。
1 仪器与材料
1.1 仪器
ACS-JJ-Tiger电子计价秤(梅特勒-托利多);ME204E电子天平(梅特勒-托利多)。
1.2 试剂
卵白蛋白(批号:326A052,Sigma公司);0.9 %氯化钠注射液(批号:1C16101307,山东齐都药业);弗氏完全佐剂(批号SLBM2183V,Sigma公司)。
1.3 动物
SD大鼠,SPF级,体重100~200 g,雌雄各48只,北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:SCXK(京)2016-0006,动物饲养于屏障环境动物实验设施。试验在屏障环境动物实验设施进行,实验动物使用许可证号SYXK(鲁)20140008,动物房温度20~26 ℃,湿度40 %~70 %。
2 方法
2.1 分组、致敏与致敏血清制备
96只大鼠随机分为16组,每组6只,2只用于抗血清制备,4只用于被动激发。将卵白蛋白溶液与弗氏完全佐剂按1:1比例混匀,1,2,5,6,9,10组大鼠于第1,3,5天分别腹腔注射给予致敏物与佐剂混合物1 ml,各组均致敏3次;3,4,7,8,11,12组大鼠于第1,3,5,7,9天分别腹腔注射给予相同混合物1 ml,各组均致敏5次。阴性对照组大鼠给予0.9 %氯化钠注射液与弗氏完全佐剂的混合物,13、14组致敏3次,15,16组致敏5次。末次致敏后第10天或第14天,大鼠以1 %戊巴比妥钠麻醉(50 mg/kg,腹腔注射)后腹主动脉采血,血液样本在室温下1500 r/min离心10 min。取上清,将每组动物的抗血清混合。

表1 试验设计
2.2 被动致敏及激发
各组制备好的抗血清用0.9 %氯化钠注射液稀释成不同浓度,分别为原液、1:2,1:4,1:8。采用10 mg/ml丙泊酚,按10 mg/kg尾静脉注射麻醉大鼠,在距离脊柱约1.5 cm处背部脱毛,脱毛区域约5 cm×6 cm。在脱毛区域旁,按一定方向皮内注射各对应组的不同稀释度抗血清0.1 ml。24 h后分别静脉注射与致敏剂量相同的激发抗原加等量0.5 %伊文思蓝染料共1 ml[6]。
2.3 蓝斑测定
激发后约30 min用3 %戊巴比妥钠麻醉(90 mg/kg,腹腔注射)处死动物,测量背部皮肤蓝斑直径,以长径与短径的平均值作为蓝斑直径。
2.4 数据处理
3 结果
3.1 3次致敏后大鼠被动皮肤过敏试验结果(第10天制备致敏血清)
13组:采用0.9 %氯化钠注射液3次致敏,末次致敏后第10天制备血清,4只动物均未出现蓝斑。
1,5,9组:卵白蛋白剂量为5 mg/只时,4只动物在原液、1:2注射点出现蓝斑,蓝斑直径均大于5 mm,阳性反应率为100 %;4只动物在1:4注射点出现蓝斑,3只动物蓝斑直径大于5 mm,阳性反应率为75 %;2只动物在1:8注射点出现蓝斑,1只动物蓝斑直径大于5 mm,阳性反应率为25 %。卵白蛋白剂量为10,20 mg/只时,各组均有4只动物在原液、1:2、1:4、1:8注射点均出现蓝斑,且蓝斑直径均大于5 mm,阳性反应率为100 %。见表2。
表2 3次致敏后大鼠被动皮肤过敏试验结果(第10天制备致敏血清,)
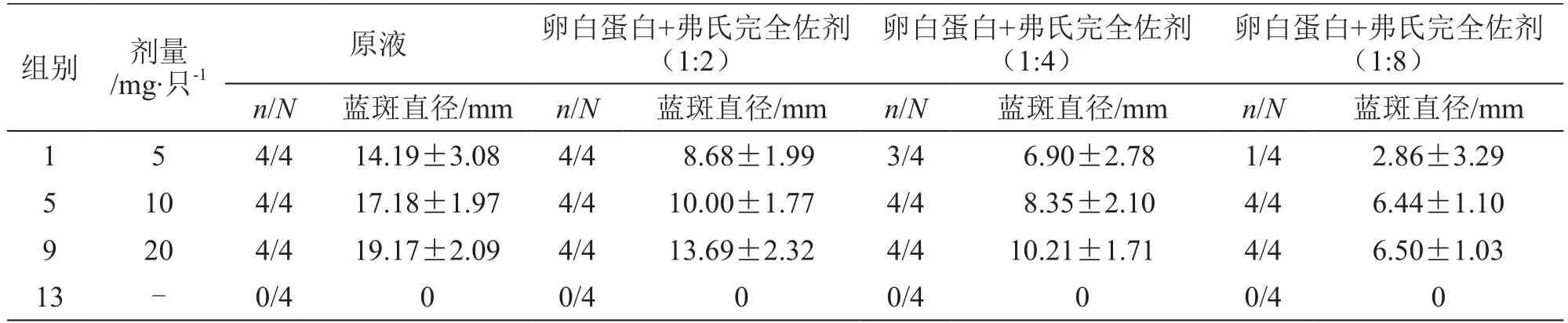
表2 3次致敏后大鼠被动皮肤过敏试验结果(第10天制备致敏血清,)
注:n代表阳性反应动物数,N代表动物总数
卵白蛋白+弗氏完全佐剂(1:8)n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm 1 5 4/4 14.19±3.08 4/4 8.68±1.99 3/4 6.90±2.78 1/4 2.86±3.29 5 10 4/4 17.18±1.97 4/4 10.00±1.77 4/4 8.35±2.10 4/4 6.44±1.10 9 20 4/4 19.17±2.09 4/4 13.69±2.32 4/4 10.21±1.71 4/4 6.50±1.03 13 - 0/4 0 0/4 0 0/4 0 0/4 0组别 剂量/mg·只-1原液 卵白蛋白+弗氏完全佐剂(1:2)卵白蛋白+弗氏完全佐剂(1:4)
3.2 3次致敏后大鼠被动皮肤过敏试验结果(第14天制备致敏血清)
14组:采用0.9 %氯化钠注射液3次致敏,末次致敏后第14天制备血清,4只动物均未出现蓝斑。
2,6,10组:卵白蛋白剂量为5 mg/只时,4只动物在原液、1:2注射点出现蓝斑,阳性反应率为100 %;2只动物在1:4注射点出现蓝斑,阳性反应率为50 %;1只动物在1:8注射点出现蓝斑,阳性反应率为25 %。卵白蛋白剂量为10,20 mg/只时,各组均有4只动物在原液、1:2注射点出现蓝斑,阳性反应率为100 %;3只动物在1:4注射点出现蓝斑,阳性反应率为75 %;2只动物在1:8注射点出现蓝斑,阳性反应率为50 %。见表3。
表3 3次致敏后大鼠被动皮肤过敏试验结果(第14天制备致敏血清,)

表3 3次致敏后大鼠被动皮肤过敏试验结果(第14天制备致敏血清,)
注:n代表阳性反应动物数,N代表动物总数
卵白蛋白+弗氏完全佐剂(1:8)n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm 2 5 4/4 12.93±2.92 4/4 9.82±1.53 2/4 3.72±4.00 1/4 1.29±2.39 6 10 4/4 14.23±3.70 4/4 10.87±1.20 3/4 6.78±4.50 2/4 3.60±4.03 10 20 4/4 16.06±3.33 4/4 11.06±1.24 3/4 6.54±4.23 2/4 3.71±4.07 14 - 0/4 0 0/4 0 0/4 0 0/4 0组别 剂量/mg·只-1原液 卵白蛋白+弗氏完全佐剂(1:2)卵白蛋白+弗氏完全佐剂(1:4)
3.3 5次致敏后被动皮肤过敏试验结果(第10天大鼠制备致敏血清)
15组:采用0.9 %氯化钠注射液5次致敏,末次致敏后第10天制备血清,4只动物均未出现蓝斑。
3,7,11组:卵白蛋白剂量为5 mg/只时,4只动物在原液、1:2注射点出现蓝斑,阳性反应率为100 %;3只动物在1:4注射点出现蓝斑,阳性反应率为75 %;1只动物在1:8注射点出现蓝斑,阳性反应率为25 %。卵白蛋白剂量为10 mg/只时,4只动物在原液、1:2注射点均出现蓝斑,阳性反应率为100 %;3只动物在1:4注射点出现蓝斑,阳性反应率为75 %;1只动物在1:8注射点出现蓝斑,阳性反应率为25 %。卵白蛋白剂量为20 mg/只时,4只动物在原液、1:2、1:4注射点均出现蓝斑,阳性反应率为100 %;2只动物在1:8注射点出现蓝斑,阳性反应率为50 %。见表4。
表4 5次致敏后大鼠被动皮肤过敏试验结果(第10天制备致敏血清,)

表4 5次致敏后大鼠被动皮肤过敏试验结果(第10天制备致敏血清,)
注:n代表阳性反应动物数,N代表动物总数
卵白蛋白+弗氏完全佐剂(1:8)n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm 3 5 4/4 13.37±2.38 4/4 10.17±2.80 3/4 5.64±4.16 1/4 1.99±3.69 7 10 4/4 16.10±2.88 4/4 12.82±1.99 3/4 6.07±4.17 1/4 1.81±3.40 11 20 4/4 17.13±2.65 4/4 12.08±1.88 4/4 10.90±1.90 2/4 3.98±4.31 15 - 0/4 0 0/4 0 0/4 0 0/4 0组别 剂量/mg·只-1原液 卵白蛋白+弗氏完全佐剂(1:2)卵白蛋白+弗氏完全佐剂(1:4)
3.4 5次致敏后大鼠被动皮肤过敏试验结果(第14天制备致敏血清)
16组:采用0.9 %氯化钠注射液,5次致敏,末次致敏后第14天制备血清,4只动物均未出现蓝斑。
4,8,12组:卵白蛋白剂量为5,10,20 mg/只时,各组均有4只动物在原液、1:2注射点出现蓝斑,阳性反应率为100 %;3只动物在1:4注射点出现蓝斑,阳性反应率为75 %;各组4只动物在1:8注射点均未出现蓝斑。见表5。
表5 5次致敏后大鼠被动皮肤过敏试验结果(第14天制备致敏血清,)
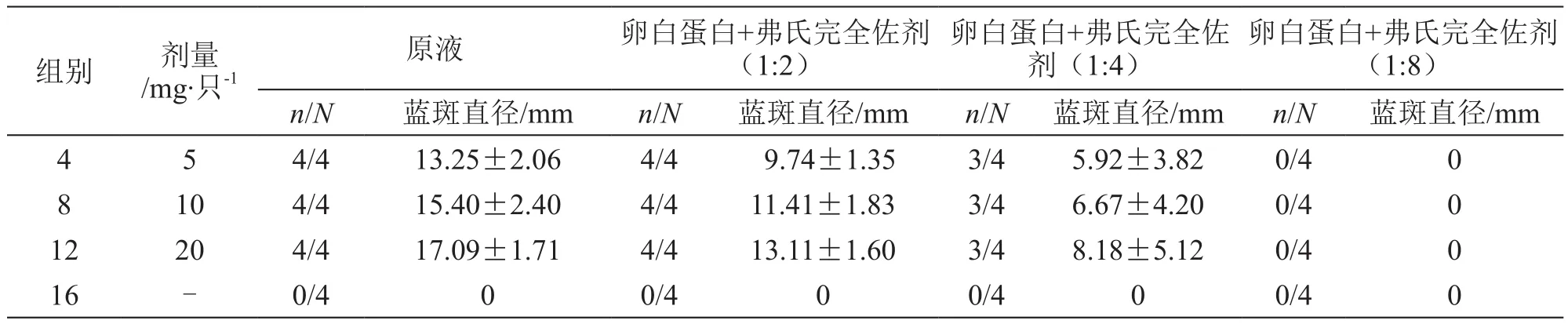
表5 5次致敏后大鼠被动皮肤过敏试验结果(第14天制备致敏血清,)
注:n代表阳性反应动物数,N代表动物总数
卵白蛋白+弗氏完全佐剂(1:8)n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm n/N 蓝斑直径/mm 4 5 4/4 13.25±2.06 4/4 9.74±1.35 3/4 5.92±3.82 0/4 0 8 10 4/4 15.40±2.40 4/4 11.41±1.83 3/4 6.67±4.20 0/4 0 12 20 4/4 17.09±1.71 4/4 13.11±1.60 3/4 8.18±5.12 0/4 0 16 - 0/4 0 0/4 0 0/4 0 0/4 0组别 剂量/mg·只-1原液 卵白蛋白+弗氏完全佐剂(1:2)卵白蛋白+弗氏完全佐剂(1:4)
4 讨论
被动皮肤过敏试验中影响免疫应答的因素很多,如动物种属、致敏剂量、致敏次数、致敏途径、抗血清制备时间、是否添加佐剂等。大鼠已被广泛用于过敏性评价试验[9],SD大鼠是常用的非临床研究用实验动物,有大量的生物学历史数据,动物免疫原性较强,因此本研究选用SD大鼠进行试验。王金华等[10]研究表明,以卵白蛋白为致敏原进行大鼠被动皮肤试验,在不加佐剂的条件下,激发后无蓝斑出现,结果为阴性,但在加弗氏完全佐剂的条件下,结果为阳性。不同佐剂对实验结果影响也不同,戴学栋等[11]使用3种佐剂比较了SD大鼠被动皮肤过敏的反应程度,阳性反应率和蓝斑直径从大到小依次为氢氧化铝>百白破联合疫苗>弗氏完全佐剂,加入佐剂时,均能提高SD大鼠的敏感性,其中以氢氧化铝效果最好。氢氧化铝凝胶无市售成品,需自行配制[12],方法繁琐,而弗氏佐剂为油性佐剂[13],无需配制,质量稳定,因此本试验致敏过程也选用弗氏完全佐剂,1:1与卵白蛋白混合后致敏。指导原则中,致敏给药方法可选择静脉、腹腔或皮下注射等,共给药3~5次,末次致敏后第10~14天制备致敏血清,大鼠抗体产生阶段,致敏给药方法多选用皮下注射[14-15],有些药物说明书中明确说明禁止皮下给药,因此本试验研究了腹腔注射致敏途径下,不同致敏剂量(5,10,20 mg/只)、致敏次数(3次、5次)、不同抗血清制备时间(末次致敏后第10天、第14天)等因素对大鼠被动皮肤过敏试验的影响。
结果表明,以卵白蛋白+弗氏完全佐剂作为抗原,卵白蛋白在5~20 mg/只剂量下,各组蓝斑直径与血清稀释倍数呈递减关系,蓝斑直径随血清稀释度的增加而减小,即原液注射点蓝斑直径最大,其他注射点依次减小。所有动物在原液、1:2注射点均出现蓝斑,阳性反应率为100 %,各组动物在1:4、1:8注射点出现蓝斑动物例数及阳性反应率不同,卵白蛋白10,20 mg/只剂量下的阳性反应率高于卵白蛋白5 mg/只剂量,但20 mg/只剂量下的原液注射点蓝斑直径过大,边缘不易区分,10 mg/只剂量下的各注射点蓝斑边缘清晰,较易区分。在卵白蛋白剂量相同,致敏次数及末次致敏后抗血清制备时间不同时,各组在原液、1:2注射点阳性反应率并无明显区别,均为100 %,但在1:4,1:8注射点阳性反应率存在差异,特别是5次致敏后第14天制备抗血清组,所有动物在1:8注射点均未出现蓝斑。王冲等[16]研究发现,致敏8 d与致敏12~14 d的蓝斑直径比较差异无统计学意义,各组蓝斑直径并无明显区别;井中旭等[17]研究发现,致敏效果与致敏次数不呈依赖关系,本研究结果也显示致敏效果与致敏剂量相关,与致敏次数并无递增关系,末次致敏后第10天制备抗血清的阳性反应要优于末次致敏后第14天制备抗血清的阳性反应。蓝继奎等[18]研究表明,使用豚鼠进行被动皮肤试验试验时,增加免疫次数能提高阳性反应率,分析可能与动物种属特异性有关。需要注意的是,大鼠腹腔注射致敏,由于佐剂的吸收速度慢,导致大鼠腹胀、腹腔内肠黏膜粘连[10],体重增长缓慢,致敏期间应密切关注动物状态。
综上,大鼠被动皮肤过敏试验,致敏途径为腹腔注射给药时,推荐的方法为:SD大鼠连续隔日3次注射给予受试物与弗氏完全佐剂1:1混合乳液1 ml/只致敏,卵白蛋白致敏剂量10 mg/只,末次致敏后第10天取血制备抗血清。抗血清按原液,1:2,1:4,1:8倍比稀释,大鼠背部皮肤皮内分别注射0.1 ml各浓度抗血清被动致敏,24 h后静脉注射与致敏剂量相同抗原激发。

