一株多形炭角菌的分离鉴定及其生长特性研究
何山文 雷 琼 马立安*
(1长江大学生命科学学院,湖北荆州434025;2荆州文物保护中心,湖北荆州434020)
多形炭角菌(Xylaria polymorpha)属于菌物界,子囊菌门,盘菌亚门,粪壳菌纲,炭角菌亚纲,炭角菌目,炭角菌科,炭角菌属。多形炭角菌主要生长于林间腐木、树皮裂缝中[1]。研究表明,多形炭角菌具有药用价值[2],是天然产物的丰富来源。JANG等[3-4]不仅从多形炭角菌子实体的甲醇提取物分离到亚油酸、亚油酸甲酯及麦角甾醇等多种生物活性物质,还分离到2种聚丙酸酯xylarinic acids A和B(具有清除自由基、抗真菌与抗炎活性)。杨宁宁等[5]从多形炭角菌菌丝发酵产物乙酸乙酯部分中分离鉴定出具有乙酰胆碱酯酶及α-葡萄糖苷酶抑制活性和抗线虫活性的新物质。由于多形炭角菌的资源比较匮乏,难以大量收集,其大规模开发利用受到限制。
笔者对一株疑似炭角菌属的大型野生真菌进行组织分离,并通过真核生物核糖体基因ITS序列对其进行鉴定并研究其培养特性,为其人工驯化栽培及产业发展提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株采自英国诺里奇东安吉利亚大学校区林间的野生大型真菌(图1),保存于长江大学生命科学学院微生物实验室。
供试基础培养基:葡萄糖20 g,蛋白胨2.0 g,磷酸二氢钾3.0 g,硫酸镁1.5 g,去离子水1000 mL,pH自然。
1.2 试验方法
1.2.1 菌株的分离纯化
将野生菌进行酒精消毒后,取子实体部分接于PDA培养基上,28℃恒温箱中培养,4 d后挑取边缘菌丝转接,转接2~3次,经镜检无杂菌后即得到纯化的菌株,编号为T-18。
1.2.2 形态学鉴定
将菌株接种于PDA培养基上,7 d后观察记录菌落特征、菌丝形态。
1.2.3 分子系统鉴定
将菌丝置于PDA液体培养基中培养3 d,离心取出菌丝后采用改良的CTAB法[6]提取DNA。PCR扩增引物:ITS4:5'-TCCTCCGCTTATTGATATGC-3',ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3',PCR 反应体系(50 μL),其体系为 10×Taq Buffer 5 μL,dNTPs(2 mmol/L)5 μL,Taq(2 U/μL)1 μL,上下游引物各1 μL(10 μmol/L),ddH2O 33 μL,DNA模板4 μL。PCR扩增程序为:94℃预变性4 min,94℃变性40 s,56℃退火30 s,72℃延伸45 s,30个循环;72℃延伸10 min。0.8%的琼脂凝胶电泳检测后送往生工生物工程(上海)股份有限公司测序。
1.2.4 菌丝生长特性研究
保存的菌种接种到PDA培养基上,放入25℃恒温培养箱培养5 d进行活化。取1 cm2左右活化菌种接种进装有150 mL基础培养基的三角瓶中,放置于25℃、转速为100 r/min的温控摇床培养5 d,制成种子液备用。
1.2.4.1 碳源对菌丝体生长的影响
以不加葡萄糖的基础培养基为空白对照,以基础培养基中葡萄糖的含碳量为标准,以相同含碳量的蔗糖、乳糖、麦芽糖、α-可溶性淀粉分别代替葡萄糖,共6个处理,每个处理3次重复。培养基装液量50 mL/100 mL三角瓶,等量接种,放置于25℃、转速为100 r/min的恒温摇床培养7 d。培养结束后,取发酵液过滤,收集菌丝体。菌丝体于50℃烘干12 h至恒重后称重。计算菌丝体产量(平均每100 mL发酵液得到的菌丝体干重)。
1.2.4.2 氮源对菌丝体生长的影响
以不加蛋白胨的基础培养基为空白对照,以基础培养基中蛋白胨的含氮量为标准,以相同含氮量的牛肉膏、酵母粉、硫酸铵、硝酸铵、硝酸钠分别代替蛋白胨,研究氮源对菌丝体生长的影响。共7个处理,每个处理3次重复。其他步骤同1.2.4.1。
1.2.4.3 无机盐对菌丝体生长的影响
以不加磷酸二氢钾和硫酸镁的基础培养基为空白对照,选用硫酸锰、硫酸锌、硫酸镁、磷酸二氢钾、磷酸二氢钠、硫酸钾6种无机盐进行试验。其他步骤同1.2.4.1。
1.2.4.4 温度对菌丝体生长的影响
液体培养基为基础培养基,培养温度为15、20、25、30、35℃,共6个处理,每个处理3次重复。其他步骤同1.2.4.1。
1.2.4.5 pH对菌丝体生长的影响
液体培养基为基础培养基,pH设置为3、4、5、6、7、8、9,每个处理3次重复。其他步骤同1.2.4.1。
1.2.5 数据处理
以菌丝体生物量作为指标,绘制柱状图。采用SPSS 19.0对试验数据进行统计分析,用LSD法比较各因素对菌丝产量的差异显著性影响。

图1 样品子实体形态
图2 样品菌落平板形态
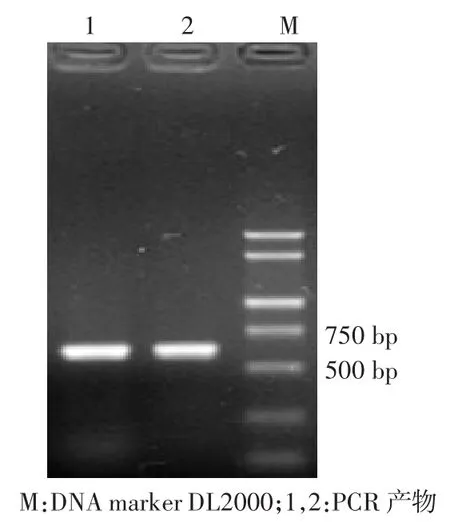
图3 ITS片段PCR产物电泳图
2 结果与分析
2.1 样品形态学鉴定
样品子实体菌落形态如图1、2所示。头部呈椭圆形或卵圆形或近球形,饱满肥厚,呈颗粒状簇生在一起,表皮黑褐色、光滑,内部呈白色,有浓郁的香气。菌丝体呈树枝状,由根部往上生长分出若干分枝。菌丝体表皮呈黑褐色,带黑色斑点,末端白色,在培养基中生长时分泌出水滴状液体。
2.2 野生菌株的ITS序列分析
PCR产物经0.8%琼脂糖凝胶电泳分析显示,可见约600 bp的目的条带,条带明亮清晰,无拖尾,见图3。测序获得野生菌株的ITS区域核酸序列,共579 bp。提交至GenBank获得基因号为KF897015。下载与其同源性较高的菌株序列作为参考,用Mega 5.1软件构建分子系统发育树,结果如图4所示。与登录号为FM164944.1的多形炭角菌(Xylaria polymorpha)的DNA序列同源性为99%。结合形态特征鉴定结果,鉴定该菌为多形炭角菌(Xylaria polymorpha),属于炭角菌目,炭角菌科,炭角菌属。

图4 T-18的16 s基因序列构建的系统发育树
2.3 不同碳源对菌丝体生长的影响
不同碳源对多形炭角菌菌丝体生物量影响如图5所示。该菌株在5种供试碳源中均可生长,表明该菌株菌丝对单糖、双糖及多糖均能利用,但菌丝长速和长势存在差异。该菌株以葡萄糖作为碳源时菌丝生物量最大,达到466 mg/100 mL,且与其他碳源相比,差异显著(P<0.01)。因此,葡萄糖为菌丝生长的最佳碳源。
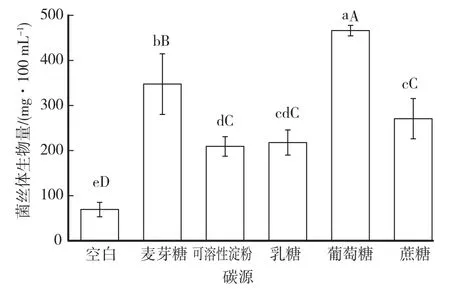
图5 不同碳源对菌丝体生长的影响
2.4 不同氮源对菌丝体生长的影响
不同氮源对多形炭角菌菌丝体生物量影响如图6所示。结果表明,多形炭角菌菌丝体在6种供试氮源培养基中均能生长,但不同氮源对菌丝体生物量的影响有差异,其中以牛肉膏为氮源的菌丝体生物量最高,达到327 mg/100 mL。无机氮源中,除硫酸铵组外,供试氮源与空白对照菌丝体生物量差异均显著(P<0.05),但没有达到极显著水平(P<0.01)。
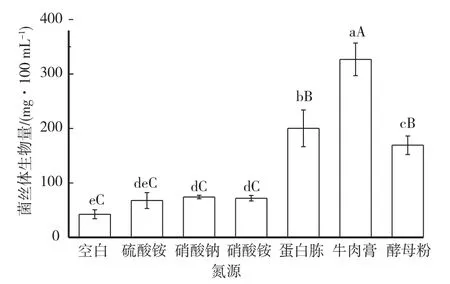
图6 不同氮源对菌丝体生长的影响
2.5 不同无机盐对菌丝体生长的影响
不同无机盐对多形炭角菌菌丝体生物量影响如图7所示。结果表明,其中以KH2PO4和MgSO4为无机盐的菌丝体生物量较大,分别达到351 mg/100 mL和346 mg/100 mL,而以硫酸锌为无机盐的菌丝体生物量最少,只有32 mg/100 mL。
2.6 不同pH对菌丝体生长的影响
不同pH对多形炭角菌菌丝体生物量影响如图8所示。结果表明,多形炭角菌菌丝体在供试pH为4~9的培养基都能生长。培养基在pH 7时菌丝体生物量最高,达到386 mg/100 mL,pH 3时菌丝体生物量最低,为169 mg/100 mL。培养基pH偏酸或偏碱时,都不适宜菌丝体生长。因此可将pH 7选为多形炭角菌菌丝体液体发酵培养的最适pH。
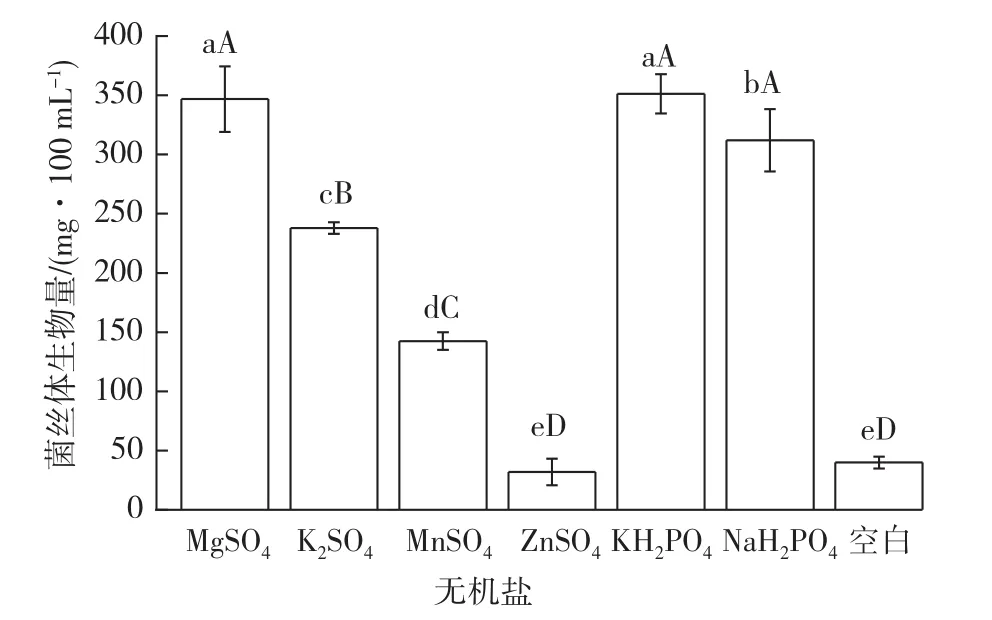
图7 不同无机盐对菌丝体生长的影响
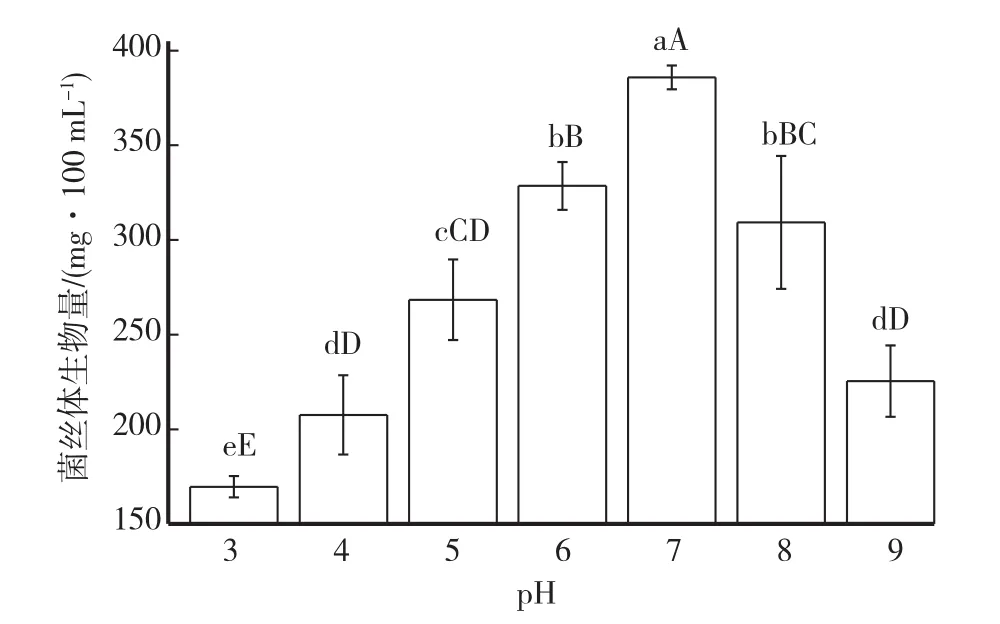
图8 不同pH对菌丝体生长的影响
2.7 不同温度对菌丝体生长的影响
不同温度对多形炭角菌菌丝体生物量影响如图9所示。培养温度15~25℃,随着温度的上升,菌丝生长速度加快,于25℃时菌丝体生物量最高,达到424 mg/100 mL,与其他温度相比均达到极显著水平(P<0.01)。因此,最适培养温度为25℃。
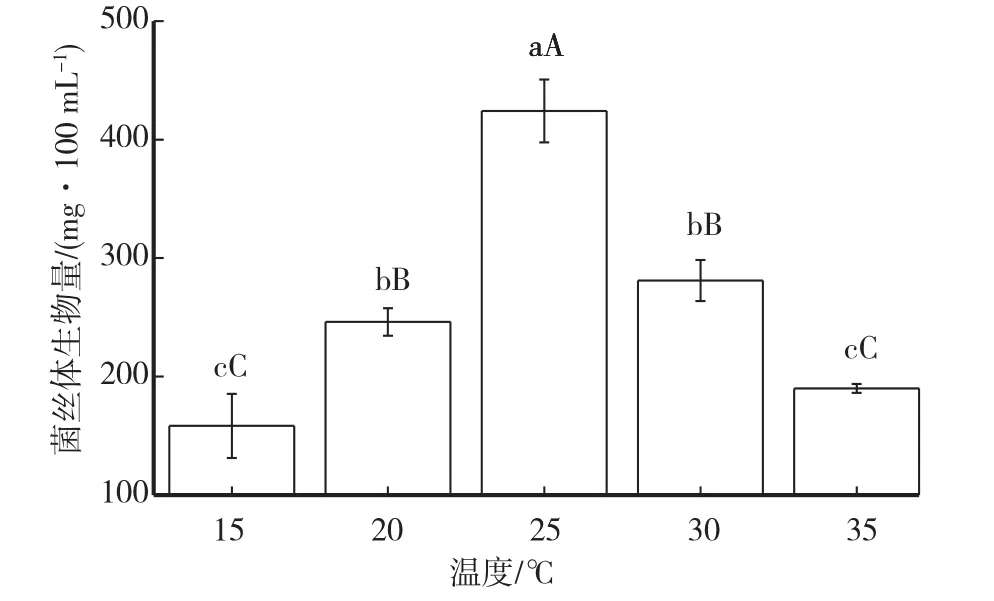
图9 不同温度对菌丝体生长的影响
3 小结与讨论
天然药用炭角菌资源非常稀少,子实体的人工栽培技术尚未成熟,利用现代生物技术进行液体深层发酵,可以得到大量的菌丝体和代谢产物[7]。探究多形炭角菌菌丝体液体发酵培养的最佳营养条件和最适环境条件,了解其生长特性,提高菌丝体产量,对炭角菌研究具有重要意义。多形炭角菌液体培养最佳碳源为葡萄糖,结果与栾洋等[8]的报道类似。炭角菌不仅能通过渗透作用直接吸收单糖,而且能分泌淀粉酶等胞外酶,将淀粉等分解成葡萄糖后吸收[9]。菌丝体能有效利用有机氮,而几乎不能利用无机氮源。分析原因可能是由于有机氮除提供氮源外,还提供一定的碳素营养和生长因子,从而促使营养平衡和物质转化[10]。供试无机盐中磷酸二氢钾、硫酸镁对菌丝体生长有一定的促进作用,K、Mg、P是多形炭角菌生长必需的大量元素。
野生菌株T-18属于多形炭角菌(Xylaria polymorpha),菌丝生长的最适温度为25℃,最适pH为7.0,最适碳、氮源分别为葡萄糖和牛肉膏,添加一定量的MgSO4和KH2PO4有利于菌丝体的生长。

