血清胆红素水平和房颤的关系
吴英乐,程帅锋,陈 润,范孟楠,杜来景
心房颤动(atrial fibrillation,AF)是一种临床上最常见的心律失常,很多研究已经证实高血压、糖尿病、心血管疾病、肥胖、代谢综合征及慢性肾脏疾病等均为心房颤动危险因素[1-3],近年来有研究表明AF与炎症反应及氧化应激相关[4-5]。近几十年来,胆红素(serum bilirubin)作为重要的内源性抗炎和抗氧化剂分子的认识已经增加,但关于血清胆红素水平与心房颤动发生之间的关系国内外相关报道较少,且结果并不统一。本研究旨在探讨胆红素水平与心房颤动的关系,并探讨其临床意义。现报道如下。
1 资料与方法
1.1 临床资料选择2017年9月至2018年7月在我院住院的心房颤动患者98例作为观察组,同期住院的年龄、性别匹配的非心房颤动患者80例为对照组。以心电图、动态心电图或电生理检查记录到心房颤动为诊断标准。排除以下情况者:急性感染、风湿病活动期、免疫系统疾病、严重肝肾功能不全、肿瘤、急性冠状动脉综合征、心力衰竭、先天性心脏病、瓣膜性心脏病、心肌病、使用抗炎抗氧化药物、使用利尿剂。两组一般临床资料比较见表1。
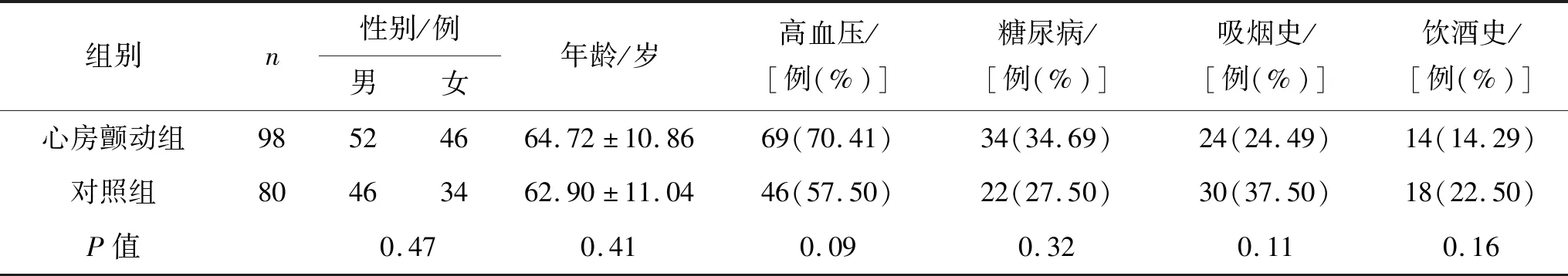
表1 两组一般临床资料比较
1.2 研究方法
1.2.1 体格检查及辅助检查所有患者均记录一般生命体征;入院24 h抽取空腹静脉血,检测血常规、凝血常规、肝肾功能、电解质、血糖血脂;入院行心电图及超声心动图检查。
1.2.2 用药史详细记录每位入选患者β受体阻滞剂(beta-blockers, β-blockers)、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors, ACEIs)、血管紧张素受体拮抗剂(angiotensin receptor blockers, ARBs)、钙拮抗剂(calcium channel blockers, CCBs)及他汀类(statins)药物的应用情况。
2 结果
2.1 两组用药情况比较两组患者既往使用β-blockers、ACEIs、ARBs、CCBs及Statins药物情况差异无统计学意义,见表2。
2.2 两组实验室检查结果比较观察组尿酸(uric acid, UA)高于对照组(P<0.05),对照组血清胆红素水平明显高于观察组,总胆红素(14.45±5.94) VS (11.96±4.38),P=0.008;直接胆红素(2.79±1.44) VS (2.07±0.83),P=0.001;间接胆红素(11.66±4.94) VS (9.88±3.97),P=0.026。其他检查结果差异无统计学意义,见表2。
2.3 心脏超声结果比较两组间左心房直径(left atrial diameter, LAD)、左心室射血分数(left ventricular ejection fraction, LVEF)相比差异有统计学意义,室间隔厚度(interventricular septal thickness, IVST)、左心室舒张末期内径(left ventricular end diastolic diameter, LVEDD)、左心室后壁厚度(left ventricular posterior wall thickness, LVPWT)差异无统计学意义。见表2。
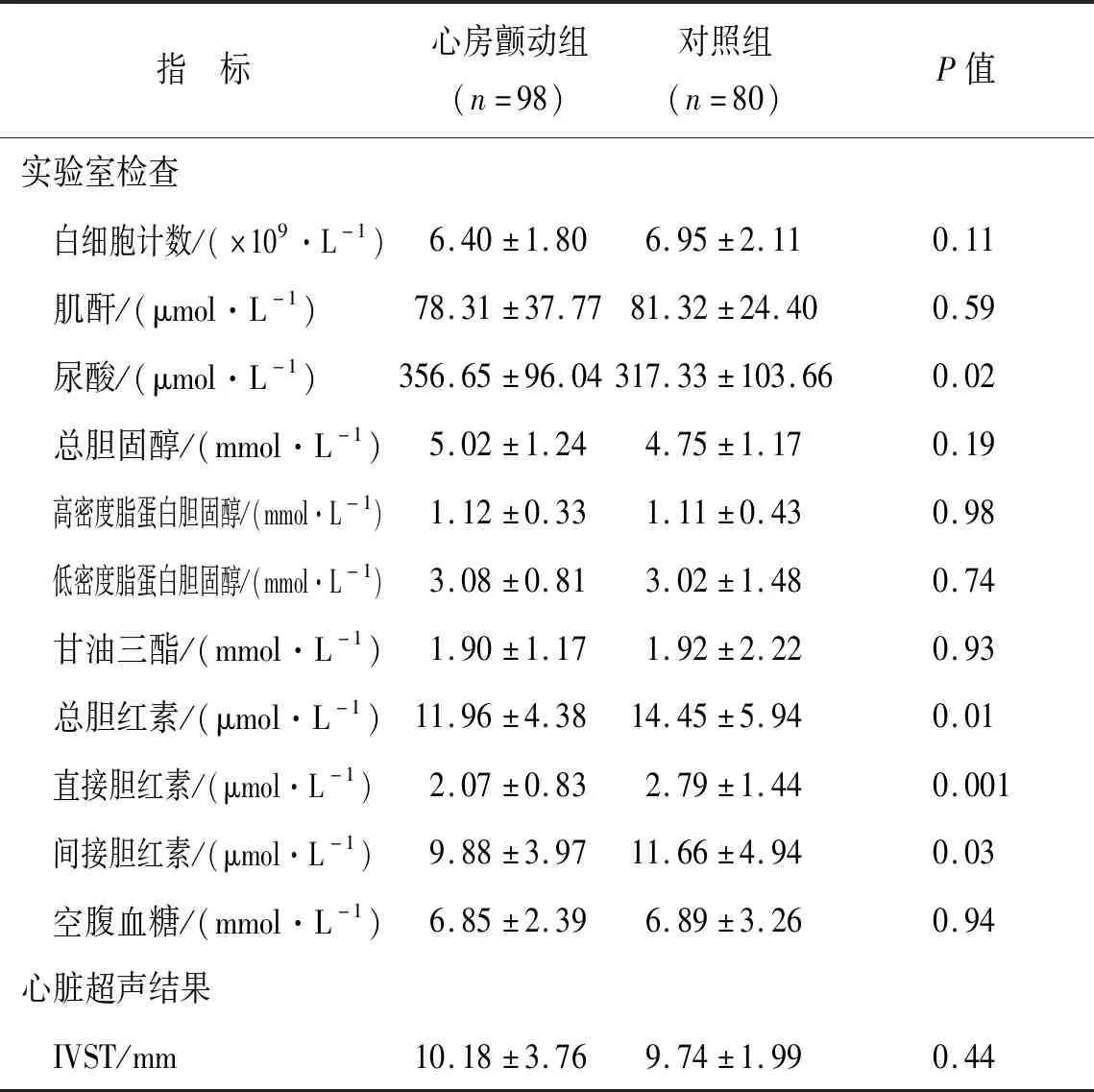
表2 两组实验室指标、心脏超声指标及既往用药史比较
续表
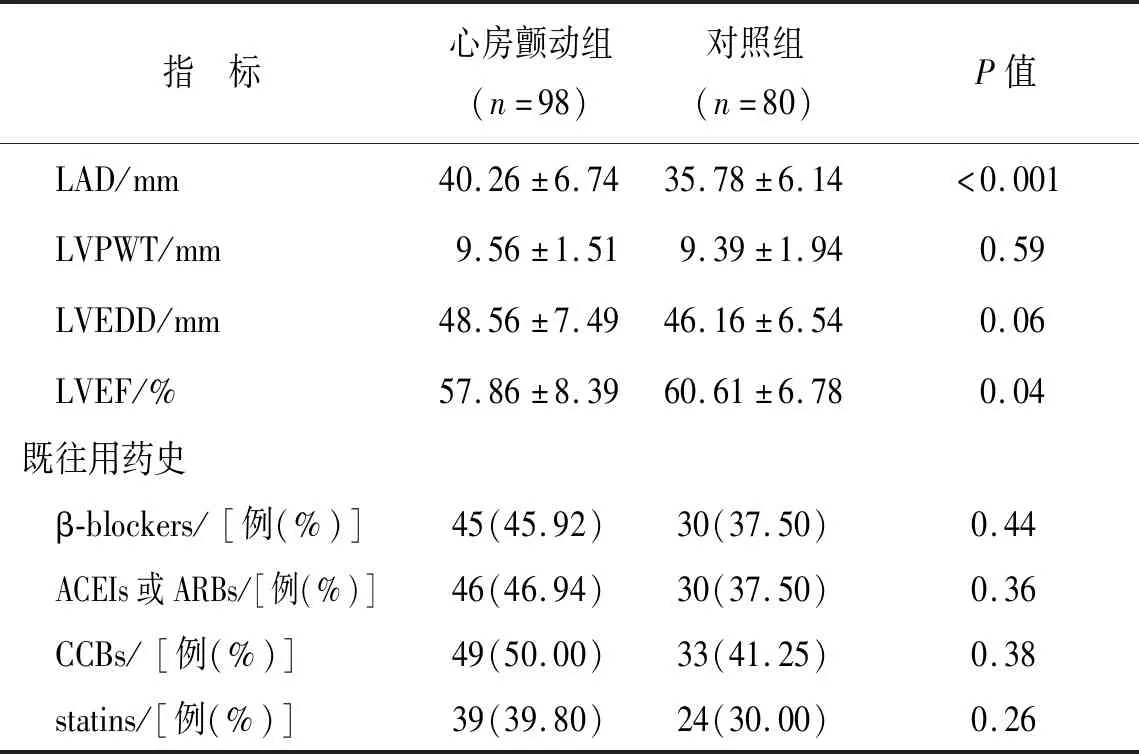
指 标心房颤动组(n=98)对照组(n=80)P值 LAD/mm40.26±6.7435.78±6.14<0.001 LVPWT/mm9.56±1.519.39±1.940.59 LVEDD/mm48.56±7.4946.16±6.540.06 LVEF/%57.86±8.3960.61±6.780.04既往用药史 β-blockers/[例(%)]45(45.92)30(37.50)0.44 ACEIs或ARBs/[例(%)]46(46.94)30(37.50)0.36 CCBs/[例(%)]49(50.00)33(41.25)0.38 statins/[例(%)]39(39.80)24(30.00)0.26
注:IVST:室间隔厚度,LAD:左心房直径,LVPWT:左心室后壁厚度,LVEDD:左心室舒张末期内径,LVEF:左心室射血分数,β-blockers:β受体阻滞剂,ACEIs:血管紧张素转换酶抑制剂,ARBs:血管紧张素受体拮抗剂,CCBs:钙拮抗剂,Statins:他汀类。
2.4 多元Logistic回归分析结果以心房颤动发生与否(无:0,有:1)为因变量,以总胆红素、血清尿酸、LAD、LVEF为自变量进行Logistic回归分析显示,左心房直径为阵发心房颤动的独立危险因素,胆红素为独立保护因素。见表3。
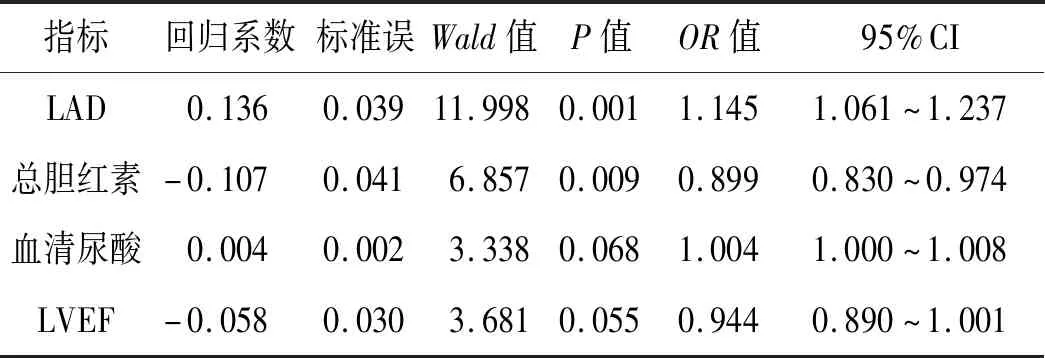
表3 心房颤动患者 Logistic回归分析结果
注:LAD:左心房直径,LVEF:左心室射血分数。
3 讨论
尽管进行了100多年的深入研究,但对AF仍未充分了解且临床治疗仍具有挑战性[6-10]。通常认为AF与心房的结构和电重构相关联[8-11],其传统病因包括冠心病、高血压、风湿性心脏病等。近年越来越多的研究提示炎症、氧化应激、肥胖等因素是心房颤动发生发展的危险因素[4-5,12]。氧化应激和炎症激活是相互关联的通路,促进心房电和结构重塑,导致心房异位搏动和间质纤维化[5]。在AF患者及AF的动物模型中,均提示氧化应激与AF的发展有关[13-16],并且抗氧化药物已经显示出对AF发展的有益效果[14-16]。此外,AF的患病率随着年龄的增长而增加,而氧化损伤的年龄依赖性增加是广泛认可的[17]。房颤患者的心房活检标本也可见炎性细胞浸润和纤维化[18]。
胆红素曾被认为只是血红素加氧酶降解血红素代谢的最终产物,现已成为一种重要的内源性抗炎和抗氧化分子。它是生理条件下的有效抗氧化剂,无论是游离的还是白蛋白结合的胆红素,均有抗氧化作用[19],表明胆红素可能是细胞应对氧化应激的防御策略的一部分。血清胆红素可能通过清除氧自由基及其对低密度脂蛋白(low-density lipoprotein,LDL)氧化的抑制作用来预防实验性动脉粥样硬化[20]。有动物实验提示,胆红素通过清除活性氧物质信号中间体来破坏内皮VCAM-1和ICAM-1介导的白细胞迁移,从而抑制小鼠的动脉粥样硬化斑块形成[21]。越来越多的研究表明胆红素水平与心血管疾病呈负相关,并与疾病的严重程度和死亡率均存在负相关,提示胆红素可能是心血管疾病的保护因子[22]。
目前关于血清胆红素水平与心房颤动发生之间的关系国内外相关报道较少,且结果并不统一。Demir等[23]发现,血清胆红素水平与房颤呈负相关,AF患者的胆红素水平明显低于非房颤患者;然而有研究[24-25]却提示房颤患者血清胆红素水平较非AF患者明显升高。
本研究发现,观察组的总胆红素、直接胆红素及间接胆红素均低于对照组(P<0.05);且Logistic回归分析显示,血清胆红素是CIN的独立保护性因子。提示胆红素可能预防房颤的发生及发展;提示相对较高的血清总胆红素有助于降低AF风险,其合理生物学机制可能是血清胆红素的抗氧化作用及抗炎作用。但是心房颤动的发生发展有着更深层次的未知因素,发生机理尚不完全清楚,且在疾病发生发展过程中,胆红素水平有无变化需要进一步研究。
本研究发现观察组中,阵发房颤患者(66例)与持续房颤患者(32例)胆红素水平相比,阵发房颤患者总胆红素水平低于持续房颤患者,但直接胆红素及间接胆红素水平无统计学差异[总胆红素(11.04±2.70) VS (13.40±5.93),P=0.048;直接胆红素(1.97±0.80) VS (2.24±0.85),P=0.153;间接胆红素(9.07±2.26 ) VS (11.15±5.53),P=0.058],考虑其可能的原因为一方面持续房颤患者样本量偏少,存在数据偏差;另一方面持续房颤患者胆红素水平可能是被动升高,仍需要进一步论证。
本研究存在一些局限性,一方面,虽然发现胆红素水平与心房颤动呈负相关,但未细化阵发房颤、持续房颤及永久性房颤,亚组分析不够,虽然后期对比了持续房颤与阵发房颤胆红素水平的区别,但样本量偏少,研究结果可能存在偏差;另一方面,本研究为单中心、回顾性研究,未进行长期随访队列研究。因此,更有效地证实胆红素对AF的保护作用仍需要多中心、大样本量且长期随访的研究。
总之,目前本研究发现了AF和血清胆红素之间可能存在的关联。从代谢的角度来看,胆红素在正常范围内升高,对AF可能是一个保护因素,对临床有一定指导意义,但仍需要大规模研究来论证。

