鱼藤素诱导肺癌细胞凋亡和细胞周期阻滞的分子机制
陈彦洁,柳传毅,吕满霞,方琼彤,吴新荣
(1. 中国人民解放军南部战区总医院药剂科,广东,广州 510010;2. 华南理工大学食品科学与工程学院,广东,广州 510641)
鱼藤素(deguelin)是一种黄酮类化合物,化学式为C23H22O6,分子质量394.42,熔点为171 ℃,常温常压下为黄色晶体粉末。近年来,大量文献表明,鱼藤素具有明显的抗肿瘤活性,对肿瘤不仅在化学预防,而且在化学治疗方面有明显的作用[1-5],对多种肿瘤细胞,如肺癌、乳腺癌、前列腺癌、支气管上皮细胞癌等都具有抑制增殖的作用。肺癌的死亡率和发病率位于全球前列,Lee等[6]在研究吸烟引起的肺部肿瘤时,用多种化合物进行体外研究,发现鱼藤素作用于磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路,抑制Akt磷酸化,使细胞停滞在G2/M期,从而抑制非小细胞肺癌扩散,得出鱼藤素对早期肺癌有潜在治疗效果的结论。一系列的药学研究肯定了鱼藤素对肺癌的治疗作用,Xu等[7]的研究表明,鱼藤素通过激活活性氧(reactive oxygen species,ROS),抑制Akt磷酸化,激活凋亡蛋白caspase-3,使肺癌细胞凋亡。Jia等[8]的研究显示,鱼藤素还能抑制淋巴血管内皮细胞管腔的形成。
现已报道,鱼藤素或通过阻滞细胞周期、诱导细胞凋亡、抑制血管生成、阻碍细胞迁移和调控新陈代谢等方面,达到抑制肿瘤细胞增殖的作用[9-12]。研究表明,90%的肿瘤死亡是由肿瘤细胞侵袭并迁移到重要的脏器导致,是临床上危害癌症患者生命的重要因素[13],因此,抑制肿瘤细胞增殖和迁移对于肿瘤治疗至关重要。课题组前期检测了鱼藤素对人非小细胞肺癌H1299和A549细胞、人乳腺癌MCF-7细胞、人宫颈癌Hela细胞、人前列腺癌PC-3细胞存活率的影响,其中对H1299细胞的抑制效果最佳。故本研究以H1299细胞作为模型,探究鱼藤素是否通过调控细胞周期来阻断细胞增殖,抑制其迁移,达到抗非小细胞肺癌的作用。
1 材料
1.1 细胞株人非小细胞型肺癌细胞株H1299,由中国科学院上海生命科学院细胞库提供。
1.2 药物与试剂鱼藤素、二甲基亚砜(DMSO),均购自Sigma公司;胎牛血清,Gibco公司;胰酶、PBS缓冲液,HyClone公司;CCK-8检测试剂盒(批号CK04),日本同仁化学研究所;细胞周期与凋亡检测试剂盒(批号1052),碧云天生物技术研究所;AnnexinV-FITC/PI双染凋亡检测试剂盒(批号AD10),日本同仁化学研究所。
1.3 仪器二氧化碳培养箱、Multiscan-GO全波长酶标仪(美国Thermo公司);IX7型倒置荧光显微镜(日本Olympus公司);YSK-239型低温高速离心机(Sigma公司);FACSCalibur流式细胞仪(美国BD公司);IncuCyte S3长时间动态活细胞成像分析仪(美国Essen BioScience公司)。
2 方法
2.1 药物的配制100 mmol·L-1鱼藤素母液配制:在DMSO溶液中溶解适量鱼藤素,并在-20 ℃避光保存,不同浓度的鱼藤素用培养基稀释,现配现用。
2.2 细胞培养将冻存在液氮罐中的H1299细胞取出,放入水浴锅中迅速融解,吸至15 mL离心管中,离心,弃上清,用新鲜培养基将细胞吹打至细胞悬液,分装至培养瓶中,待细胞生长至对数期时用于实验。
2.3 CCK-8测定细胞存活率细胞以5×107·L-1的密度铺于96孔板中,每孔100 μL,共铺3板,于CO2恒温培养箱中培养24 h,待细胞贴壁。用含血清的完全培养基将鱼藤素稀释成1.562 5、3.125、6.25、12.5、25、50 μmol·L-1,对照组为对应的完全培养基。加药培养24、48、72 h后,弃培养基,加入不含血清的培养基稀释的10% CCK-8试剂,空白组为10% CCK-8试剂。置于培养箱中孵育4 h后,测定其在450 nm波长下的吸光度(OD)值。计算存活率/%=[(OD实验组-OD空白组)/(OD对照组-OD空白组)]×100%,实验平行重复3次。
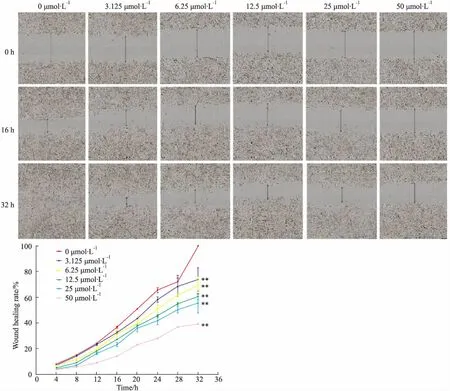
2.4 细胞划痕实验细胞以2×108·L-1密度铺于96孔板中,每孔100 μL,培养24 h待细胞贴壁后取出,弃培养基,用自动划痕仪划痕后,PBS缓冲液洗涤后,加药处理。用完全培养基将鱼藤素稀释成3.125、6.25、12.5、25、50 μmol·L-1,每组设6个复孔。给药后,置于装有长时间动态活细胞成像分析仪的CO2恒温培养箱中培养,随机选取8个视野观察,每隔4 h采集图像1次,连续观察32 h,所得图像数据用Image J软件分析处理。采用边缘迁移距离法,测定每个时间点的划痕宽度,划痕愈合率/%=(最初的划痕宽度-测量时间点的划痕宽度)/最初的划痕宽度×100%,实验平行重复3次。
2.5 PI单染测定细胞周期将细胞以1×108·L-1的密度铺于6孔板中,每孔2 mL。用完全培养基将鱼藤素稀释成1.5、3、6 μmol·L-1,对照组为完全培养基。给药24 h后取出6孔板,将细胞收集于离心管中。细胞以1 000 r·min-1离心5 min,弃上清液。每管各加入0.5 mL配制好的碘化丙啶(PI)染色液,重悬细胞,避光孵育30 min后,转移至流式管中,于流式细胞仪在激发波长488 nm进行检测。样品检测完毕后,收集数据,采用FlowJo软件进行细胞DNA含量分析。
2.6 Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡率细胞分组给药同“2.5”,药物作用24 h后,收集细胞于离心管中,1 000 r·min-1离心5 min,加入500 μL 1×结合缓冲液,5 μL Annexin V-EGFP和5 μL PI混匀,避光孵育20 min,上流式细胞仪检测。
2.7 qPCR检测周期蛋白依赖性激酶(cyclin-dependent kinases, CDKs)CDK4、CDK6和特异性细胞周期蛋白D1(cyclin D1,CCND1) mRNA表达NCBI网站上查得人的CDK4、CDK6和CCND1的cDNA序列,通过Premier 6.0软件设计引物。引物均由华大基因合成,引物序列见Tab 1。细胞分组及给药同“2.5”。细胞给药24 h后,弃上清,PBS清洗。Trizol裂解液裂解细胞,加入氯仿震荡后,静置,4 ℃、12 000×g离心15 min。离心完毕,倾斜取上层水相和等体积的异丙醇混匀离心,弃上清得总RNA。按照反转录试剂盒进行反转录反应。配制反应体系,按照说明书加入去除DNA反应液,去除总RNA中的DNA。随后,在上述反应液中加入反转录试剂,使得上述反应液条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃ 2 min。反应后保存于-20 ℃冰箱待用。配制qPCR反应体系,同样配制反应体系时先配制一个主混合液[SYBR® Premix Ex TaqTMⅡ(2×)、ROX Reference Dye or Dye Ⅱ(50×) 和dH2O],其体积按照实际反应数量加2的反应总体积配制,然后分装于每个反应管中。标记反应管,并向其中小心加入对应的基因上、下游引物,最后每个反应管中加入2 μL的cDNA溶液,按照设定的条件进行qPCR反应。平行测定3次,采用2-△△CT法分析目的基因的相对表达量。
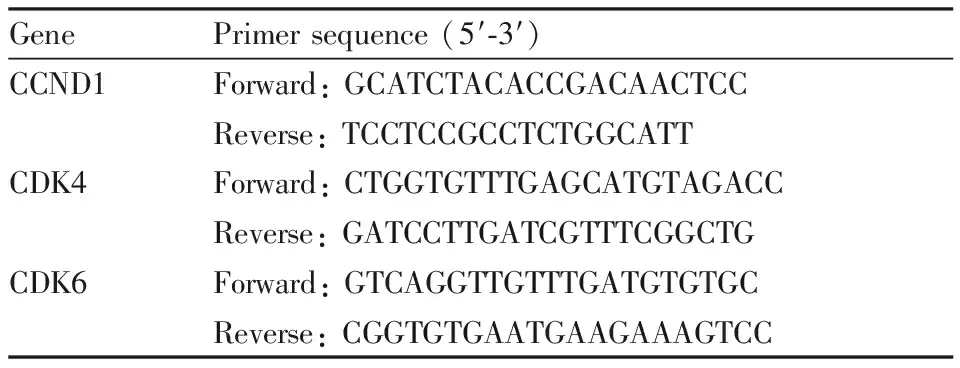
Tab 1 Primer sequences

3 结果
3.1 鱼藤素对H1299细胞存活率的影响不同浓度的鱼藤素处理H1299细胞24、48、72 h后,其细胞存活率见Fig 1。与对照组相比,药物作用24 h后,随着鱼藤素浓度的增加,H1299细胞的存活率明显降低(P<0.01),鱼藤素处理后的H1299细胞存活率随着药物处理时间的延长而减弱,表明鱼藤素对H1299细胞的增殖有明显抑制作用。
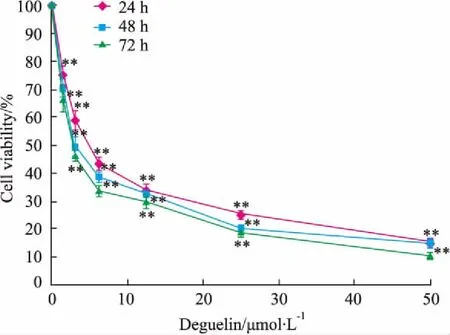
Fig 1 Effects of deguelin treatment 24, 48, 72 h on cell viability of H1299 cells ( n=3)
**P<0.01vscontrol group
3.2 鱼藤素对H1299细胞迁移能力的影响不同浓度的鱼藤素处理H1299细胞共32 h,每隔4 h采集1次图像。用ImageJ软件处理分析数据,得出鱼藤素处理后的划痕宽度随时间的变化和宽度愈合率见Fig 2。与空白对照组相比,鱼藤素处理组的划痕宽度明显加大,且随浓度越来越宽。从细胞划痕愈合率的变化趋势也可看出,鱼藤素32 h时明显抑制了H1299细胞划痕的愈合能力(P<0.01),并与浓度呈正相关。
3.3 鱼藤素对H1299细胞周期的影响不同浓度的鱼藤素处理H1299细胞24 h后,PI单染结果见Fig 3、Tab 2。最左边的峰值区域代表G0/G1期的细胞数目,相对于空白对照组,鱼藤素处理组处于G0/G1期的细胞百分比明显增加(P<0.05),即鱼藤素(1.5、3、6 μmol·L-1)阻滞H1299细胞的细胞周期于G0/G1期。
Tab 2 Percentage of cell distribution after 24 h treatment with deguelin in H1299 cells n=3)
*P<0.05,**P<0.01vscontrol group
3.4 鱼藤素对H1299细胞凋亡的影响不同浓度鱼藤素处理H1299细胞24 h后,Annexin-V FITC/PI双染结果见Fig 4。与对照组相比,随着鱼藤素浓度的增加,早期凋亡和晚期凋亡的细胞比例逐渐增大。1.5 μmol·L-1鱼藤素处理组晚期凋亡细胞所占比例相较于对照组明显增加(P<0.05)。鱼藤素(3、6 μmol·L-1)组的早期凋亡和晚期凋亡细胞所占比例相比对照组均明显增加(P<0.01),说明鱼藤素可诱导H1299细胞凋亡,使细胞早期和晚期凋亡率均明显增加。
3.5 鱼藤素对CDK4、CDK6、CCND1 mRNA表达的影响如Fig 5所示,鱼藤素(1.5、3、6 μmol·L-1)处理H1299细胞24 h,与对照组相比,CDK4、CDK6、CCND1 mRNA表达水平均明显下调(P<0.01)。表明鱼藤素能够使H1299细胞中CDK4、CDK6和CCND1基因的表达下调。
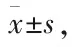
**P<0.01vscontrol group
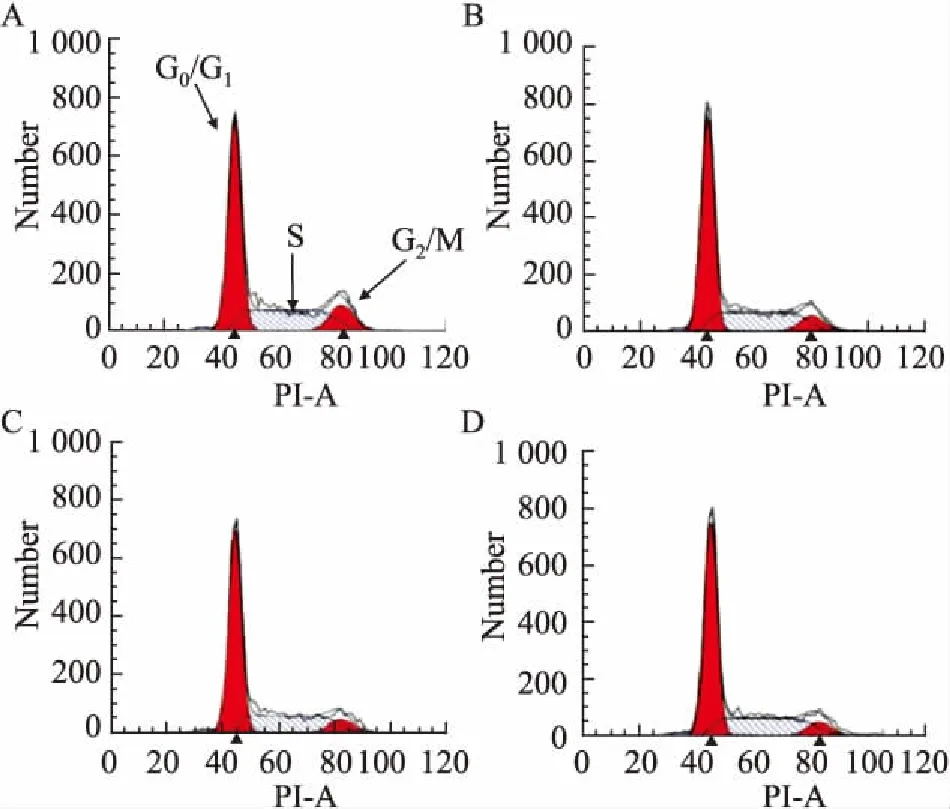
Fig 3 Cell cycle diagram of PI staining in H1299 cells treated with deguelin for 24 h
A:0 μmol·L-1deguelin;B:1.5 μmol·L-1deguelin;C:3 μmol·L-1deguelin;D:6 μmol·L-1deguelin
4 讨论
细胞周期调控系统是建立在周期蛋白依赖激酶的酶家族活性的基础上,采用以该激酶家族为核心成分,同时以细胞周期蛋白、调控蛋白和细胞周期蛋白依赖性激酶抑制蛋白等为辅的机制对细胞周期进行调控。细胞周期蛋白是CDK活性的主要决定成分,可分为G1细胞周期蛋白、G1/S细胞周期蛋白、S细胞周期蛋白和M细胞周期蛋白。G1细胞周期蛋白在起始检验点结合并激活CDKs,促进细胞进入新细胞周期的一类细胞周期蛋白,其浓度不依赖细胞周期阶段,而依赖细胞生长或生长促进信号。G1/S细胞周期蛋白是促进细胞周期通过起始检验点的一类细胞周期蛋白。董杨等[14]研究发现,橘红素能够抑制细胞外调节蛋白激酶(extracellular regulated protein kinases)磷酸化,上调Cyclin B1蛋白表达,使细胞阻滞于S期和G2/M期。李敬美等[15]研究发现,血管紧张素Ⅱ诱导H9c2心肌细胞肥大发生的病理过程与细胞周期调控因子的震荡性表达相关,各因子共同促进细胞肥大反应。同时提示在持续病理性刺激下,即使一些细胞周期正调控因子表达水平持续升高,细胞周期仍然被阻滞,致使细胞无法正常分裂。

Fig 4 Apoptosis diagram of Annexin-V FITC/PI staining in H1299 cells treated with deguelin for 24 h n=3)
A:0 μmol·L-1deguelin;B:1.5 μmol·L-1deguelin;C:3 μmol·L-1deguelin;D:6 μmol·L-1deguelin.*P<0.05,**P<0.01vscontrol group.
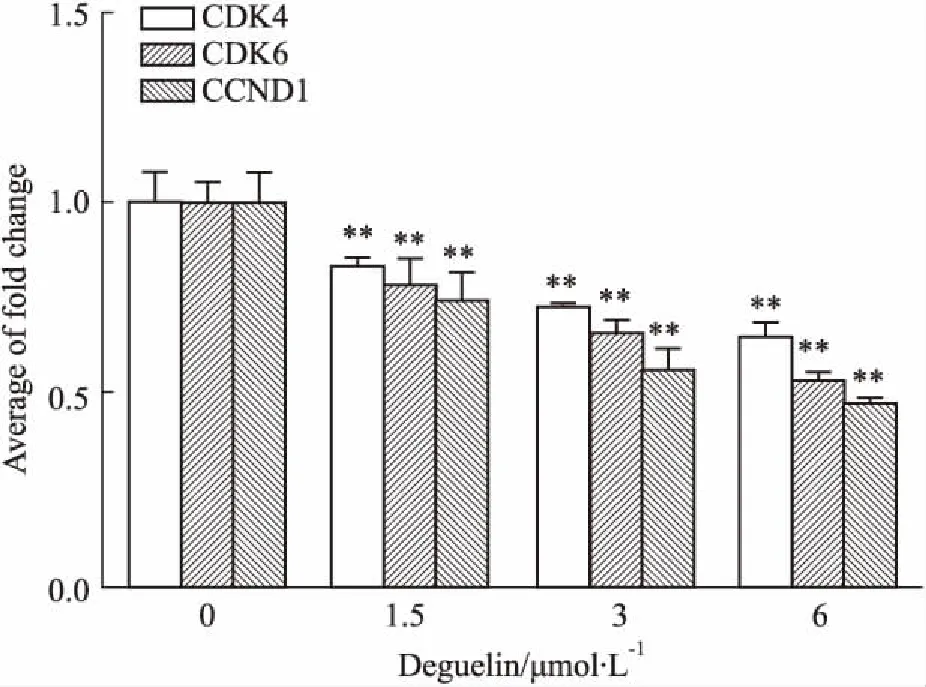
Fig 5 Effects of deguelin on expression of CDK4, CDK6 and CCND1 mRNA in H1299 cells n=3)
**P<0.01vscontrol group
Cyclin D-CDK4/6复合体是细胞周期G1/S检验点的关键因子,对细胞增殖至关重要。当Cyclin D-CDK4/6复合体异常活化时,会导致细胞增殖异常,最后演变成肿瘤,研究发现,大部分恶性肿瘤中该复合体有一定的异常[16-17]。减弱Cyclin D1-CDK4/CDK6复合体对视网膜膜细胞瘤蛋白(Retinoblastoma)的磷酸化,使E2F转录因子不能正常进入细胞核中参与基因转录,从而阻滞细胞周期于G1/S期。细胞周期蛋白与某些肿瘤的发生有直接相关性,对肿瘤的治疗与预后也有重要意义。
肺癌是我国发病率和死亡率最高的癌症之一,而80%~85%的肺癌都是非小细胞肺癌,对肺癌进行有效的治疗和预防成为我国癌症研究中一个急迫的方向。目前,肺癌的治疗手段有外科手术、放疗、靶向治疗等,但是传统的肿瘤治疗手段容易产生严重的不良反应,乃至耐药性,开发低毒、可持续抗肿瘤的药物对肺癌的治疗十分重要。本研究证明,鱼藤素能抑制非小细胞肺癌H1299细胞的增殖,划痕实验证明其抑制细胞的运动迁移能力,且鱼藤素可通过下调细胞周期调控系统中的CDK4、CDK6、Cyclin D1的基因表达来调控细胞周期,阻滞细胞周期,从而达到抗肿瘤作用,为鱼藤素抗非小细胞肺癌提供了新的科学依据。
(致谢:本实验在中国人民解放军南部战区总医院医学实验科完成,特别感谢实验室老师的指导与帮助。)