酸敏感离子通道-1a在急性肺损伤大鼠肺组织中的表达及作用初探
孙礼宾,朱月琴,潘学胜,王亚男,陈莹瑛,陈 运,刘敬浩,叶 莹,胡成穆,黄 艳
(1. 安徽医科大学附属巢湖医院儿科,安徽 合肥 238000; 2. 安徽医科大学药学院,安徽 合肥 230032; 3. 安徽医科大学校医院,安徽 合肥 230032)
急性肺损伤(acute lung injury,ALI)是由脓毒血症、创伤、休克等心源性以外的各种肺内、外因素所致的急性缺氧性呼吸衰竭,主要表现是难治性低氧血症和呼吸窘迫,若不能及时控制病情,将进一步发展为更严重的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1]。其以肺容积减少、肺顺应性降低、通气/血流比例失调为病理生理特征,肺部影像学上表现为非均一性的渗出性病变[2-3]。该病起病急骤,病情发展迅速,预后极差,致死率高达30%以上[4]。自1967年,Ware等[5]首次报道肺损伤以来,关于ALI的研究层出不穷,并且取得了较大的进展,但患病率和致死率仍居高不下。因此,关于ALI的发病机制及临床治疗的研究,是临床危重病学领域备受关注的焦点和重要的研究方向。
酸敏感离子通道(acid sensitive ion channels,ASICs)是一类阳离子通道蛋白复合体,为上皮钠通道(epithelial sodium channel, ENaC)超家族的一员。有研究显示,能否有效清除肺泡中过多的液体是治疗ALI的关键,而ENaC在肺水肿液的清除中扮演重要角色[6-8]。ASICs作为ENaC家族的一员,在炎症(关节炎)、缺血、肿瘤等伴有组织酸化的疾病中,也发挥着重要的病理生理作用[9]。ALI的前期阶段即伴肺脏炎症,局部的炎症反应可导致局部组织酸化。其是否诱导肺内ASICs表达及活性变化,此变化在ALI中是否发挥作用?目前国内外无相关研究。ASIC1a是ASICs亚基中能通透Ca2+的主要亚基,当胞外pH下降时可被激活[10]。阿米洛利可以阻断ENaC Na+/H+交换体和Na+/Ca2+交换体,是ASICs的非特异性阻断剂[11]。课题组前期研究发现,在脂多糖(lipopolysaccharides,LPS)诱导的ALI大鼠肺组织中,ASIC1a的表达明显上调,可能与ALI的发生、发展有关。因此,本课题拟在课题组前期研究基础上,探讨ASIC1a通道在LPS诱导的ALI大鼠模型肺组织中表达及活性的变化,此变化对大鼠ALI进程的影响,为进一步完善ALI的发病机制研究提供依据,同时也为ALI的防治和新药研发提供新的靶点和思路。
1 材料与方法
1.1 材料
1.1.1实验动物 32只♂SD大鼠,SPF级,体质量180~220 g,由安徽医科大学实验动物中心提供,实验动物生产许可证编号为SYXK(皖)2017-006。
1.1.2药物与试剂 LPS、阿米洛利(美国Sigma公司);地塞米松(美国Solarbio公司);细胞组织裂解液RIPA、蛋白酶抑制剂PMSF、一抗稀释液(上海碧云天生物技术有限公司);ASIC1a一抗(美国Affinity公司);β-actin一抗(北京博奥森生物技术有限公司);TRIzol裂解液(美国Thermo Fisher公司);ECL显影液(美国Advansta公司);ELISA试剂盒(武汉基因美生物技术有限公司)。
1.1.3仪器 Centrifuge 5424R冷冻离心机(德国Eppendorf公司);酶标仪MK3(荷兰雷勃公司);Western blot设备、化学发光成像系统(美国Bio-Rad公司 );荧光倒置显微镜 (日本Olympus公司);FA2004型电子天平 (上海精天天平厂)。
1.2 方法
1.2.1大鼠ALI模型的建立 32只♂SD大鼠按随机数字表法分为4组:正常对照组(Control组)、ALI组(Model组)、阿米洛利组(Amiloride组)、阳性药物组(Dex组)。正常组和模型组各腹腔注射生理盐水2 mL,阿米洛利组和阳性药组分别腹腔注射2 mL阿米洛利(10 mg·kg-1)和2 mL地塞米松(5 mg·kg-1),30 min后,正常组腹腔注射1 mL生理盐水,其余3组腹腔注射1 mL LPS(5 mg·kg-1)。处理完成后,将大鼠放回笼内自由活动,不禁食水。16 h后用戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉后,腹主动脉取血,并取肺组织留存。
1.2.2肺组织病理学分析 取大鼠右肺下叶,4%多聚甲醛固定后,常规石蜡包埋、切片,HE染色,封固。光镜下观察肺组织病理学变化。
1.2.3肺组织湿干重比 湿干重比(wet/dry,W/D)是反映肺含水量的重要指标。取各组大鼠右肺前叶组织,称湿重后,置于70 ℃烘箱内烘干72 h后称干重,计算肺湿干重比。
1.2.4血气分析 大鼠麻醉后,用BD preset动脉采血器腹主动脉取血1 mL,送安徽医科大学第四附属医院检验科做血气分析检测。
1.2.5ELISA法检测血清TNF-α含量 将取出的血液4 ℃、3 000 r·min-1离心10 min,分离出血清,按照ELISA试剂盒说明书检测各标本血清TNF-α水平。每样本和标准品均设双复孔,读取酶标仪450 nm处吸光度(OD)值,并根据OD值绘制标准曲线,计算各样本TNF-α含量,取平均值。
1.2.6免疫组化检测大鼠肺组织ASIC1a表达 取大鼠肺组织右肺叶标本,行免疫组化SP法染色,采用柠檬酸盐缓冲液(0.01 mol·L-1)高温高压抗原修复,常规透膜,5% BSA室温封闭l h,滴加一抗(1 ∶250)4 ℃过夜。HRP标记的二抗(1 ∶1 000) 37 ℃孵育1 h,DAB显色,自来水冲洗终止,苏木精复染10 min后返蓝,烤干组织切片,中性树胶封片,镜下观察。
1.2.7Real-time PCR 使用TRIzol法提取大鼠肺组织总RNA,微量核酸蛋白检测仪测定RNA浓度。将mRNA反转录为cDNA,real-time PCR检测各样本ASIC1a表达,反应条件:95 ℃ 30 s,95 ℃ 5 s,56 ℃ 30 s,72 ℃ 30 s,总共38个循环。以β-actin为内参,每组设3个复孔,重复3次,计算平均值。引物由生工生物工程(上海)股份有限公司设计合成,引物序列见Tab 1。

1.2.8Western blot法检测ASIC1a在肺组织中的蛋白表达 按蛋白提取试剂盒说明书提取肺组织总蛋白,浓度经微量核酸蛋白检测仪测定。各标本取蛋白样品进行10% SDS-PAGE电泳,切胶转膜后,置于5%脱脂牛奶封闭2 h。洗涤,分别孵一抗β-actin(1 ∶1 000)和ASIC1a(1 ∶1 000),4 ℃过夜。TBST洗膜后,加入辣根过氧化酶标记的二抗(1 ∶10 000),室温孵育1 h,洗涤后,加入ECL化学发光法显色成像。用图像分析处理软件测定各条带积分光密度值,以β-actin条带校正。

2 结果
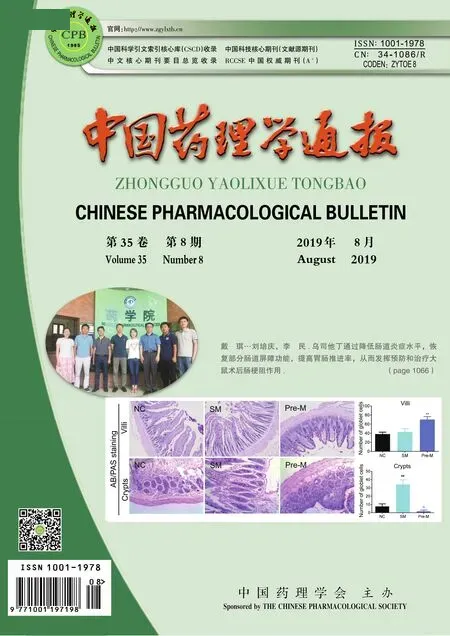
2.1 各组大鼠肺组织病理学变化大鼠肺组织HE染色结果如Fig 1所示,正常组肺泡腔结构清晰,间质血管无充血。模型组肺泡正常结构消失,肺间质水肿增宽,肺泡隔增厚,肺泡腔明显变窄,部分肺泡腔萎陷不张,毛细血管明显扩张,肺泡腔内炎性细胞浸润和大量均质红染样渗出物,微血栓形成。阿米洛利组和阳性药物组大鼠肺间质及肺泡出血渗出较模型组明显减轻。
2.2 各组大鼠肺组织干湿重比的变化肺组织干湿重比(W/D)是反映肺含水量的重要指标。如Fig 2所示,与正常组相比,模型组W/D明显升高(P<0.01)。阿米洛利组和阳性药物组W/D值均明显低于模型组(P<0.01)。
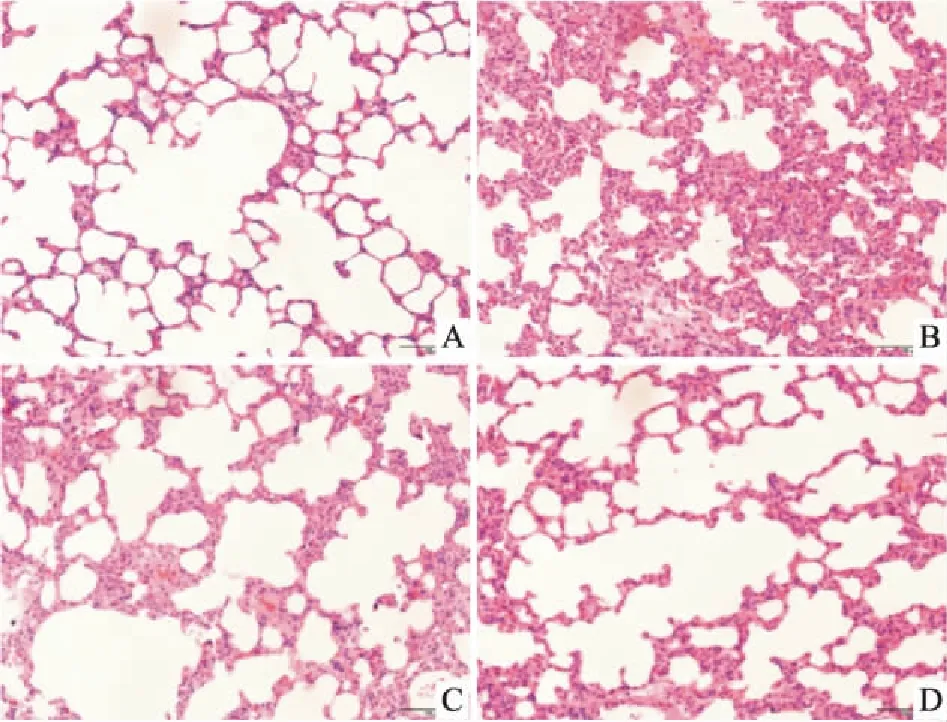
Fig 1 HE staining of lung tissues in each group(×400)
A:Control group;B:Model group;C:Amiloride group;D:Dex group.
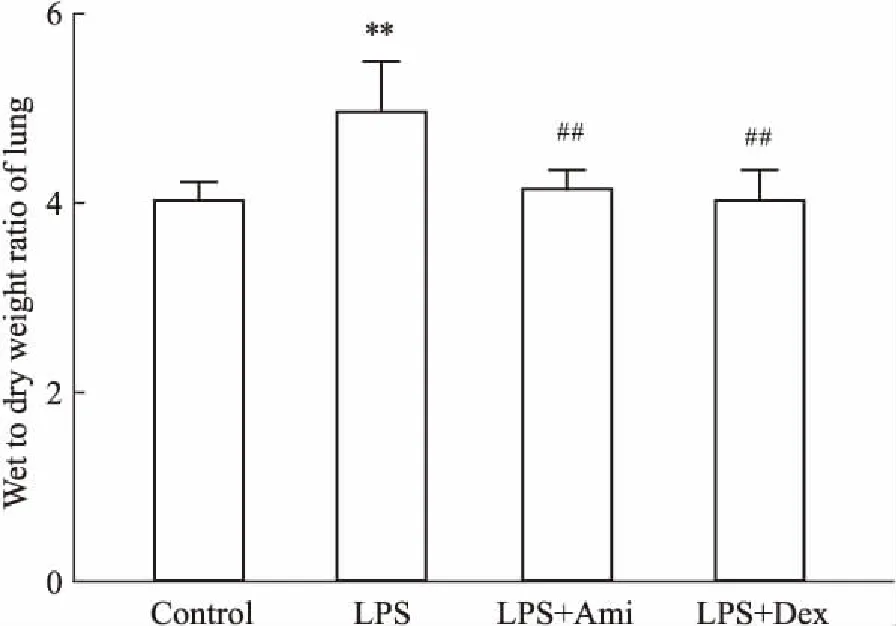
Fig 2 Wet dry weight ratio of lung
**P<0.01vscontrol;##P<0.01vsLPS
2.3 各组大鼠血清中TNF-α表达的变化大鼠血清中TNF-α的表达水平如Fig 3所示,模型组血清中TNF-α水平较正常组明显升高(P<0.01)。阿米洛利组和阳性药物组血清中TNF-α的水平均明显低于模型组(P<0.01)。
Fig 3 Expression of TNF-α in
**P<0.01vscontrol;##P<0.01vsLPS
2.4 各组大鼠血气分析的变化如Tab 2所示,模型组氧气分压和pH值均明显低于正常组(P<0.01),二氧化碳分压明显高于正常组(P<0.01);阿米洛利组和阳性药物组氧气分压和pH值均明显高于模型组,二氧化碳分压明显低于模型组(P<0.01)。

Tab 2 Rat arterial blood gas analysis
**P<0.01vscontrol;##P<0.01vsmodel
2.5 免疫组化检测各组大鼠肺组织中ASIC1a的表达如Fig 4所示,模型组中ASIC1a的表达量较正常组明显增多,阿米洛利组和阳性药物组相比于模型组相对减少。
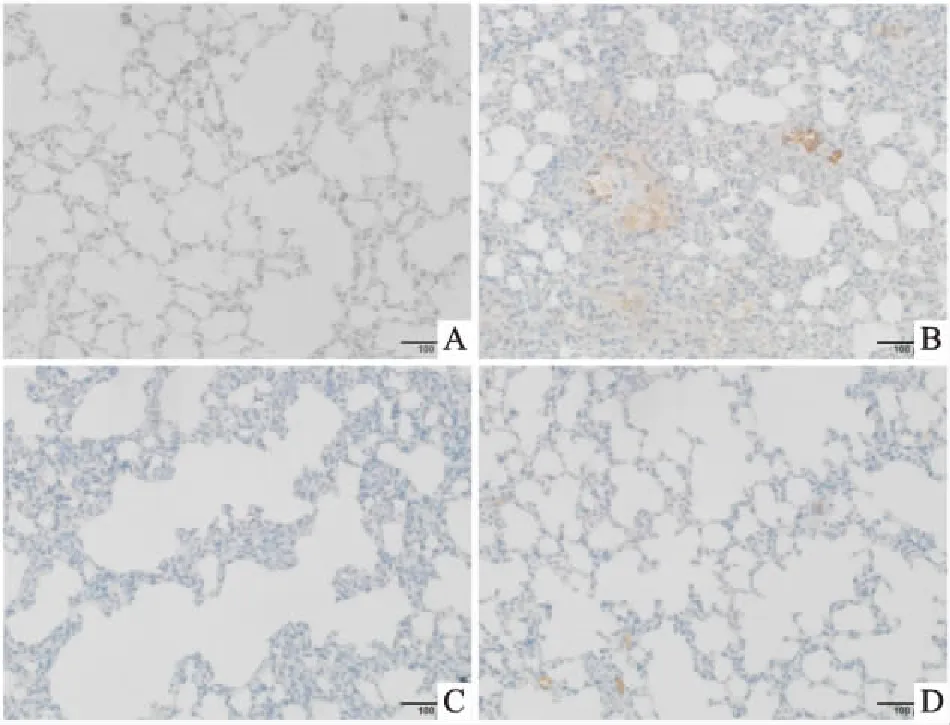
Fig 4 Immunohistochemistry of ASIC1a in lung tissuesof each group(×200)
A:Control group;B:Model group;C:Amiloride group;D:Dex group.
2.6 各组大鼠肺组织中ASIC1a mRNA的表达变化如Fig 5所示,模型组ASIC1a mRNA的表达量明显高于对照组(P<0.01)。阿米洛利组(P<0.01)和阳性药物组(P<0.05)ASIC1a mRNA的表达量与模型组相比明显下降。
2.7 各组大鼠肺组织中ASIC1a蛋白的表达变化如Fig 6所示,模型组ASIC1a蛋白的表达量明显高于对照组(P<0.01)。阿米洛利组(P<0.01)和阳性药物组(P<0.05)ASIC1a蛋白的表达量与模型组相比明显下降。
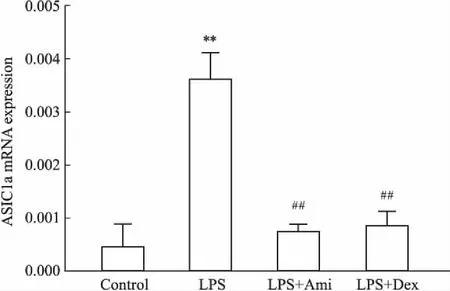
Fig 5 mRNA expression of ASIC1a in lung tissues
**P<0.01vscontrol;##P<0.01vsLPS
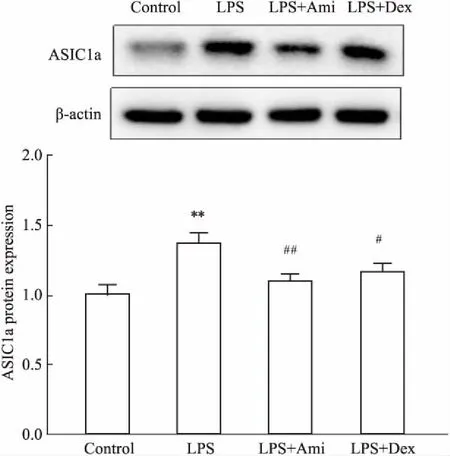
Fig 6 Protein expression of ASIC1a in lung tissues
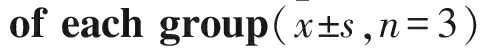
**P<0.01vscontrol;#P<0.05,##P<0.01vsLPS
3 讨论
本实验结果显示,与正常组相比,模型组氧分压下降,二氧化碳分压升高,pH值降低;病理学显示,其肺组织结构变化与正常组相比,肺泡塌陷,且有大量炎症渗出液填充。ELISA结果也表明,与正常组相比,模型组血清中TNF-α的表达水平明显升高,提示造模成功。而与模型组相比,阿米洛利组和阳性药物组氧气分压升高,二氧化碳分压降低,pH值升高,肺组织病理学明显好转,TNF-α的表达水平明显降低。表明阻断酸敏感离子通道的活性,能够有效抑制ALI的发生、发展,使疾病转归,趋于好转。
LPS能增强中性粒细胞活化,导致中性粒细胞浸润和活性氧、炎性介质的过度释放,破坏肺泡/毛细血管屏障,致肺组织损伤,形成ALI/ARDS[12]。本实验采用LPS腹腔注射复制大鼠ALI模型,观察酸敏感离子通道非特异性阻断剂阿米洛利对大鼠ALI的影响,从而探究ASIC1a在ALI中扮演的角色。
阿米洛利可以阻断ENaC Na+/H+交换体和Na+/Ca2+交换体,曾经被用作利尿剂,是ASICs的非特异性阻断剂,其抑制ASIC1a、ASIC1b和ASIC2a电流的半抑制浓度(IC50)为10~20 μmol·L-1,抑制瞬态ASIC3电流的IC50约为60 μmol·L-1。目前,阿米洛利是用于研究ASICs功能的主要药理学工具药之一[11]。目前为止,ASICs的大部分研究主要集中在中枢及外周神经系统中,ASICs参与了脑缺血、癫痫等中枢神经系统疾病的发病,在学习记忆、外周触觉、痛觉、味觉、机械感觉等的信息传递中发挥重要作用[9]。也有文献报道,酸敏感离子通道开放或在糖尿病肝纤维化的形成过程中,起着重要的促进作用[13]。ASIC1a是ASICs亚基中能通透Ca2+的主要亚基,当胞外pH下降时可被激活[7]。本研究采用免疫组化、qPCR及Western blot实验,检测各组大鼠肺组织中ASIC1a的表达情况,探讨ASIC1a在LPS诱导的大鼠肺损伤中的表达及作用。结果显示,与正常组相比,模型组肺组织中ASIC1a的mRNA与蛋白的表达量均明显增加;与模型组相比,阿米洛利组和阳性药物组肺组织中ASIC1a的mRNA与蛋白的表达量均明显下降,其ALI程度较模型组明显降低。提示ASIC1a可能参与ALI发病,抑制ASIC1a的表达能够在一定程度上减轻ALI,具体的作用及机制有待于进一步研究证实。
本实验发现,在LPS致ALI大鼠的肺组织中,ASIC1a的表达量明显升高,阿米洛利给药和阳性药地塞米松给药后,大鼠的肺组织病理改变减轻,肺组织中ASIC1a的表达量较模型组明显降低,提示LPS诱导大鼠ALI的机制可能与ASIC1a的激活有关。