RGS4过表达对甲基苯丙胺依赖大鼠纹状体mGluR5信号传导通路相关蛋白表达的影响
赵林波,隋念含,蒙国懿,洪仕君,李利华,邢豫明,赵永娜
(1.云南中医药大学信息学院,云南 昆明 650500;2. 昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;3. 昆明医科大学法医学院,云南 昆明 650500;4. 云南省公安厅禁毒处毒品分析与禁毒技术公安部重点实验室,云南 昆明 650228)
甲基苯丙胺(methamphetamine,METH)俗称“冰毒”,作为一种具有精神活性的新型合成毒品,其依赖的发生发展机制十分复杂,涉及脑内多个脑区、多条神经环路、多信号分子的共同调节[1-2]。其中,纹状体在激发和维持运动、情绪控制、奖赏效应和药物依赖中扮演着重要角色[3]。纹状体内含有丰富的G蛋白信号调节因子4(regulator of G-protein signaling 4,RGS4)和代谢型谷氨酸受体5(metabotropic glutamate receptor subtype 5,mGluR5)[4]。大量研究表明,RGS4蛋白在苯丙胺[4]、可卡因[5]、吗啡[6]等药物成瘾的调节机制中均扮演了重要角色,作为G蛋白信号通路的负性调节因子,它能负性调节一些与Gαi和Gαq亚基偶联的受体信号因子作用的持续时间及强度[7]。mGluR5是一类重要的G蛋白偶联受体(G-protein coupled receptors,GPCRs),它可与Gαq偶联,并激活磷脂酶C-β1(phospholipase C-β1, PLCβ1),介导甘油二脂(diacylglycerol,DAG)和1,4,5-三磷酸肌醇(inositol 1,4,5-triphohate,IP3)双信使信号通路,参与药物成瘾行为的调节[4]。
国外已有不少研究探讨了吗啡、可卡因等成瘾性药物使用后,RGS4和mGluR5介导的信号通路的变化情况。本研究采用METH依赖使大鼠纹状体内RGS4蛋白过表达的方法,观察大鼠行为学变化,以及脑纹状体内RGS4、mGluR5、Gαq、PLCβ1蛋白表达的变化,为进一步研究RGS4和mGluR5受体信号通路在药物依赖的发生、发展中的作用提供理论基础。
1 材料
1.1 实验动物健康SD大鼠50只,♂,体质量(230±20)g,由昆明医科大学实验动物学部提供,生产许可证号:SCXK(滇)K2015-0005。
1.2 药物与试剂甲基苯丙胺盐酸盐,由云南省公安厅禁毒处毒品分析与禁毒技术公安部重点实验室合法提供;过表达腺病毒载体Ad5-RGS4-EGFP(病毒滴度为1.6×1013PFU·L-1)、阴性对照腺病毒载体Ad5-EGFP,均购自博淼生物科技(北京)有限公司;BCA蛋白浓度测定试剂盒(北京天根生化公司);兔抗RGS4多克隆抗体、鼠抗mGluR5单克隆抗体(Abcam公司);兔抗Gαq单克隆抗体、兔抗PLCβ1多克隆抗体(Santa Cruz公司);兔抗GAPDH单克隆抗体(SAB公司)。
1.3 仪器大鼠脑立体定位仪和牙科钻(深圳瑞沃德公司);微量进样器(上海玻璃仪器厂);鼠博士动物行为学分析系统(上海移数信息科技有限公司);全波长酶标仪(Thermo公司);垂直电泳仪和膜转印装置Mini Protein 3(Bio-Rad公司)。
2 方法
2.1 携带EGFP的过表达腺病毒载体Ad5-RGS4-EGFP转导效率研究根据George Paxinos和Charles Watson的《大鼠脑立体定位图谱》[8],反复进行定位点校正后,确定大鼠纹状体立体定位注射靶点为:前囟前0.5 mm,中线旁开±3.0 mm,深距颅骨表面5.2 mm。用微量进样器抽取过表达腺病毒载体Ad5-RGS4-EGFP,按上述靶点坐标钻颅并匀速缓慢注射,每侧3 μL,病毒数量为4.8×107PFU,注射速度为0.2 μL·min-1,注射完毕后,针头留置10 min后再缓慢拔出,缝合切口,于术后d 3、7、11进行心脏灌注固定,避光取脑,制作冰冻切片,立即取含有纹状体的切片,于倒置荧光显微镜下观察EGFP在脑纹状体内的表达情况,以EGFP表达间接评估目的蛋白RGS4在纹状体内的表达;同时以正常大鼠相同部位脑切片作为对照。
2.2 实验动物分组及脑纹状体立体定位注射大鼠随机分为5组:正常组、生理盐水(normal saline,NS)组、METH组、Ad5-RGS4-EGFP组、Ad5-EGFP组,每组10只。以微量进样器抽取过表达腺病毒载体Ad5-RGS4-EGFP,按上述靶标、剂量、方法匀速缓慢注入Ad5-RGS4-EGFP组大鼠纹状体内;同法抽取阴性对照腺病毒载体Ad5-EGFP注入Ad5-EGFP组大鼠纹状体内;抽取磷酸盐缓冲溶液(phosphate buffered saline,PBS)注入NS组、METH组大鼠纹状体内;正常组大鼠不做任何处理。次日,建立大鼠METH依赖的条件位置偏爱(conditioned place preference,CPP)模型。
2.3 CPP模型的建立参照Niwa等[9]的方法,进行METH依赖CPP模型建立。预测期:大鼠在CPP测试箱内自由活动3 d,每天1次,每次15 min,d 3记录每只大鼠在白箱和黑箱的平均停留时间,确定大鼠的天然偏爱倾向(本实验为黑箱),将白箱定为伴药箱;剔除以白箱为天然偏爱箱及活跃性较差的大鼠。给药及条件化训练期:d 4,Ad5-RGS4-EGFP组、Ad5-EGFP组、METH组大鼠腹腔注射METH 10 mg·kg-1·d-1(早上8 ∶00),NS组大鼠给予相同剂量的生理盐水后,放入白箱内关闭通道观察30 min;次日,各组大鼠均注射生理盐水,放入黑箱内关闭通道观察30 min,如此共进行3个循环,共训练6 d;后测期:d 10开放通道,使大鼠在黑白两箱内自由活动,观察15 min,记录动物在白箱停留时间,计算CPP差值,CPP差值=CPP后测值-CPP前测值,并对各组值分别进行统计学分析。正常组大鼠不做任何处理。
2.4 Western blot检测CPP测试结束后,处死大鼠,于冰上迅速剥离大脑并取出纹状体,使用RIPA和PMSF冰上裂解纹状体组织,提取总蛋白后,用BCA法测定蛋白浓度,取30 μg蛋白经SDS-PAGE电泳后,转至PVDF膜;5%脱脂牛奶室温封闭2 h;分别加入RGS4、PLCβ1、mGluR5、Gαq抗体(RGS4稀释比为1 ∶500,Gαq、PLCβ1均为1 ∶1 000,mGluR5为1 ∶5 000稀释),4 ℃孵育过夜;TBST洗膜;加入HPR标记的二抗(1 ∶6 000稀释),摇床上室温孵育2 h;TBST洗膜;取膜于暗室内加入ECL,在荧光和化学发光成像系统中曝光不同时间后,拍照成像保存。用Image-Pro Plus图像分析软件分析目标条带和对应的内参GAPDH条带的平均光密度值,对二者比值进行统计分析。

3 结果
3.1 Ad5-RGS4-EGFP注入纹状体后介导的EGFP表达实验大鼠注射Ad5-RGS4-EGFP后d 3、7、11,均可在荧光激发下观察到EGFP在纹状体注射区内有明显表达,且荧光强度在不同实验大鼠及不同时间呈现区域稳定;而正常大鼠脑切片纹状体部位没有观察到绿色荧光。见Fig 1。
3.2 Ad5-RGS4-EGFP对METH处理大鼠CPP实验的影响Tab 1结果显示,各组大鼠CPP前测试值差异无统计学意义(P>0.05),表明立体定位注射手术没有引起实验大鼠行为学改变,提示后续CPP测试具有良好的可比性。CPP差值比较:与NS组比较,METH组CPP差值明显增加(P<0.01),提示METH依赖CPP模型建立成功,Ad5-RGS4-EGFP组CPP差值也增加(P<0.05);与METH组比较,Ad5-EGFP组CPP差值无明显差异(P>0.05),提示脑纹状体内注射腺病毒载体对METH依赖CPP行为无影响,Ad5-RGS4-EGFP组CPP差值减少(P<0.05),提示脑纹状体内注射Ad5-RGS4-EGFP使RGS4过表达后,可减弱METH引起的CPP行为,但与NS组比较的结果提示还不能彻底消除CPP行为。
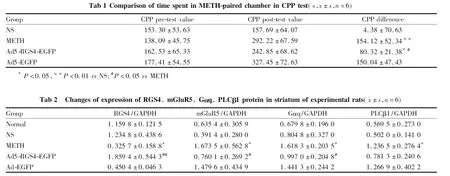
*P<0.05,**P<0.01vsNS;#P<0.05vsMETH
3.3 大鼠纹状体内RGS4、mGluR5、Gαq、PLCβ1蛋白表达情况Fig 2、Tab 2结果显示:与NS组比较,正常组RGS4、mGluR5、Gαq、PLCβ1四个蛋白表达差异均无显著性(P>0.05),METH组RGS4蛋白表达水平降低(P<0.05),mGluR5、Gαq、PLCβ1蛋白表达水平均升高(P<0.05);与METH组比较,Ad5-EGFP组RGS4、mGluR5、Gαq、PLCβ1四个蛋白表达差异均无显著性(P>0.05),Ad5-RGS4-EGFP组RGS4蛋白表达水平明显升高(P<0.01),提示脑纹状体内注射过表达腺病毒载体Ad5-RGS4-EGFP可使METH依赖大鼠脑纹状体RGS4蛋白成功过表达,mGluR5、Gαq蛋白表达水平均降低(P<0.05),PLCβ1蛋白表达水平略有降低(P>0.05),提示脑纹状体内RGS4蛋白过表达后,可使mGluR5、Gαq表达水平降低,差异有统计学意义,PLCβ1表达水平略有降低,但差异无统计学意义。
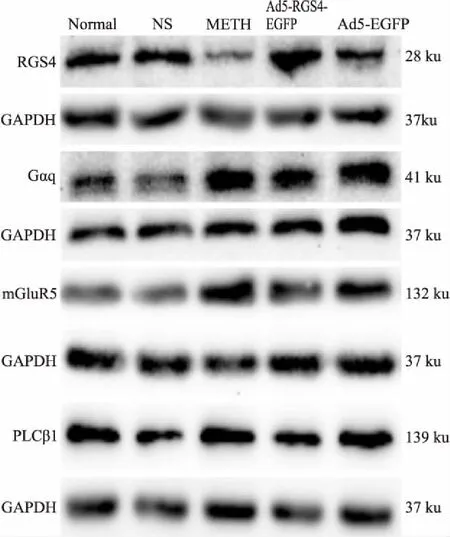
Fig 2 Change of RGS4, mGluR5, Gαq, PLCβ1protein expression in striatum of experimental rats
4 讨论
本实验通过将过表达腺病毒载体Ad5-RGS4-EGFP注入METH依赖大鼠纹状体,使RGS4蛋白过表达,研究RGS4调控的mGluR5蛋白及其下游Gαq和PLCβ1相关蛋白表达变化,以及对大鼠CPP行为的影响,探讨其在METH成瘾中的作用。本实验用腺病毒载体作为转染载体,有安全性高、外源基因表达水平较高、病毒滴度高、感染范围广等特点[10],它对神经组织有很高的转染能力,因而对于本研究较其他病毒载体具有更大优势[11]。CPP是一种常用的药物奖赏效应以及药物渴求研究的动物模型,是评估药物依赖精神依赖性最方便、常用、经典的实验,其通过对成瘾物质奖赏效应的体验是否产生偏爱,来评价成瘾物质精神依赖的程度[12]。本研究结果显示,大鼠纹状体RGS4过表达可减弱METH依赖CPP效应,但不能消除,可能是本实验中只对纹状体中的RGS4蛋白表达进行了干预,而其他成瘾相关脑区及其他信号通路的作用却并未受到影响,所以成瘾行为只能减弱而无法消除。Kim等[13]的研究也发现,小鼠脑伏隔核内RGS4敲除后,可卡因成瘾行为明显增强,与本实验结果相似。
本实验前期研究发现,METH依赖可导致大鼠脑纹状体RGS4蛋白表达下调,以及mGluR5、Gαq、PLCβ1蛋白表达上调[14]。现阶段RGS4过表达后,可加强对G蛋白偶联受体mGluR5的负性调控作用,使该通路中相关蛋白迅速失活,即RGS4与mGluR5、Gαq、PLCβ1形成稳定复合物,RGS4表达升高抑制了mGluR5活化,从而阻断了PLC介导磷脂酰肌醇信号通路。Mao等[15]研究阐明,PLCβ1是磷脂酰肌醇信号途径的重要分子,是mGluR5的Gαq亚单位主要的作用对象,它与阿片类药物成瘾的易感性密切相关。
Schwendt等[16]研究也发现,使背侧纹状体内RGS4过表达,可减弱由苯丙胺或mGluR5激动剂诱导的动物行为活性和降低ERK磷酸化水平,与使用mGluR5拮抗剂有相似的效果。Mathews等[17]研究还发现,长期可卡因成瘾大鼠经过20 d的戒断后,大鼠脑背侧纹状体内RGS4表达降低,并激活了Gαq下游信号通路。本实验发现,成瘾大鼠纹状体RGS4过表达后,mGluR5、Gαq、PLCβ1表达呈现出不同程度的降低趋势,其中mGluR5、Gαq降低程度较为明显,与Schwendt等和Mathews等的研究结果一致。这可能是因为RGS4蛋白的过表达,加强了对mGluR5受体信号通路的负性调控作用,使该通路中相关蛋白迅速失活,从而阻断PLC系统介导的磷脂酰肌醇信号通路所致。PLCβ1作为磷脂酰肌醇信号途径的重要信号分子,被Gαq激活后,可催化质膜磷脂酰肌醇4,5二磷酸(PIP2)水解为DAG和IP3,从而调节细胞内Ca2+水平[18]。另外,mGluR5也可被Gαq强烈激活,并与PLC途径相偶联[19]。RGS4与Gαq间也有直接的作用[20]。因此,RGS4过表达可能通过抑制mGluR5介导的磷脂酰肌醇信号通路,从而使mGluR5、Gαq、PLCβ1表达水平降低,对METH依赖起了一定的抑制作用。
本实验以RGS4作为研究靶点,为治疗METH依赖提供了一个新思路和着力点。但鉴于METH成瘾涉及众多脑区及多条受体信号通路,因此,后续研究将综合多个重要的成瘾相关脑区和多条信号通路进行深层次探讨。
(致谢:本实验在昆明医科大学药学院、法医学院、基础医学院实验室内完成,对本实验辛勤付出的各位老师、同学表示衷心感谢。)