宫颈HSIL行锥切术后病灶残留的高危因素及子宫切除时机探讨
王三锋 胡 克 钟沅月 麦 碧 何 裕 张 煦 黎玉涵
(广东省妇幼保健院妇科,广东 广州 511400)
宫颈癌是妇科常见恶性肿瘤之一,随着宫颈癌筛查普及,临床中癌前病变的发现大幅增加。宫颈癌前病变传统病理命名是宫颈上皮内瘤变三级(CINⅠ、Ⅱ、Ⅲ),2012年ASSCP提出用两级分类法代替三级分类法来命名宫颈癌前病变,即低级别鳞状上皮内病变(lowgrade squamous intraepithelial lesion,LSIL)和高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)[1],两级分类法弥补了以前三级分类法的不足[2]。宫颈LSIL约90%可自然消退,无需治疗,随诊即可;宫颈HSIL进展为宫颈癌的风险有20%左右,应积极治疗。宫颈锥切是宫颈HSIL有效治疗手段,锥切术后病变有残留风险,影响因素有争议;子宫切除术是宫颈HSIL的选择之一,手术选择时机也有一定争议[3-4]。本研究选择广东省妇幼保健院2015年1月至2017年12月因宫颈HSIL行切除子宫者作为研究对象,探讨宫颈HSIL宫颈锥切术后病变残留的危险因素及子宫切除术的手术时机。
1 资料与方法
1.1 一般资料:选取2015年1月至2017年12月在广东省妇幼保健院就诊的宫颈HSIL患者,根据宫颈癌前病变三阶梯原则诊治。纳入标准:①患者有性生活,无生育要求;②患者无严重内外科合并症;③患者及家属有切除子宫的强烈意愿;④患者能按要求定期随访;⑤患者无腹腔镜手术禁忌证;⑥患者诊疗过程均为经培训合格的宫颈病变专业组医师诊治。
1.2 诊治流程:患者均按诊疗规范行宫颈癌筛查,有严格阴道镜指征,阴道镜检查病理活检提示宫颈HSIL;再按规范行宫颈锥切术(均为宫颈LEEP术),术后常规石蜡病理学结果提示仍为宫颈HSIL,除外癌;根据患者意愿行腹腔镜下筋膜外子宫切除术;术后半年、1年各随访一次,行阴道残端液基细胞学检查(TCT)及高危型HPV 检测(HR-HPV)。
1.3 观察指标:收集患者年龄、术前HR-HPV类型、阴道镜下宫颈转化区类型、宫颈锥切病理结果、宫颈锥切后切缘病理情况(切缘阳性、切缘阴性)、颈管补切病理情况、子宫切除术后病理结果(病灶残存有,无)。子宫切除术后患者均6个月、12个月随访,随访内容包括TCT、HR-HPV检测。
1.4 病理学判定:所有组织病理均经两个以上高级职称病理科医师评估。宫颈锥切切缘阳性指宫颈锥切术后切缘可见病变或切缘与病变距离<1 mm[5]。宫颈管补切组织有HSIL病变为宫颈补切阳性,没有病变为阴性。病变残留指子宫切除术后残存宫颈组织仍有HSIL及以上病变。宫颈癌分期按FIGO2009年分期标准。
1.5 HR-HPV检测方法:选择广东凯普生物科技股份有限公司HPV 分型检测试剂盒,检测14 种高危型别:HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68。
1.6 统计学处理:采用SPSS23.0软件进行统计分析,所有统计检验为双侧检验。计数资料以绝对数和百分数(%)表示,采用卡方检验或Fisher 精确概率法进行组间比较。影响病灶残留因素纳入logistic多因素分析回归模型计算相关风险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料:107例患者年龄30~71岁,中位年龄49岁,平均年龄(49.18±7.01)岁;<40岁7例,40岁以上100例。术后病灶残留率为41.12%(44/107),其中癌3例,均为IA1期(癌中切缘阳性2例,切缘阴性1例),宫颈锥切术术后病理升级率为2.8%。
2.2 宫颈锥切术后切缘状态与病灶残留关系:107例患者中,按宫颈术后切缘状态分为切缘阳性组(64例),切缘阴性组(43例),两组病变残留率分别为50%、27.91%,二者差异有统计学意义(χ2=4.3127,P=0.0378)。见表1。

表1 子宫切除术术前切缘状态与术后病变残留率(%)
2.3 宫颈HSIL锥切术后病变残留影响因素:对107例患者年龄、术前HR-HPV类型、阴道镜转化区类型、切缘状态、宫颈管补切状态对宫颈HSIL锥切术后病变残留影响行多因素分析显示:切缘状态对病变残留的影响有统计学意义(P=0.039),切缘阳性增加病变残留风险,OR=2.469(95%CI 1.05~5.83)。年龄、术前HR-HPV类型、转化区类型、宫颈管补切状态对病变残留影响无统计学意义,不是高危因素。见表2。
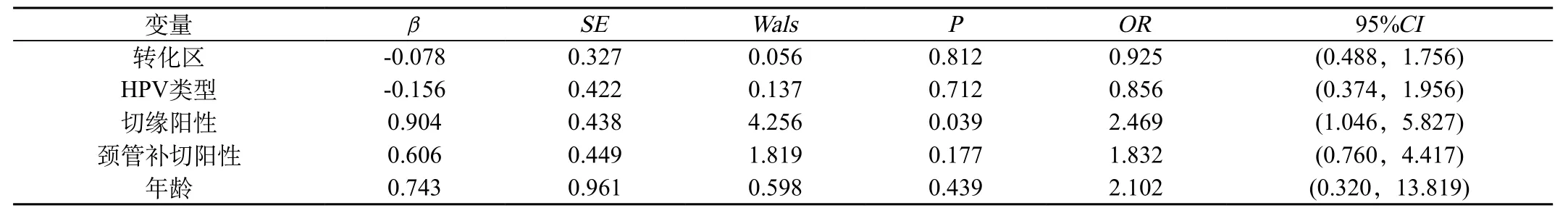
表2 宫颈HSIL锥切术后病变残留多因素分析
2.4 子宫切除术后HPV转阴情况:107例患者术后半年HPV转阴率为81.31%(87/107),1年HPV消除率为83.18%(89/107),半年和1年转阴率差异无统计学意义(χ2=0.1280,P=0.7205)。见表3。按子宫切除前切缘状态分为切缘阳性组、切缘阴性组;切缘阳性组、切缘阴性组术后半年转阴率分为79.69%、83.72%,两组间差异无统计学意义(χ2=0.2753,P=0.5998);切缘阳性组、切缘阴性组术后1年转阴率分为82.81%、83.72%,两组间差异无统计学意义(χ2=0.0152,P=0.9020)。见表4。

表3 HPV转阴率与子宫切除术后时间关系(%)

表4 锥切术后切缘状况、HPV类型与HPV转阴率(%)
3 讨 论
宫颈HSIL由于病变的多中心性,手术后病变残留的风险增加。本研究显示宫颈锥切术后病变残留率为41.12%;国内学者对宫颈锥切术后病变残留率的报道不一致,可能与研究方法有关。刘莉等[6]报道1502例宫颈HSIL锥切术后半年残留率为3.2%,该研究均未行子宫切除术,仅以宫颈细胞学结果来判定残留,假阴性较高。文献报道宫颈HSIL子宫切除术后发现锥切术后病灶残留率为32.5%~50.12%[7-8],与本研究基本一致。子宫切除术后判定病变残留是组织学证据,更准确,但缺点是样本量均较少。对于锥切术后病变残留的影响因素,文献报道也有不一致。苏晓玲等[9]研究显示:绝经年限是病变残留危险因素,切缘阳性、HPV感染对病变残留的影响无统计学意义;但其他研究均显示切缘阳性是病变残留独立危险因素[10-12];本研究也显示切缘阳性对病变残存有明确影响,是独立危险因素。曹倩文等[13]报道高龄是病变残留危险因素,本研究提示年龄对病变残留无明显影响。
高危型HPV感染是宫颈癌前病变的主要原因,因此宫颈HSIL通过锥切切除病灶来消除HPV。宫颈HSIL去除病灶后HPV转阴时间及影响因素文献报道也无定论。学者张晶等[14]报道宫颈HSIL行宫颈锥切后,术后3~12个月内行第1次复查,HPV转阴率为85.5%;张忠明等[15]报道宫颈锥切术后半年HPV转阴率为86.17%;本研究显示宫颈HSIL子宫切除术后半年、1年HPV消除率为81.31%、83.18%;可以看出宫颈锥切术和子宫切除术1年内HPV转阴率无明确差异。本研究提示切缘阳性和切缘阴性的锥切患者切除子宫后HPV转阴率差异无统计学意义,切缘状态视乎对HPV消除率无影响;王依妮等[16]报道影响宫颈锥切术后HPV转阴的因素不明确,与切缘、年龄、锥切方式、病理类型、孕产次均无明显相关性。有研究指出HPV持续阳性,是病变复发的高危因素[17-19],因此对于在宫颈HSIL的治疗中HPV转阴消除致关重要,HRHPV的检测在宫颈HSIL管理中显得极为重要。
子宫切除术是宫颈HSIL的可选择治疗方法,临床中子宫切除的时机选择有差异;部分选择阴道镜活检后直切子宫切除,部分选择宫颈锥切同时行快速冰冻病理检查后行子宫切除,也有选择宫颈锥切术后等待常规石蜡病理结果后手术;手术时机的选择差异可能造成术后病理升级,漏诊癌导致手术范围不足。苏晓玲等[9]报道:阴道镜活检后直接切除子宫组病理升级率为7.14%,术前行宫颈锥切再切除子宫病理升级率为3.88%;宫颈锥切快速冰冻病理检查后切除子宫病理升级率为8.16%。郝真等[20]回顾分析宫颈病变高级别病变子宫切除的病理确诊时间发现:宫颈锥切术中冰冻病理结果行子宫切除术后病理升级率为11.88%,宫颈锥切后石蜡病理后再子宫切除病理升级率为0.93%。本研究子宫切除是选择锥切常规病理结果后再手术,结果显示本研究宫颈锥切术后病理升级率仅为2.8%;明显低于前面文献报道的阴道镜活检病理升级率,也低于术中快速冰冻病理的升级率。因此宫颈HSIL子宫切除的手术时间应选在宫颈锥切常规石蜡病理结果后,可降低漏诊率。
综上所述,宫颈锥切术后切缘阳性是病变残留的高危因素,子宫切除应选择在宫颈锥切术后常规石蜡病理结果后进行。本研究的缺陷在于为回顾性研究,病例数相对较少,今后仍需扩大样本量、进一步研究。

