lncRNA GAS5通过靶向miR-221抑制骨肉瘤细胞的增殖、迁移和侵袭
王耀宗 孙乃坤 叶桂峰 杨镔 张英
(厦门大学 1附属中山医院骨科,福建 厦门 361003;2附属第一医院脊柱外科)
骨肉瘤(OS)也称为成骨肉瘤,是一种常见的原发性成骨性实体恶性肿瘤,约占所有恶性肿瘤发生率的2.4%〔1,2〕。据报道,超过30%的OS患者可出现癌细胞肺、胸膜和心脏转移,极大程度上加大了OS的治疗难度,导致患者5年生存率仅为40%~75%〔3,4〕。目前,临床中常采用放疗、化疗、手术切除治疗,但对转移性或复发性OS患者治疗效果不理想,极易产生不良预后〔5,6〕。
LncRNAs是一类超过200个核苷酸长度的长链非蛋白编码RNAs,最早被认为是基因转录的“噪音”,但近年来研究表明,部分lncRNAs可通过再转录或转录后水平调控基因的表达参与机体内多种生物学过程,如细胞周期、分化、增殖、凋亡等〔7〕。研究证实,在多种癌症组织或细胞中均出现lncRNAs的异常表达,失调的lncRNAs通过调控肿瘤相关因子表达发挥致癌或肿瘤抑制作用〔8〕。生长停滞特异性转录因子(GAS)5是最早在小鼠生长停滞的成纤维细胞中被发现的lncRNA,定位于人染色体1q25.1上。大量研究显示,该lncRNA在多种人类肿瘤中发挥重要的肿瘤抑制作用〔9~11〕,但其在OS发展中的功能和机制还有待深入研究。本研究分析GAS5在OS细胞中的表达及对OS细胞增殖、迁移和侵袭的影响,并深入探究GAS5调控细胞功能的作用机制。
1 材料和方法
1.1材料 细胞学实验于2017年6月至2018年3月在厦门大学附属中山医院病理科完成。人胚胎肾细胞293T和人成骨细胞hFOB 1.19(中国科学院典型培养物保藏委员会细胞库);OS细胞U2OS(美国ATCC);胎牛血清,DMEM培养基,McCoy 5A培养基,胰蛋白酶(美国Gibco);Lipofectamine 2000 Reagent,High Capacity cDNA Reverse Transcription Kit,MicroRNA Reverse Transcription Kit,Maxima SYBR Green qPCR Master Mix(2×)(美国ThermoFisher),Dual-Luciferase® Reporter Assay System(美国Promega);点突变试剂盒(日本Takara);Transwell细胞小室(孔径8 μm)(美国Corning);Matrigel基底膜基质(美国BD Biocoat);噻唑蓝(MTT)细胞增殖试剂盒、总RNA提取试剂盒(上海碧云天生物技术有限公司);pcDNA-GAS5重组质粒(GAS5)及对照质粒(pcDNA3.1),GAS5小干扰RNA(si-GAS5)及干扰对照(si-NC),miR-221模拟物(miR-221)及相应的阴性对照(miR-NC),miR-221抑制剂(anti-miR-221)及相应的阴性对照(anti-miR-NC),含miR-221结合位点的野生型GAS5荧光素酶报告质粒(GAS5-WT)和miR-221结合位点突变的突变型GAS5荧光素酶报告质粒(GAS5-MUT,上海吉玛制药技术有限公司)。
1.2细胞培养 293T和hFOB 1.19细胞培养在含10%胎牛血清的DMEM基础培养液中,U2OS细胞培养在含10%胎牛血清的McCoy 5A培养基中。将上述细胞置于37℃、5% CO2的恒温培养箱中培养,每隔2 d更换一次培养基,至细胞融合度达85%时,进行后续细胞实验。
1.3细胞转染 将上述处于对数生长期的细胞接种于6孔板中,过夜培养至细胞融合度达50%时,利用Lipofectamine 2000将上述质粒或寡核苷酸转染到细胞中,持续培养48 h后,进行后续实验操作。
1.4qRT-PCR检测GAS5和miR-221表达 利用总RNA提取试剂盒提取细胞中的总RNA,紫外分光光度计测定RNA浓度后分别利用High Capacity cDNA Reverse Transcription Kit和MicroRNA Reverse Transcription Kit将GAS5和miR-221逆转录成cDNA。miR-221-RT:AGCUACAUUGUCUGCUGGGUU-UC;U6-RT:GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACAAAATAGTGAAC。以cDNA为模板,利用Maxima SYBR Green qPCR Master Mix(2×)配制qPCR反应体系,之后在荧光定量PCR仪上测定GAS5和miR-221的相对表达水平,分别以GAPDH和U6 snRNA作为内参,结果按照2-ΔΔCt公式计算。GAS5上游引物:5′-CTTCTGGGCTCAAGTGATCCT-3′,下游引物:5′-TTGTGCCATGAGACTCCATCAG-3′;GAPDH上游引物:5′-ACCACAGTCCATGCCATCAC-3′,下游引物:5′-TCCACCACCCTGTTGCTGTA-3′;miR-221上游引物:5′-CAGCATACATGAT TCCTTGTGA-3′,下游引物:5′-CTTTGGTGTTTGAGATGTTTGG-3′;U6上游引物:5′-TGCGGGTGCTCGCTTCGGCAGC-3′,下游引物:5′-CCAGTGCAGGGTCCGAGGT-3′。
1.5MTT法检测细胞的增殖活性 将转染后的U2OS细胞以3×103个/孔的密度接种于96孔板中,每组设3个重复样品,分别在转染后24、48、72 h加入MTT试剂,37℃、5% CO2条件下孵育4 h后,加入Formazan溶解液,之后在酶标仪上测定570 nm处的吸光值。
1.6Transwell小室法检测细胞侵袭和迁移 细胞迁移:将转染48 h后的U2OS细胞用0.25%的胰酶消化,磷酸盐缓冲液(PBS)洗涤2次,用不含血清的培养基重悬细胞,并调整细胞密度为5×105/ml。取200 μl细胞悬液加入24孔板小室上室中,在下室内加入500 μl含10%胎牛血清的完全培养基,于37℃、5% CO2条件下培养48 h后取出,用棉签擦去上室内的细胞,之后用0.1%结晶紫染液染色10 min,倒置显微镜下观察结果并拍照,随机选取10个视野进行计数,并计算平均迁移细胞数。细胞侵袭实验需要在上室中加入Matrigel以模仿细胞外基质,具体操作步骤同迁移实验。
1.7双荧光素酶报告分析 利用Lipofectamine 2000将构建的GAS5-WT/MUT重组质粒与miR-NC、miR-221、anti-miR-NC或anti-miR-221共转染到293T细胞中,48 h后利用Dual-Luciferase®Reporter Assay System检测各组细胞的荧光素酶活性。
1.8主要观察指标 GAS5在OS细胞中的表达;GAS5对OS细胞增殖、迁移和侵袭的影响及调控机制。
1.9统计学分析 采用SPSS20.0软件进行t检验、单因素方差分析及SNK-q检验。
2 结 果
2.1GAS5在OS细胞U2OS中的表达 与正常hFOB 1.19组(1.008±0.002)相比,U2OS细胞中GAS5相对表达量(0.297±0.035)显著降低(P<0.05)。
2.2GAS5过表达对U2OS细胞增殖、迁移和侵袭的影响 GAS5转染组细胞中GAS5相对表达水平(3.251±0.326)显著高于pcDNA转染组(1.025±0.025,P<0.05),说明通过转染GAS5可建立GAS5过表达细胞模型。与pcDNA组相比,GAS5过表达的U2OS细胞在48 h和72 h的增殖活性明显降低(P<0.05);GAS5转染后48 h,U2OS细胞的迁移和侵袭活性也明显低于pcDNA转染组(P<0.05),见图1,表1。

图1 GAS5过表达抑制U2OS细胞迁移和侵袭

组别吸光度值24 h48 h72 h迁移数目(个)侵袭数目(个)pcDNA组0.202±0.0180.575±0.0250.916±0.05296.23±10.05109.54±10.21GAS5组0.211±0.023 0.337±0.0311) 0.448±0.0361)43.18±6.131)50.26±5.481)
与pcDNA组比较:1)P<0.05
2.3GAS5与miR-221靶向关系验证 miR-221序列中存在与GAS5互补结合的位点,GAS5:5′-gauAUUCUGCAUUCCCAUGUAGCa-3′,miR-221:3′-cuuUGGGUCGU-CUGUUACAUCGa-5′。与miR-NC组相比,miR-221过表达明显抑制GAS5-WT的荧光素酶活性(P<0.05),但对GAS5-MUT荧光素酶活性无影响(P>0.05);与anti-miR-NC组相比,抑制miR-221表达明显促进了GAS5-WT的荧光素酶活性(P<0.05),但对GAS5-MUT荧光素酶活性无影响(P>0.05),见表2。

表2 miR-221过表达或敲低对GAS5WT/MUT报告质粒荧光素酶活性的影响
与miR-NC组比较:1)P<0.05;与anti-miR-NC组比较:2)P<0.05
2.4GAS5对miR-221表达的调控 与pcDNA组(1.015±0.002)相比,GAS5转染的U2OS细胞中miR-221的相对表达量(0.248±0.014)显著降低(P<0.05);与si-NC组(0.986±0.013)相比,si-GAS5转染的U2OS细胞中miR-221相对表达量(2.863±0.205)显著升高(P<0.05)。
2.5miR-221在OS细胞U2OS中的表达 与正常hFOB 1.19组(1.000±0.003)相比,U2OS细胞中miR-221的相对表达量(3.213±0.033)显著升高(P<0.05)。
2.6miR-221逆转GAS5对U2OS细胞增殖、迁移和侵袭的抑制作用 与GAS5+miR-NC组相比,外源回补miR-221可显著逆转GAS5对U2OS细胞增殖的抑制作用(P<0.05);与GAS5+miR-NC组相比,外源回补miR-221可逆转GAS5对U2OS细胞迁移和侵袭的抑制作用(P<0.05),见表3。
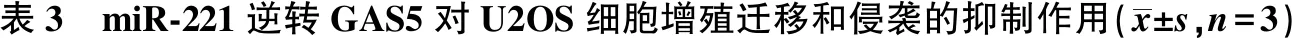

组别吸光度值24 h48 h72 h迁移数目(个)侵袭数目(个)pcDNA组0.213±0.0240.596±0.0551.037±0.176110.45± 12.39123.32± 12.68GAS5组0.208±0.0320.367±0.0411)0.492±0.0531)53.71 ± 5.731)63.41 ±6.531)GAS5+miR-NC组0.216±0.0210.343±0.0300.514±0.04458.52 ±6.0453.36 ±6.04GAS5+miR-221组0.227±0.020 0.569±0.0472) 0.936±0.0862)96.46 ±9.482)98.27 ±10.422)
与pcDNA组比较:1)P<0.05;与GAS5+miR-NC组比较:2)P<0.05
3 讨 论
新型临床辅助化疗药物的开发,极大程度地缓解了OS患者的病情发展〔12〕,然而,恶性肿瘤转移仍然是导致OS患者治疗失败的主要原因〔13〕。随着分子生物学技术的不断发展,研究人员发现lncRNA在多种生物过程中发挥重要的调节作用,异常表达的lncRNA可能涉及多种人类疾病,特别是恶性肿瘤的发生发展,包括OS〔14,15〕。LncRNA GAS5在多种人类肿瘤中出现异常的低表达,并通过调控癌细胞的增殖、迁移、侵袭、细胞周期和凋亡等过程发挥肿瘤抑制功能。研究显示,肝癌组织中低表达的GAS5可作为患者总体存活率的独立预测因子,外源过表达GAS5可通过调控波形蛋白表达抑制体外肝癌细胞的增殖和侵袭〔16〕;在胰腺导管癌中GAS5表达水平显著降低,体外功能实验证实,下调的GAS5可通过诱导细胞周期依赖性蛋白激酶(CDK)6表达调控细胞周期并发挥对癌细胞增殖的促进作用〔17〕。本研究结果表明,lncRNA GAS5在OS中发挥肿瘤抑制作用。Ye等〔18〕证实,GAS5可通过抑制OS细胞生长和上皮间质转化发挥抗肿瘤形成作用;Wang等〔19〕研究表明,OS细胞MG-63中下调的GAS5可促进肿瘤细胞的侵袭和迁移,并促进细胞周期蛋白(Cyclin)D1、Cyclin B1、CDK1和CDK4表达,本研究结果与之相一致。
研究表明,lncRNA GAS5可发挥“分子海绵”的功能吸附miRNA,减少miRNA在特定组织或细胞中的表达,最终参与肿瘤的发生发展〔20〕。如GAS5可通过与miR-222互补结合,抑制胶质瘤细胞的生长、侵袭、迁移和凋亡〔21〕;此外,GAS5还可通过抑制miR-103表达促进其下游靶基因第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)水平的升高,进而延缓子宫内膜癌的发展〔22〕。本研究结果证实miR-221是GAS5的一个靶miRNA,GAS5能够通过互补结合位点负调控miR-221表达。miR-221是一种常见的致癌因子,参与多种肿瘤的发生发展过程。如在胃癌卵巢转移患者血清外泌体中,miR-221表达水平显著升高,由此初步说明miR-221可能参与胃癌的卵巢转移过程〔23〕;miR-221/222簇可通过调控PTEN/蛋白激酶B(Akt)信号通路活性促进乳腺癌细胞的增殖、迁移和侵袭〔24〕。miR-221通过靶向抑制AT丰富结合域1A基因(ARID1A)增强宫颈癌细胞的增殖和侵袭能力〔25〕。另外,本研究结果显示,外源回补miR-221逆转了GAS5对OS细胞增殖、迁移和侵袭的抑制作用。综上,GAS5在OS细胞中表达量降低,而miR-221表达量升高;过表达GAS5可通过靶向吸附miR-221抑制OS细胞的增殖、侵袭和迁移能力,在OS发展中起肿瘤抑制作用,提示GAS5具有作为OS新型肿瘤抑制剂的潜能。
——一道江苏高考题的奥秘解读和拓展

