龙葵碱联合KLF16基因对胶质瘤细胞增殖、凋亡的影响及其机制研究
赵舒杨 雷艳杰 马世杰 高明
胶质瘤是脑中枢神经系统中常见的恶性肿瘤,其中胶质母细胞瘤(glioblastoma,GBM)是恶性程度最高、最常见的亚型,5年生存率低于5%[1]。目前,手术摘除、局部照射和常规化疗等治疗手段虽取得了一定的进展,但是胶质瘤患者的总体生存率仍无明显改善[2]。放疗及化疗产生的严重副作用及并发症,严重影响患者预后,因此传统中药联合靶向基因治疗的方式越来越受到人们的关注。龙葵碱广泛存在于龙葵全草、马铃薯、番茄等茄科植物中,具有抗病毒、抗炎和抗肿瘤等作用[3]。相关的研究发现,龙葵碱可抑制肝癌、胰腺癌、乳腺癌等多种类型肿瘤细胞的生长[4-6]。Krüppel样转录因子 16(Krüppel-like transcription factor 16,KLF16)是 Krüppel样转录因子家族成员之一,参与细胞周期和启动子依赖性方式的转录调节[7]。KLF16在肺腺癌中通过抑制肿瘤细胞增殖、诱导细胞凋亡发挥肿瘤抑制作用[8]。转录因子KLF16可通过细胞色素p450酶抑制子宫内膜生理和代谢[9]。据报道,KLF16通过调节肝配蛋白受体A5(recombinant ephrin A5,EphA5)的表达影响视网膜神经节细胞中神经突向外生长[10]。以上研究表明龙葵碱和KLF16在抑制肿瘤生长,诱导肿瘤细胞凋亡中,二者具有一致性。因此本实验探讨龙葵碱联合KLF16基因对胶质瘤细胞增殖、凋亡的影响,并初步探讨其作用机制,以期为胶质瘤的治疗提供新思路。
1 材料与方法
1.1 材料
龙葵碱(美国Sigma公司),质量分数>95%,以二甲基亚砜稀释至1 mg/mL,经0.22 μm滤膜过滤除菌,在-20℃条件下储存,使用时以DMEM培养基稀释到所用浓度。人胶质母细胞瘤U87细胞(中国科学院上海细胞库);DMEM培养基、胎牛血清(美国HyClone公司);胰蛋白酶、青链霉素(杭州四季青生物工程材料有限公司);二甲基亚砜、MTT试剂(美国Sigma公司);转染试剂(美国赛默飞世尔公司);特异性KLF16siRNA和阴性对照siRNA Control(广州市锐博生物科技有限公司);AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒(日本TaKaRa公司);Trizol试剂(碧云天生物技术研究所);逆转录试剂盒、SYBR Green PCR Master Mix实时荧光定量PCR试剂盒(上海生工生物工程有限公司);兔抗人KLF16抗体、兔抗人Ki-67抗体、兔抗人PCNA抗体、兔抗人Bax抗体、兔抗人Bcl-2抗体及山羊抗兔IgG(美国Abcam公司)。
1.2 细胞培养
人胶质母细胞瘤U87细胞培养在含10%胎牛血清、含100 U/L青链霉素的DMEM培养基中,置入饱和湿度、体积分数为5%CO2、37℃恒温培养箱中,根据细胞生长状态及时更换新鲜培养液,每隔1~2 d用胰蛋白酶传代1次。取对数增殖期的U87细胞用于实验。
1.3 特异性KLF16siRNA转染细胞
取对数生长期的U87细胞接种到6孔板中,接种密度为5×105个/孔,置于37℃培养箱继续培养,待细胞汇合密度达60%时,按照转染试剂说明说进行转染实验,其中转染特异性KLF16siRNA的U87细胞设置为si-KLF16组,转染阴性对照siRNA Control的U87细胞设置为si-NC组,转染后各组U87细胞置37℃培养箱继续培养。
1.4 qRT-PCR检测U87细胞中KLF16mRNA表达水平
转染48 h后分别收集si-NC组和si-KLF16组U87细胞,按照Trizol试剂说明说提取细胞中总RNA,使用逆转录试剂盒合成cDNA,以实时荧光定量PCR检测试剂盒进行扩增,KLF16上游引物:5′-GTGTACCAAGCGGTTCACC-3′;下 游 引物 :5′-CAGGTCGTCGCAGGAGTTC-3′。内参GAPDH上游引物:5′-GCTCTCTGCTCCTCCTGTTC-3′;下游 引 物:5′-CCAAATCCGTTGACTC-3′。采 用2-ΔΔCt法分析各组细胞中KLF16mRNA相对表达水平。
1.5 Western blot检测U87细胞中KLF16蛋白表达水平
转染48 h后,收集si-NC组和si-KLF16组U87细胞,加入RIPA细胞裂解液,于冰上提取细胞中总蛋白,加入上样缓冲液,加热变性,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,分离蛋白后电转至PVDF膜上,将膜置5%脱脂奶粉中封闭2 h,分别加入KLF16和GAPDH一抗(KLF16一抗1∶800稀释,GAPDH一抗1∶1 000稀释),4℃过夜杂交,再加入二抗(1∶3 000稀释),室温杂交2 h。采用ECL法显色,在凝胶成像仪中拍照,采用Image J软件分析各条带灰度值,以KLF16条带灰度值与GAPDH条带灰度值的比值表示KLF16蛋白相对表达水平。
1.6 龙葵碱对U87细胞的毒性实验
对数生长期si-NC组和si-KLF16组U87细胞接种到96孔板中,调整细胞密度为5×105个/孔,分别向si-NC组和si-KLF16组U87细胞加入0、2.5、5、10、20、30 μg/μL的龙葵碱,每组3个复孔,分别孵育48 h,向每孔细胞中加入100 μL MTT溶液,37℃常规培养箱中继续培养4 h,除去旧培养液,再加入150 μL二甲基亚砜,混匀后,室温振荡反应10 min,待紫色结晶完全溶解,在全自动酶标仪上测定450 nm波长处光密度值(optical density,OD值),计算细胞增殖抑制率,增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%。选取增殖抑制率接近50%的龙葵碱浓度即半数抑制浓度(half maximal inhibitory concertration,IC50)为实验加药标准浓度,并将U87细胞设成 4组:si-NC 组、si-KLF16组、si-NC+Sol组和si-KLF16+Sol组。
1.7 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞增殖能力
将对数生长期的si-NC组和si-KLF16组U87细胞接种到6孔板中,调整细胞密度为5×105个/孔,37℃培养箱过夜培养,待细胞覆盖率达60%时,分别向si-NC+Sol组和si-KLF16+Sol组U87细胞中加入标准浓度(20 μg/μL)的龙葵碱,37℃培养箱处理48 h,向各组U87细胞中加入MTT溶液100 μL,继续孵育4 h,再加入150 μL二甲基亚砜,振荡反应10 min,酶标仪测定450 nm处的OD值,计算各组细胞增殖率,增殖率=实验组OD值/对照组OD值×100%。
1.8 流式细胞仪检测细胞凋亡情况
si-NC组、si-KLF16组、si-NC+Sol组和si-KLF16+Sol组U87细胞按照1.7处理48 h,收集各组细胞,PBS洗涤细胞3次,用1×Binding Buffer结合缓冲液重悬细胞,向细胞悬液中分别加入 AnnexinⅤ-FITC 和 PI各 5 μL,混匀后室温避光反应20 min,立即上流式细胞仪检测细胞凋亡情况。
1.9 Western blot检测各组U87细胞中增殖细胞核抗原(ProliferatingCellNuclearAntigen,PCNA)、Ki-67、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)和 B 细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)蛋白表达水平。
si-NC组、si-KLF16组、si-NC+Sol组和si-KLF16+Sol组U87细胞按照1.7处理48 h,收集并提取细胞中总蛋白,检测各组细胞中Ki-67、PCNA、Bax和Bcl-2蛋白相对表达水平,方法同1.5。
1.10 统计学分析
使用SPSS 21.0软件进行数据统计分析,计量资料均以表示,2组数据间比较采用t检测分析,多组间差异比较采用单因素方差分析,两两组间差异比较采用SNK-q检验分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1KLF16基因转染效果检测
分别将特异性KLF16siRNA和阴性对照siRNA Control转染胶质瘤U87细胞,48 h后qRT-PCR和Western blot检测结果显示,si-KLF16组U87细胞中KLF16mRNA和蛋白表达水平显著低于si-NC组(t1=12.277,t2=14.742,P<0.05),见图1和表1。
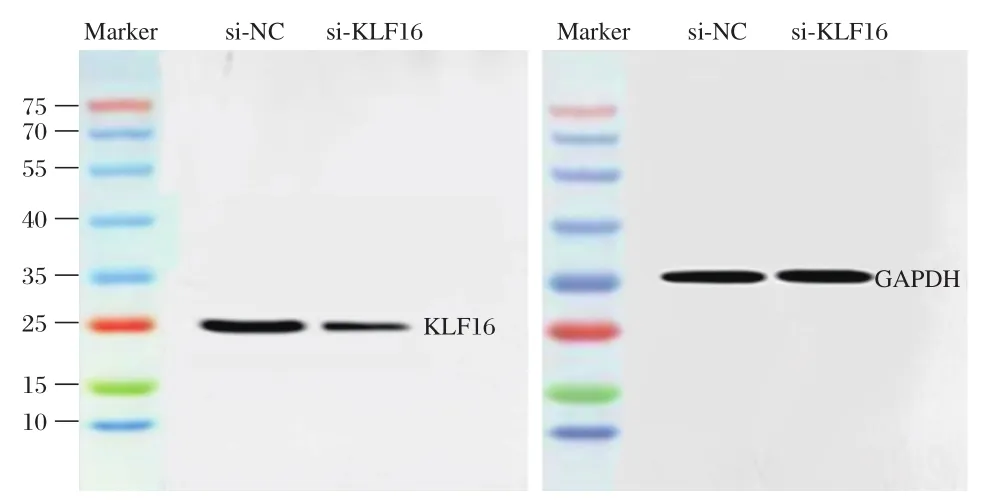
图1 Western blot检测si-NC组和si-KLF16组U87细胞中KLF16蛋白表达情况Figure1 Western blot analysis of KLF16 protein expression in si-NC group and si-KLF16 group U87 cells
表1 转染后对U87细胞中KLF16表达的影响(±s)Table1 Effect of KLF16 expression on U87 cells after transfection(±s)
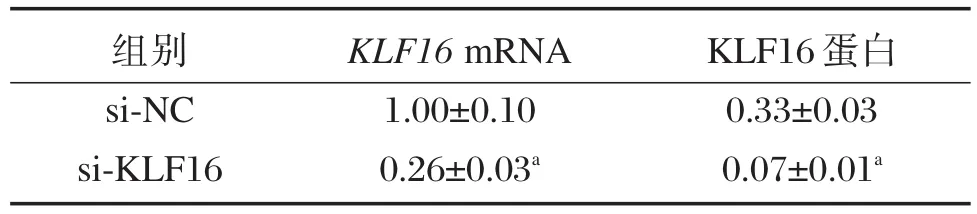
表1 转染后对U87细胞中KLF16表达的影响(±s)Table1 Effect of KLF16 expression on U87 cells after transfection(±s)
与si-NC组比,aP<0.05。
组别si-NC si-KLF16 KLF16 mRNA 1.00±0.10 0.26±0.03a KLF16蛋白0.33±0.03 0.07±0.01a
2.2 龙葵碱对胶质瘤U87细胞的细胞毒性作用
本实验选择不同浓度(2.5、5、10、20、30 μg/μL)的龙葵碱作用于si-NC组和si-KLF16组U87细胞48 h,MTT法测定细胞增殖抑制率,结果显示(见表2),龙葵碱呈浓度依赖性的抑制si-NC组和si-KLF16组U87细胞增殖(P<0.05),且浓度为20 μg/μL的龙葵碱作用于si-NC组和si-KLF16组48 h时细胞增殖抑制率分别为(48.84±4.88)%和(51.34±5.13)%,增殖抑制率均在50%左右,因此选取20 μg/μL的龙葵碱作为后续实验加药浓度。
表2 不同浓度的龙葵碱作用于胶质瘤细胞48 h后细胞增殖抑制率(±s)Table2 Inhibition rate of cell proliferation after different concentrations of solanine applied to glioma cells for 48 h(±s)
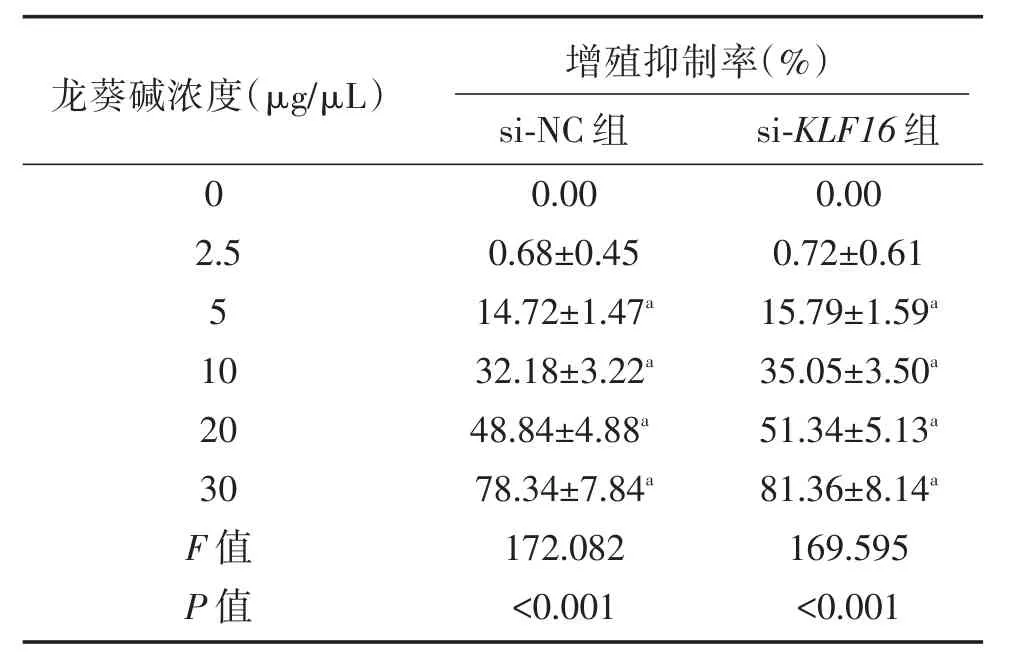
表2 不同浓度的龙葵碱作用于胶质瘤细胞48 h后细胞增殖抑制率(±s)Table2 Inhibition rate of cell proliferation after different concentrations of solanine applied to glioma cells for 48 h(±s)
与0 μg/μL龙葵碱组比,aP<0.05。
龙葵碱浓度(μg/μL)0 2.5 5 10 20 30 F值P值增殖抑制率(%)si-NC组0.00 0.68±0.45 14.72±1.47a 32.18±3.22a 48.84±4.88a 78.34±7.84a 172.082<0.001 si-KLF16组0.00 0.72±0.61 15.79±1.59a 35.05±3.50a 51.34±5.13a 81.36±8.14a 169.595<0.001
2.3 各处理组对胶质瘤U87细胞增殖的影响
MTT实验分析结果显示,与si-NC组相比,si-KLF16组、si-NC+Sol组和si-KLF16+Sol组 U87细胞增殖率明显降低(P<0.05),与si-KLF16组和si-NC+Sol组相比,si-KLF16+Sol组U87细胞增殖率显著降低(P<0.05),见表3。
2.4 各处理组对胶质瘤U87细胞凋亡的影响
流式细胞仪检测结果显示,与si-NC组相比,si-KLF16组、si-NC+Sol组和si-KLF16+Sol组 U87细胞凋亡率明显升高(P<0.05),与si-KLF16组和si-NC+Sol组相比,si-KLF16+Sol组U87细胞凋亡率升高(P<0.05),见图2和表4。
2.5 各组U87细胞中Ki-67、PCNA、Bax和Bcl-2蛋白表达情况

图2 流式细胞仪检测细胞凋亡情况Figure2 Flow cytometry to detect apoptosis
表3 各处理组U87细胞增殖能力(±s)Table3 U87 cell proliferation ability of each treatment group(x ± s)
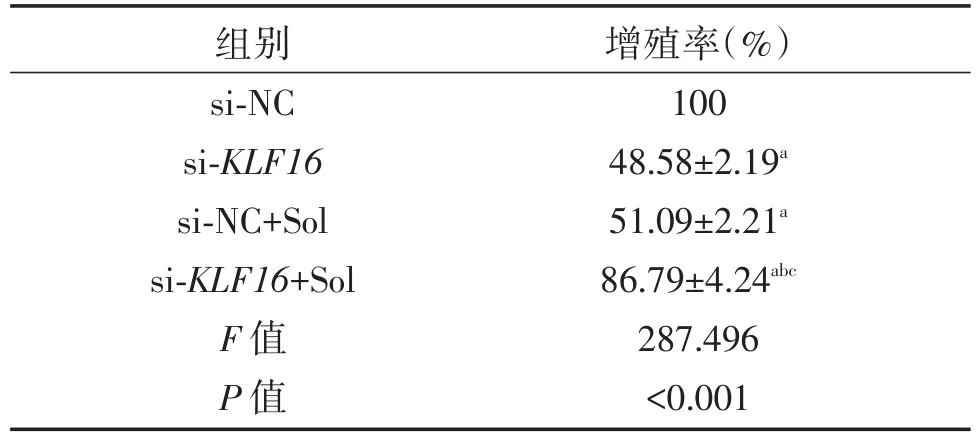
表3 各处理组U87细胞增殖能力(±s)Table3 U87 cell proliferation ability of each treatment group(x ± s)
与 si-NC 组比,aP<0.05;与si-KLF16组比,bP<0.05;与si-NC+Sol组比,cP<0.05。
组别si-NC si-KLF16 si-NC+Sol si-KLF16+Sol F值P值增殖率(%)100 48.58±2.19a 51.09±2.21a 86.79±4.24abc 287.496<0.001
表4 各处理组U87细胞凋亡率比较(±s)Table4 Comparison of Apoptosis Rates of U87 Cells in Each Treatment Group(±s)
表4 各处理组U87细胞凋亡率比较(±s)Table4 Comparison of Apoptosis Rates of U87 Cells in Each Treatment Group(±s)
与 si-NC 组比,aP<0.05;与si-KLF16组比,bP<0.05;与 si-NC+Sol组比,cP<0.05。
组别si-NC si-KLF16 si-NC+Sol si-KLF16+Sol F值P值凋亡率(%)1.97±0.55 26.66±4.29a 19.24±4.36a 58.79±5.68abc 97.001<0.001
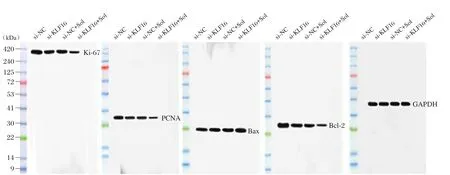
图3 Western blot检测各组U87细胞中Ki-67、PCNA、Bax和Bcl-2蛋白水平Figure3 Western blot analysis of Ki-67,PCNA,Bax and Bcl-2 protein levels in U87 cells
表5 各组U87细胞中Ki-67、PCNA、Bax和Bcl-2蛋白表达水平比较(±s)Table5 Comparison of Ki-67,PCNA,Bax and Bcl-2 protein expression levels in U87 cells of each group(±s)
表5 各组U87细胞中Ki-67、PCNA、Bax和Bcl-2蛋白表达水平比较(±s)Table5 Comparison of Ki-67,PCNA,Bax and Bcl-2 protein expression levels in U87 cells of each group(±s)
与si-NC组比,aP<0.05;与si-KLF16组比,bP<0.05;与si-NC+Sol组比,cP<0.05。
Bcl-2 0.85±0.08 0.53±0.05a 0.57±0.06a 0.20±0.03abc 63.485<0.001组别si-NC si-KLF16 si-NC+Sol si-KLF16+Sol F值P值Ki-67 0.83±0.10 0.58±0.06a 0.60±0.06a 0.31±0.03abc 30.011<0.001 PCNA 0.78±0.08 0.49±0.05a 0.49±0.05a 0.24±0.03abc 47.545<0.001 Bax 0.47±0.05 0.86±0.09a 0.81±0.08a 1.21±0.11abc 37.811<0.001
Western blot检测各组胶质瘤U87细胞中Ki-67、PCNA、Bax和Bcl-2蛋白表达情况,结果显示,与si-NC组相比,si-KLF16组、si-NC+Sol组和si-KLF16+Sol组U87细胞中Ki-67、PCNA和Bcl-2蛋白表达下调(P<0.05),Bax蛋白表达上调(P<0.05);与 si-KLF16组和 si-NC+Sol组相比,si-KLF16+Sol组U87细胞中Ki-67、PCNA和Bcl-2蛋白表达下调(P<0.05),Bax蛋白表达上调(P<0.05)。见图3和表5。
3 讨论
胶质瘤具有发病率高、复发率高、死亡率高、治愈率低的特点,是目前成人中最常见的原发性脑肿瘤[11]。传统的治疗策略通常将肿瘤切除与放疗和化疗相结合,但治疗效果往往不能令人满意[12]。与此同时,放疗及化疗产生的多种毒副作用在很大程度上限制了胶质瘤的疗效。因此,探索更高效更合理的联合治疗手段对胶质瘤的治疗具有非常重要的意义。目前备受青睐的分子靶向治疗和中药联合使用具有良好的应用前景[13]。KLF16在肺腺癌中发挥抑制基因的作用,其表达量的高低与患者生存率密切相关[8]。本实验将特异性KLF16siRNA转染人胶质瘤U87细胞中,qRT-PCR和Western blot检测结果显示转染KLF16siRNA后U87细胞中KLF16mRNA和蛋白表达水平均明显降低,表明转染KLF16siRNA能够有效沉默U87细胞中KLF16。MTT实验和流式细胞仪检测结果显示,沉默KLF16基因后U87细胞增殖明显受到抑制,细胞凋亡增加。这与近期Chen等[14]人的报道一致,该报道指出KLF16可通过靶向线粒体转录因子A(mitochondrial transcription factor A,TFAM)抑制人脑胶质瘤细胞增殖和致肿瘤。另有研究表明,KLF16可抑制胰腺癌细胞生长和转化,阻滞细胞周期于S期,诱导细胞凋亡[14]。Ma等[16]人研究显示,KLF16通过调节 p21和CDK4促进胃癌细胞的增殖。提示KLF16作为一种肿瘤细胞调控因子,参与肿瘤细胞的生长、增殖、凋亡、侵袭和迁移等生物学过程。
相关研究显示,龙葵碱不仅具有抗炎作用还具有抗肿瘤活性[17-18]。近期郭玲等人[19]研究指出,龙葵碱能够呈浓度依赖性的抑制人胶质瘤U251细胞增殖、侵袭和迁移,并诱导细胞凋亡。本研究通过预实验结合郭玲等人的研究探索出龙葵碱对胶质瘤U87细胞的有效作用浓度,并将龙葵碱浓度分别配置成2.5、5、10、20、30 μg/μL作用于沉默KLF16或阴性对照组U87细胞,MTT实验检测龙葵碱对U87细胞毒性作用,并筛选出浓度为20 μg/μL龙葵碱为后续实验加药浓度。并且MTT实验和流式细胞仪检测结果发现,20 μg/μL的龙葵碱能够抑制U87细胞增殖,诱导细胞凋亡。为进一步探究二者联合使用的协同作用效果,本实验将沉默KLF16和20 μg/μL的龙葵碱联合作用U87细胞,结果发现,二者联合作用对U87细胞增殖抑制及凋亡诱导作用更强。本实验通过Western blot检测各处理组U87细胞中Ki-67、PCNA、Bax和Bcl-2蛋白水平,结果发现龙葵碱或沉默KLF16均可下调U87细胞中Ki-67、PCNA和Bcl-2蛋白表达,上调Bax蛋白表达,且龙葵碱联合沉默KLF16作用更强。增殖细胞核抗原Ki-67和PCNA是细胞处于增殖状态的标志物,已广泛在肿瘤细胞中应用[20-21]。Bcl-2基因是细胞凋亡研究最多基因之一,其具有抑制细胞凋亡的功能。Bax是Bcl-2基因家族中促进细胞凋亡的基因,其过度表达能够拮抗Bcl-2的保护作用使细胞趋于凋亡[22]。本实验结果提示龙葵碱联合KLF16基因对胶质瘤细胞增殖抑制和凋亡诱导作用机制可能与下调Ki-67、PCNA和Bcl-2蛋白表达,上调Bax蛋白表达有关。
综上,龙葵碱联合沉默KLF16基因对胶质瘤U87细胞有增殖抑制和凋亡促进作用,并且联合作用比单独使用龙葵碱或沉默KLF16基因效果更明显。本实验结果提示,中药和靶向基因治疗联合使用在治疗胶质瘤中有可能发挥较好作用,但其适用性和治疗效果尚待深入探究。

