细胞免疫联合手术对结直肠癌肝转移患者生存质量的影响
许立国 冯广森 林亚超 李智
肝脏是结直肠癌最常见血行散播靶器官。约50%结直肠癌患者在初诊时出现肝转移,约15%~25%患者在病程中出现异时性肝转移,其中80%肝转移患者肝转移灶不能获得根治性切除,成为导致患者死亡的主要原因[1]。因此如何预防、治疗结直肠癌肝转移成为临床研究热点。近年来过继免疫疗法治疗恶性肿瘤逐渐受到人们关注尤其是晚期癌症[2]。树突状细胞-细胞因子诱导的杀伤细胞(dendritic cell-cytokine-induced killer,DCCIK)免疫技术是一种细胞生物免疫治疗技术,它利用树突状细胞与细胞因子诱导的杀伤细胞定向精准杀伤肿瘤[3]。氩氦刀冷冻消融术是一种局部超低温冷冻消融肿瘤微创类先进医疗技术,能通过冷冻+热疗消除肿瘤[4]。本研究选取结直肠癌肝转移患者,从全血T淋巴细胞亚群、血清癌胚抗原(carcinoembryonic antigen,CEA)水平及生存质量等角度,观察DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术应用价值,为结直肠癌肝转移的治疗提供参考,报道如下。
1 资料和方法
1.1 一般资料
选取2016年1月至2018年3月本院收治的68例结直肠癌肝转移患者,简单随机划分为对照组(34例)和观察组(34例),两组年龄、病程、肿瘤最大直径、性别、体质量指数、肝转移灶数量、原发病类型、转移类型、临床分期、病理分型、分化程度、合并疾病等资料均衡可比(P>0.05),见表1。本研究患者均自愿签署知情同意书,经本院伦理委员会审核批准。
1.2 纳入标准及排除标准
(1)纳入标准:无腹水、黄疸、出血倾向;符合结直肠癌肝转移诊断标准[5];无其他脏器转移及肝功能衰竭;自愿签署知情同意书;(2)排除标准:存在其他原发性恶性肿瘤者;合并严重病毒、细菌感染者;存在生物制品过敏史及自身免疫疾病者;存在药物无法控制高血压者;合并急性心脑血管疾病者;伴有传染类疾病者。
1.3 方法
1.3.1 主要试剂/仪器
anti-CD3单克隆抗体(Peprotech公司,美国);GT-T551培养基(TaKaRa公司,日本);重组人干扰素 γ(rh IFN-γ)(Novoprotein 公司);Ficoll-Hypaque淋巴细胞分离液(GE Healthcare公司,美国);重组人白介素-4(recombinant human Interleukin-4,rh IL-4)(Peprotech公司,美国);重组人肿瘤坏死因子(recombinant human tumor necrosis factor-α,rh TNF-α)(Peprotech公司,美国);粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)(Peprotech公司,美国);重组人白介素-1α(recombinant human interleukin-1α,rh IL-1α)(Sinobiological公司);重组人白介素-2(recombinant human interleukin-2,rh IL-2)(北京四环生物制药有限公司);血细胞分离机(南京惠杰医疗科技有限公司);电子计算机断层扫描机(computed Tomography,CT)(中国新博医疗技术有限公司);冷冻消融系统(Galil Medical Ltd。公司,以色列)。
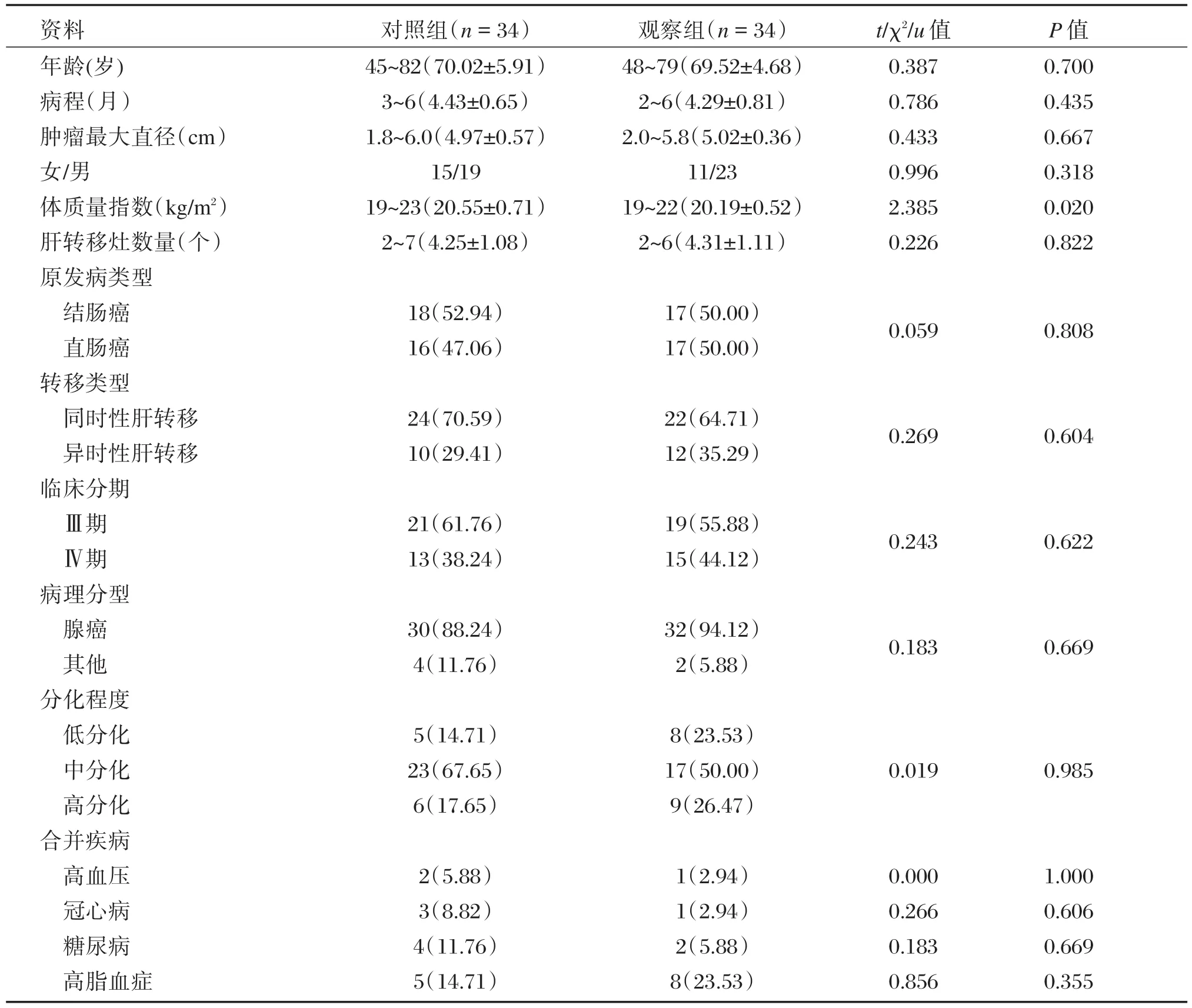
表1 两组临床资料对比Table1 Comparison of clinical data between two groups
1.3.2 对照组治疗方法
对照组予以CT引导下氩氦刀冷冻消融术。(1)术前:实施CT定位扫描,整体评估手术可行性,明确进针数量、方向、冷冻范围、路径等,设计包含3、2、5 mm在内多种组合,以单刀或多刀组合方式进行穿刺,肿瘤组织尽可能全部被冰球包容,冷冻范围>肿瘤边缘1.0 cm,穿刺路径设计时注意重要神经与大血管。(2)手术方法:3.0T CT机,根据穿刺路径要求取合适体位实施CT扫描,再次明确进针方向、进针点,测量进针距离,标记定位肿瘤相应皮肤表面,常规消毒铺巾、局部浸润麻醉,CT引导下按预定路径插入氩氦刀至目标深度。核实无误后,开启氩氦靶向治疗系统冷冻消融系统按40%氩气输出功率超低温快速冷冻,维持-140℃~-160℃温度15 min,启动氦气升温至20℃,再启动超低温快速冷冻,共重复2个循环,氩氦刀超导探头可拔动时退刀,再次实施CT扫描,观察冷冻效果、是否有出血等情况,穿刺通道止血,对应部位皮肤进行消毒、包扎。(3)术后嘱患者定期随访。
1.3.3 观察组治疗方法
观察组予以DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术(方法同对照组)。消融术实施DC-CIK细胞免疫:(1)先按流程制备DC-CIK细胞,确定细菌、真菌检验结果阴性,抽样5 mL,台盼蓝染色,观察计数活细胞与死细胞数量,并检测明确内毒素阴性,收集24瓶细胞,置于无菌离心瓶内,离心8 min后弃去上清,0.9%注射用水平衡细胞,离心清晰,弃去上清,收集细胞至注射用生理盐水中(0.9%,100 mL),注入50%5 mL人血白蛋白,混匀后抽样1 mL置于-4℃以备测。(2)核对患者信息,无误后进行回输,1个月1次,共回输3次。
1.4 疗效评定
参照实体瘤疗效评判标准[6]分为4个等级。完全缓解(complete response,CR):病灶消失,维持4周以上;部分缓解(partial remission,PR):病灶减少≥50%,维持4周以上;稳定(stable disease,SD):病灶减少<50%或增大<25%,无新发病灶,维持4周以上;进展(progressive disease,PD):病灶增大≥25%。缓解率=(CR+PR)/总例数×100%。
1.5 观察指标
1.5.1 标本采集与检测
采集EDTA抗凝静脉血2 mL,以流式细胞仪检测全血T淋巴细胞亚群(CD3+、CD4+、CD8+)水平;采集静脉血3 mL,4 000 r/min离心10 min分离血清,利用化学发光免疫分析法检测血清糖类抗原242(carbohydrate antigen 242,CA242)、CEA、糖类抗原 199(carbohydrate antigen 199,CA199)水平;取500 μL血清样本,以Trizol法提取总RNA,以反转录试剂盒反转录为cRNA,以U6小核RNA为内参照,以cRNA为模板,设计内参U6上下游引物分别为 5′-CTCGCTTCGGCAGCACA-3′、5′-AACGCTTCACGAATTTGCGT-3′,微小 RNA(miR)-21上下游引物分别为5′-GCGGCGGTAGCTTATCAGACTG-3′、5′-ATCCAGTGCAGGGTCCGAGG-3′,miR-106a 上下游引物分别为 5′-GCGGCGGAAAAGTGCTTACAGTG-3′、5′-ATCCAGTGCAGGGTCCGAGG-3′,以荧光定量PCR检测miR-21、miR-106a表达,反应体系包括PCR反应缓冲液10 μL、引物 1 μL、逆转录产物 1.33 μL、5 U/μL Taq DNA聚合酶2.5 U,应用无酶水补充至25 μL,混合液稍离心后立即置于PCR仪上,执行扩增,反应条件95℃预变性15 min、94℃变性15 s、55℃ 30 s、70℃ 34 s,共40个循环,最后在72℃保温7 min,OCR产物放置4℃下电泳检测。
1.5.2 观察指标
(1)比较两组术后3个月缓解率。(2)比较两组术前、术后3个月T淋巴细胞亚群(CD3+、CD4+、CD8+)水平。(3)比较两组术前、术后3个月CA242、CEA、CA199水平。(4)比较两组术前、术后3个月miR-21、miR-106a表达量。(5)比较两组术前、术后3个月生存质量:以欧洲癌症研究治疗组织研发癌症患者生存质量评定量表(European Organisation for Research and Treatment Cancer Quality of Life-C30,EORTC QLQ-C30)[3],分为 5 个功能量表(包含2个条目认知功能量表、2个条目社会功能量表、4个条目情绪功能量表、5个条目躯体功能量表、2个条目角色功能量表)、1个整体生活质量量表(2个条目)、3个症状量表(包含2个条目恶心呕吐量表、2个条目疼痛量表、3个条目疲乏量表)、6个单项测量项目,共30个条目,整体生活质量量表分为1(最低生活质量)~7级(最高生活质量),功能量表评分分为1(最低功能)~4级(最高功能),其他条目分为1~4级,整体生活质量量表、功能量表评分越高,质量或功能越佳,症状量表、单项测试项目评分越高,对应测试条目越严重。
1.6 统计学方法
采用SPSS 22.0统计学软件处理数据,计量资料以表示,以t检验,计数资料用n(%)表示,以χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组疗效比较
观察组术后3个月CR、PR、SD、PD分别有3、13、11、2例,缓解率为 61.76%;对照组 CR、PR、SD、PD分别有 3、4、19、8例,缓解率为20.59%,两组比较差异具有统计学意义(P<0.05),见表2。单个病例术前、术后3个月肝脏CT图见图1。

表2 两组疗效比较[n(%)]Table2 Comparisons of curative effects between the two groups[n(%)]
患者性别男,59岁,图1A为其术前肝脏CT图像,可见面积较大癌灶,经DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术治疗后3个后癌灶面积明显减小,见图1B。
2.2 两组血清T淋巴细胞亚群比较
观察组术后 3 个月 CD3+、CD4+、CD4+/CD8+高于对照组,差异具有统计学意义(P<0.05),见表3。
2.3 两组CA242、CEA、CA199水平比较
观察组术后3个月CA242、CEA、CA199低于对照组,差异具有统计学意义(P<0.05),见表4。
2.4 两组miR-21、miR-106a表达比较
观察组术后3个月miR-21、miR-106a表达量低于对照组,差异具有统计学意义(P<0.05),见表5。
2.5 两组EORTC QLQ-C30评分比较
观察组术后3个月功能量表、整体生活质量量表评分高于对照组,症状量表、单项测试项目评分低于对照组,差异具有统计学意义(P<0.05),见表6。
3 讨论
CT引导下氩氦刀冷冻消融术是近年来发展起来冷冻治疗技术,能用于多种肿瘤治疗,尤其适用于不能耐受手术或不能手术切除患者,其主要通过能迅速降温的氩气,封闭肿瘤形成冰晶,促使癌细胞脱水、破裂,再利用能迅速升温的氦气,融化冰晶,促使癌灶发生肿胀、破裂。以往实践证实,氩氦刀冷冻消融术能保留更多正常肝组织,且安全性高[7]。王猛等[8]以 CT 引导下氩氦刀冷冻消融术治疗侵及胸膜或胸壁恶性肿瘤,发现患者术后病变得到不同程度消融。但根据梁淑贞等[9]报道,42个肝、肺恶性肿瘤病灶氩氦刀冷冻消融术后,16个病灶有肿瘤残存,可见单一依赖氩氦刀冷冻消融术不能将全部肿瘤完全消除。
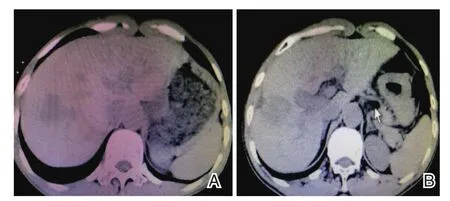
图1 治疗前后肝脏CT图像Figure1 CT image of liver before and after treatment
表3 两组血清T淋巴细胞亚群比较(±s)Table3 Comparison of serum T lymphocyte subsets between two groups(± s)

表3 两组血清T淋巴细胞亚群比较(±s)Table3 Comparison of serum T lymphocyte subsets between two groups(± s)
时间术前n组别观察组对照组t值P值观察组对照组t值P值34 34术后3个月34 34 CD3+(%)52.66±5.32 53.21±4.88 0.444 0.658 64.48±10.23 52.97±6.19 5.613 0.000 CD4+(%)23.34±5.61 24.47±7.32 0.714 0.478 34.09±8.21 23.28±4.73 6.653 0.000 CD4+/CD8+0.86±0.17 0.88±0.16 0.499 0.619 1.27±0.24 0.84±0.20 8.026 0.000
表4 两组CA242、CEA、CA199水平比较(±s)Table4 Comparison of CA242,CEA and CA199 levels between two groups(± s)
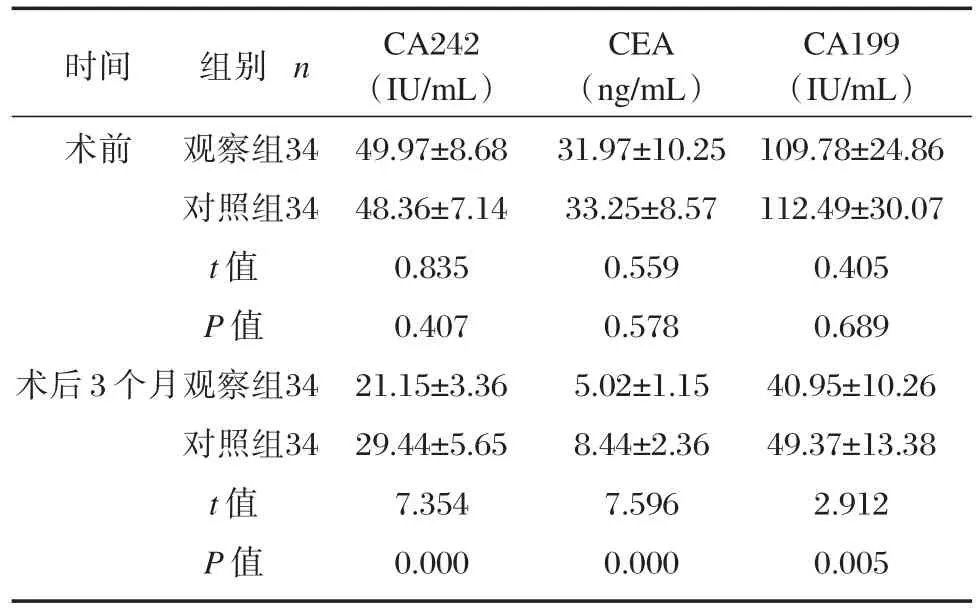
表4 两组CA242、CEA、CA199水平比较(±s)Table4 Comparison of CA242,CEA and CA199 levels between two groups(± s)
时间术前n组别观察组对照组t值P值观察组对照组t值P值34 34术后3个月34 34 CA242(IU/mL)49.97±8.68 48.36±7.14 0.835 0.407 21.15±3.36 29.44±5.65 7.354 0.000 CEA(ng/mL)31.97±10.25 33.25±8.57 0.559 0.578 5.02±1.15 8.44±2.36 7.596 0.000 CA199(IU/mL)109.78±24.86 112.49±30.07 0.405 0.689 40.95±10.26 49.37±13.38 2.912 0.005
表5 两组miR-21、miR-106a表达比较(±s)Table5 Comparison of the expression of microRNA-21 and microRNA-106 in two groups(± s)
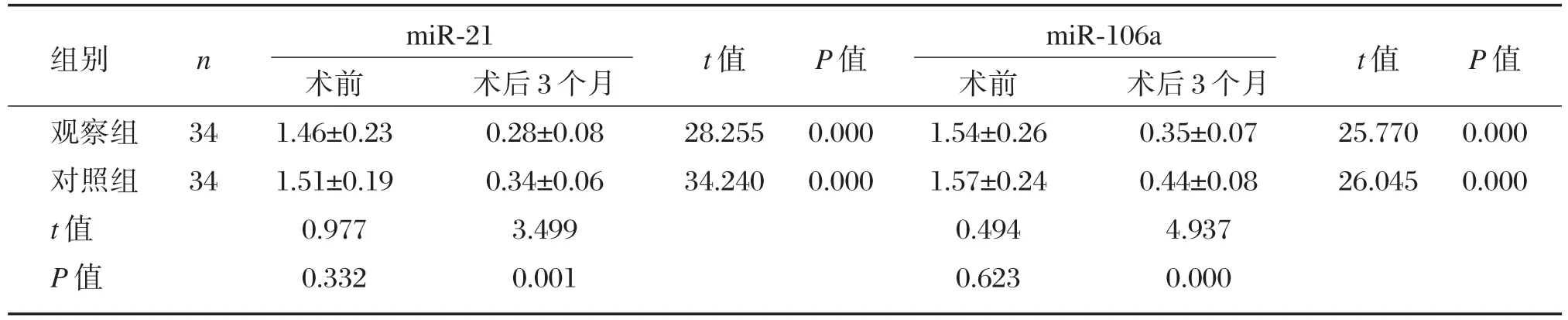
表5 两组miR-21、miR-106a表达比较(±s)Table5 Comparison of the expression of microRNA-21 and microRNA-106 in two groups(± s)
组别观察组对照组t值P值n 34 34 miR-21术前1.46±0.23 1.51±0.19 0.977 0.332术后3个月0.28±0.08 0.34±0.06 3.499 0.001 t值28.255 34.240 P值0.000 0.000 miR-106a术前1.54±0.26 1.57±0.24 0.494 0.623术后3个月0.35±0.07 0.44±0.08 4.937 0.000 t值25.770 26.045 P值0.000 0.000
表6 两组EORTC QLQ-C30评分比较(±s,分)Table6 Comparison of EORTC QLQ-C30 scores between the two groups(±s,score)
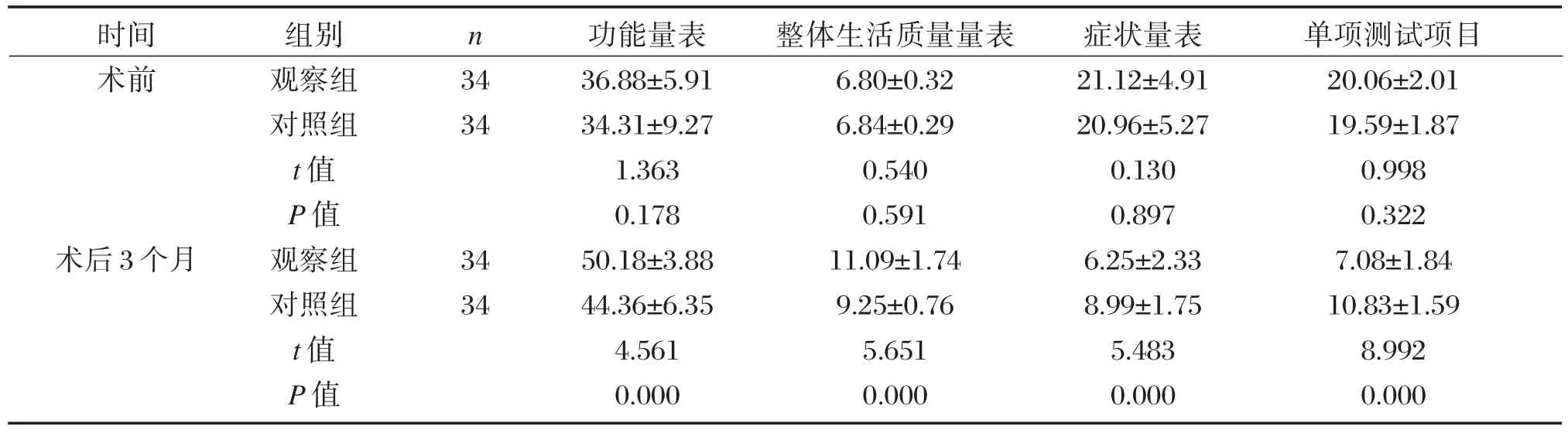
表6 两组EORTC QLQ-C30评分比较(±s,分)Table6 Comparison of EORTC QLQ-C30 scores between the two groups(±s,score)
时间术前n 34 34术后3个月组别观察组对照组t值P值观察组对照组t值P值34 34功能量表36.88±5.91 34.31±9.27 1.363 0.178 50.18±3.88 44.36±6.35 4.561 0.000整体生活质量量表6.80±0.32 6.84±0.29 0.540 0.591 11.09±1.74 9.25±0.76 5.651 0.000症状量表21.12±4.91 20.96±5.27 0.130 0.897 6.25±2.33 8.99±1.75 5.483 0.000单项测试项目20.06±2.01 19.59±1.87 0.998 0.322 7.08±1.84 10.83±1.59 8.992 0.000
近年来研究发现,机体不能对癌细胞产生主动免疫或免疫作用较弱的原因在于缺少抗原递呈类分子,不能被T细胞识别,导致肿瘤组织在体内增殖、转移[10]。而DC-CIK可激活T细胞因子,启动机体主动免疫,这为细胞免疫治疗癌症提供了理论基础。其中CIK来源于自体外周血单个核细胞,是类似于自然杀伤细胞的T细胞,能通过癌细胞细胞膜,裂解肿瘤细胞,且经过体外培养技术获得大幅度增长,杀伤癌细胞能力明显增强。但研究发现,单独应用CIK时常因癌细胞产生抵抗作用难以取得预期疗效[11]。DC是机体一种功能最强大专职抗原递呈细胞,对T细胞活化及抵抗癌细胞免疫逃逸具有重要作用[12]。国外相关资料指出,结直肠癌患者存在不同程度DC数量减少或功能缺陷[13-15]。而体外试验表明,DC-CIK细胞能调节免疫状态,抑制肿瘤细胞生长[16]。可见DC-CIK细胞可能有助于肿瘤治疗,故有学者对此进行探讨,如Zhang等[17]指出,DC-CIK 免疫治疗能延长晚期非小细胞肺癌患者总生存时间;Zhang等[18]研究以DC-CIK细胞治疗肝癌,发现患者免疫功能增强,提示DC-CIK治疗非小细胞肺癌、肝癌有利于病情控制与改善。与Zhang L、Zhang J学者不同的是,本研究对象为结直肠癌肝转移患者,联合应用DC-CIK细胞免疫、CT引导下氩氦刀冷冻消融术两种方法,结果显示,观察组术后3个月缓解率(61.76%),高于对照组的缓解率(20.59%),且观察组CD3+(%)、CD4+(%)、CD4+/CD8+高于对照组(P<0.05),提示两种方法联合能提高结直肠癌患者的免疫功能,增强对肿瘤的杀灭作用,疗效显著。
CA242、CEA、CA199是常用血清肿瘤标志物[19-21]。邱绪文等[22]报道发现,CA242、CEA、CA199联合诊断结直肠癌准确性、敏感性可达95.12%、81.69%,且Ⅲ~Ⅳ期结直肠癌明显高于Ⅰ~Ⅱ期患者。Huo等[23]指出,血清CEA和CA125可反映患者预后。本研究结果显示观察组术后3个月CA242、CEA、CA199低于对照组(P<0.05),提示联合应用DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术能降低患者血清肿瘤标志物水平,从侧面印证了两种方法联合效果优于单一消融术。另观察组术后3个月功能量表、整体生活质量量表评分高于对照组,症状量表、单项测试项目评分低于对照组(P<0.05),提示DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术能提高患者生存质量。
miRNA是长度约为21~25 bp核苷酸非编码RNA分子,具有丰富结构、序列、丰度,因而表达方式多种多样,能通过抑制翻译、降解、切断调控靶基因。目前关于miRNA对原癌基因、抑癌基因影响尚处于探索阶段[24-27]。Tusong等[28]研究发现,与正常组织相比,miR-21、miR-106a在肾细胞癌中表达水平明显增加,提示两者可能与肾细胞癌发生有关,而不同癌细胞增殖、浸润受多种miRNA共同基因调控,故miR-21、miR-106a可能与其他类型肿瘤有关。Okugawa等[29]指出,miR-21 与结直肠癌患者肌肉减少症有关,而肌肉减少是无进展生存独立危险因素,说明miR-21与结直肠癌无进展生存时间有关。本研究对此进行探讨发现,观察组术后3个月miR-21、miR-106a表达量低于对照组(P<0.05),提示DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术能抑制miR-21、miR-106a表达,这可能是两者发挥疗效作用机制之一,同时亦说明miR-21、miR-106a抑制剂可能有助于结直肠癌的治疗。但本研究资料有限,有待于后续深入探讨。同时以往学者指出,外周血miR-21、miR-106a具有特异性循环表达特点,且稳定性良好,具有作为肿瘤标志物潜质[30-32]。可见 miR-21、miR-106a具有广阔前景与研究价值。值得注意的是,本研究miR-21、miR-106a的探讨基于结直肠癌,在其他恶性肿瘤中表达仍有待验证。
综上所述,对结直肠癌肝转移患者联合应用DC-CIK细胞免疫联合CT引导下氩氦刀冷冻消融术,能提高患者免疫功能,降低患者血清肿瘤标志物水平,增强对肿瘤的杀灭作用,提高患者生存质量,其机制可能与抑制促癌miR-21、miR-106a表达有关,miR-21、miR-106a抑制剂可能为结直肠癌的治疗提供新的思路。

