贻贝足丝蛋白的汞、镉抗性及富集机制
凌文康,黄慧炜,刘 冰,邓 旭
深圳大学生命与海洋科学学院,广东深圳 518055
近年来由于工业活动多样化,环境中的重金属污染问题日益严重[1].在冶金、石油化工、电池、聚氯乙烯和采矿等生产活动中常产生多种有毒金属残留物,严重污染环境[2].重金属离子,如汞、镉、铬和银等,在极低浓度下就会对生命体产生极大的毒性[3].不仅如此,重金属污染具有来源广、残留时间长、有蓄积性、可沿生物链富集放大、污染后不易被检测,以及难以被微生物降解等缺点[4].传统的有毒金属阳离子的环境修复技术通常采用物理、化学和生物的方法,这些技术不仅处理效果有限、成本高昂,还易产生二次污染物[5].生物吸附法作为一种新兴的重金属去除技术,愈来愈受到人们的关注[6].生物吸附法通过游离或固定化的活体或灭活生物材料去除废水中的有毒物质,回收有用成分,具有成本低、效率高、选择性好、无二次污染及可回收贵重金属等优点[7].
海洋动物如贝类和鱼类等常可用于指示生物衡量海洋环境的重金属污染[8].贻贝是一种广泛分布于沿海和近海的甲壳类海洋生物,其足丝腺能分泌足丝,并通过足丝形成的足丝盘将自身固定在各种固体基材(如岩石)表面,并伴随海水的冲刷吸附各种重金属[9].WAITE等[10]研究表明,这与贻贝分泌的足丝有关,其足丝的主要成分是贻贝足丝蛋白.在生物医学、表面化学[11]和海洋工程[12]等领域中,足丝蛋白都已被广泛应用.虽然足丝分泌的足丝蛋白黏附重金属的能力已经备受关注,但对足丝蛋白黏附重金属的机理研究尚未见报道.本研究通过转录组分析翡翠贻贝足丝蛋白,构建翡翠贻贝足丝蛋白基因重组菌,探讨翡翠贻贝足丝蛋白对Hg和Cd富集机制和行为.
1 材料与方法
1.1 实验材料
1.1.1 菌株与载体
高表达载体pET-30a由深圳大学生命与海洋科学学院海洋生物资源与生态环境重点实验室提供.E.coliBL21(DE3)购于上海唯地生物技术有限公司.
1.1.2 主要试剂
TaKaRa质粒DNA小量试剂盒、TaKaRa DNA凝胶回收试剂盒、TaKaRa LA Taq Hot Start Version、TaKaRa QuickCut NdeⅠ限制性内切酶、TaKaRa QuickCut Hind Ⅲ限制性内切酶、TaKaRa T4 DNA 连接酶,以上试剂盒及试剂均购于宝日医生物技术(北京)有限公司.卡那霉素、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)、LB培养基(lysogeny broth medium)∶NaCl 10 g/L;酵母提取物(bacto-yeast extract)5 g/L;蛋白胨(bacto-tyrptone)10 g/L.
1.2 实验方法
1.2.1 翡翠贻贝足部组织转录组测序
提取翡翠贻贝足部组织的total RNA和转录组测序由深圳华大基因研究院完成.使用Illumina公司Hiseq2000测序平台,采用90 bp双端测序方法(paired-end)进行RNA-seq测序.得到数据后首先采用FastQC软件对原始数据进行质量评估;然后对原始数据进行过滤,去除含有接头的测序片段(reads),去除未知碱基(碱基N)比例高于5%的reads,去除低质量reads(read中质量值<10的碱基含量高于50%),得到干净片段(clean data);最后采用短序列拼接软件Trinity对clean data进行序列拼接组装,得到转录本序列.
1.2.2 编码基因pvfp6的PCR扩增及质粒的提取
根据转录组测序所得的pvfp6基因序列,利用Primer 5.0设计,上游引物为5’ GGATCCGGTGTTTACATCCC 3’,引入NdeⅠ酶切位点;下游引物为5’CTCGAGTTTGTAACCGTAAC3’,引入Hind Ⅲ酶切位点.pvfp6基因的反应条件为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环后;72 ℃再延伸7 min.琼脂糖凝胶电泳观察分析扩增结果,切胶回收目的基因.
在37 ℃,200 r/min条件下,以0.1%的接种量培养含pET-30a的宿主菌,14~16 h后按照TaKaRa质粒DNA小量试剂盒的实验方法步骤提取质粒,取1~2 μL进行1%琼脂糖凝胶电泳,取2 μL在分光光度计中测定浓度.
1.2.3pvfp6基因工程菌的构建
用NdeⅠ和Hind Ⅲ双酶切pvfp6基因PCR扩增产物和载体pET-30a,取5 μL进行琼脂糖凝胶电泳,Takara MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0分别切胶回收约300 bp、5 000 bp的DNA片段;使用T4 DNA Ligase连接目的基因和载体,得到重组质粒pET-30a-pvfp6,转化E.coliBL21(DE3).
1.2.4 重组质粒的验证与蛋白表达
从转化的平板中挑取单克隆,接种到30 mL的LB培养基中(含100 μg/mL的卡那霉素),用20%的甘油进行菌种保藏.为进一步验证所得的重组质粒是否为阳性,首先用pvfp6的引物以重组质粒为模板进行 PCR 扩增,电泳检测分别得到约 300 bp的条带,与原 PCR 产物大小一致.所得样品送华大基因测序.
将验证正确的重组菌以0.1%的接种量分别接种到30 mL LB培养基中,37 ℃,200 r/min过夜培养,再以1%的接种量接种到新的LB培养基中,37 ℃,180 r/min摇床培养,待培养至D(600)为0.5~0.8时,添加IPTG至终浓度为0.5 mmol/L,并置于37 ℃摇床中诱导表达.取诱导后的培养液12 000 g离心5 min,去除上清液,加入磷酸盐缓冲液重悬沉淀,最后加入SDS-PAGE上样缓冲液,于100 ℃加热样品10 min,离心取上清电泳.电泳前10 min以100 V稳压电泳,待溴酚蓝指示剂进入分离胶后200 V稳压电泳至溴酚蓝带迁移至离凝胶底部1 cm,取出凝胶用考马斯亮蓝染色液染色,随后转入脱色液中,脱色至背景清晰.
1.2.5 重组菌对Hg2+和Cd2+生长抗性及富集研究
把各重组菌及对照菌以0.1%的接种量,接到液体LB培养基中,37 ℃,180 r/min振荡过夜培养(12~16 h).其中,培养重组菌和对照菌的培养基添加了100 μg/mL卡那霉素.以1%的接种量转接到新的液体LB培养基中,培养至D(600)值为0.5~0.7(约2.5 h)时添加IPTG至终浓度为1 mmol/L,诱导4 h后,以2%的接种量将重组菌和对照菌分别接种到添加不同Hg2+和Cd2+质量浓度的LB培养基中,37 ℃,180 r/min振荡培养.每组每个浓度设3个平行,每隔4 h测量其D(600)值. 另外, 将一定的菌体悬浮后分别投入不同离子浓度的Hg2+和Cd2+溶液中,30 ℃,150 r/min振荡培养2 h,离心收集菌体后,利用电感耦合等离子体发射光谱仪测定上清中Hg2+和 Cd2+的质量浓度[13].
2 结果与讨论
2.1 高通量测序以及转录组的筛选与功能注释
对翡翠贻贝足部组织提取的RNA进行转录组测序,获得55 670 668个原始数据(raw reads),测序质量值Q20=98.19%, GC值为42.18%.通过过滤,获得53 047 718个clean reads,使用Trinity软件进行从头组装,获得73 571个广泛通用的基因数据库(Universal Genes,UniGenes).将翡翠贻贝足部的UniGenes注释到基因本体(gene ontology, GO)数据库,共获得9 466个注释结果,并分为51个亚类,这51个亚类归属于生化进程、细胞组成和分子功能3个功能.进一步通过KEGG注释后,发现有955个UniGenes被注释到黏着斑通路中,推测足丝蛋白黏附重金属的功能与其密切相关.综合来看,GO和KEGG途径的注释为进一步明确翡翠贻贝中特定细胞结构、通路和蛋白质功能提供了有用信息.
将实验得到的翡翠贻贝足部转录组和已公布的紫贻贝足丝蛋白序列进行blastx同源性搜索,结果如表1.最终挑选序列长度适中,半胱氨酸、组氨酸、酪氨酸含量高的足丝蛋白Pvfp6进行后续研究.
Pvfp6分子质量约为11 ku,pH(I)=5.60,其信号肽由17个氨基酸残基组成,主要涉及足丝蛋白的分泌机制.Pvfp6富含14%的半胱氨酸和8.2%的酪氨酸.半胱氨酸具有金属结合能力和氧化还原活性,将结合的重金属螯合成无毒的配合物,起到降解重金属毒性的作用[14].黏附蛋白序列中的酪氨酸具有羟基化的翻译后修饰特征,其被羟基后形成3,4-二羟基苯丙氨酸(3,4-dihydroxyphenyl alanine,DOPA,多巴),正是DOPA的存在才赋予了贻贝足丝蛋白强的黏附功能以及对重金属等可能具有的吸附作用[15].
2.2 基因 pvfp6的PCR扩增及连接
按照1.2.2节的方法得到PCR扩增产物.编码基因pvfp6的PCR产物在300 bp处出现条带,与转录组测序所得基因大小一致.提取pET-30a质粒后,将pvfp6的PCR产物定向克隆至pET-30a中,构成重组质粒.
2.3 pvfp6基因重组子的验证
将连接后的重组质粒转入感受态细胞,然后涂布在含有100 μg/mL卡那霉素的LB平板上过夜培养菌体.挑取重组菌单菌落转化子,提取转化子质粒DNA作为模板进行PCR扩增验证,再将扩增产物进行琼脂糖凝胶电泳.如图1,重组菌在300 bp处出现条带,说明所挑取单菌落转化子为阳性重组菌.最后,把重组菌的质粒分别送去测序.将已转入pvfp6基因的阳性重组子命名为P6.测序结果显示,P6重组菌成功构建,没有发生任何碱基突变.
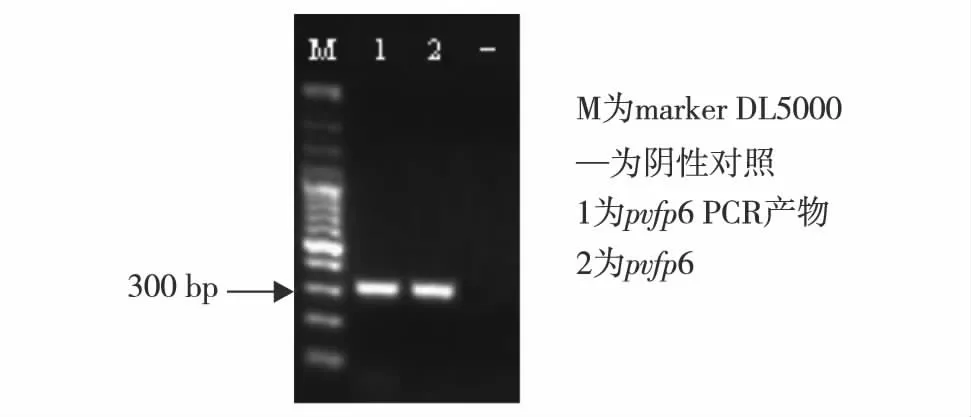
图1 重组质粒 pvfp6的PCR产物电泳检测Fig.1 Agarose gel electrophoresis of PCR product of target gene pvfp6
2.4 Pvfp6蛋白的表达
对重组菌P6(含pET-30a-pvfp6)进行诱导表达,以转入空载体pET-30a的E.coli. BL21为对照菌株,并进行SDS-PAGE电泳,结果如图2.由图2可见,工程菌P6在11 ku处附近有特异条带,而对照菌在该位置无条带,电泳检测结果与理论值基本相符,表明Pvfp6足丝蛋白已成功表达.

图2 SDS-PAGE分析Pvfp6蛋白于BL21表达情况Fig.2 SDS-PAGE analysis of Pvfp6 protein expression in BL21
2.5 P6重组菌对Hg2+和Cd2+的抗性与富集
图3给出P6重组菌与对照组30a在不同Hg2+质量浓度下的生长曲线.由图3可见,重组菌P6对Hg2+的最大抗性为5 mg/L,而对照组30a对Hg2+的最大抗性仅2 mg/L,且随着Hg2+质量浓度的升高,重组菌体进入对数期的时间比对照组30a更短,表明P6经表达足丝蛋白后抗汞能力有了一定程度的增强.

图3 P6重组菌与对照组30a在不同Hg2+质量浓度下的生长曲线Fig.3 Growth curves of P6 recombinant bacteria and control group 30a under different Hg2+ conditions
图4给出了P6重组菌与对照组30a在不同Cd2+质量浓度下的生长曲线.由图4可见,重组对照菌pET-30a对Cd2+的最大抗性为120 mg/L,而P6重组菌对Cd2+的最大抗性为160 mg/L.P6重组菌对Cd2+的最大抗性高于对照组30a,说明P6重组菌表达的足丝蛋白确实具有镉抗性.
从实验的抗性结果可见,重组菌相比对照菌株具有更强的抗重金属能力,但要在含Hg2+的环境下生存和繁殖,需要一定的时间进行诱导和适应.重金属浓度越高,越容易出现生长迟滞的现象.随着Hg2+和Cd2+质量浓度的升高,最大生长菌量减少,究其原因可能是细菌在降解重金属毒性物质时,占用了大量的营养物质和能量,影响细菌的生长.另外,P6重组菌表达的足丝蛋白富含大量的半胱氨酸和组氨酸残基,能将进入细胞中的非必需有毒金属离子结合,减少细胞与有毒金属的接触,从而保护细胞免受金属离子的毒性[16].
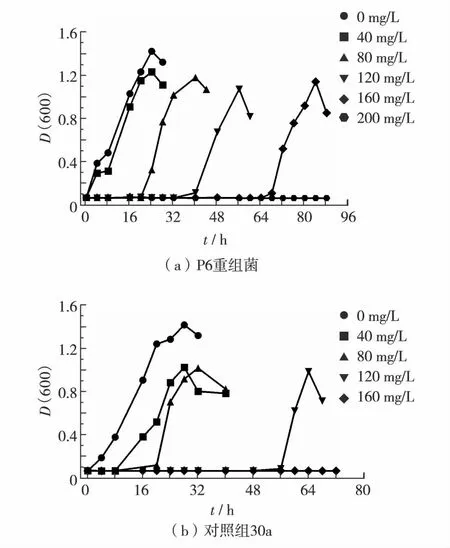
图4 P6重组菌与对照组30a在不同Cd2+质量浓度下的生长曲线Fig.4 Growth curves of P6 recombinant bacteria and control group 30a under different Cd2+ conditions
对P6重组菌的Hg2+和Cd2+富集能力的实验研究表明,重组菌的重金属的富集能力较宿主菌有一定的提高.重组菌对Hg2+的平衡富集量为109.89 mg/g,比对照组93.46 mg/g提高了17.58%;对Cd2+的平衡富集量为19.27 mg/g,比对照组16.50 mg/g提高了16.79%.在本研究中,如图5所示,重组菌P6和对照菌30a在一定的Hg2+和Cd2+质量浓度范围内对重金属离子的富集符合Langmuir吸附模型.随着溶液中Hg2+和Cd2+质量浓度的增加,菌体对重金属离子的吸附量也增加,当离子浓度达到一定量时,吸附达到平衡并趋于饱和状态.总的来说,P6重组菌对Hg2+和Cd2+的富集量均高于对照组30a.富集量的增加可能是因为进入胞内的重金属能被足丝蛋白中的半胱氨酸、组氨酸以及酪氨酸结合,从而表现为重组菌细胞对Hg2+和Cd2+的富集容量增加[17].

图5 P6重组菌与对照组30a的Hg2+和Cd2+的平衡富集量Fig.5 Equilibrium accumulation of P6 recombinant bacteria and control group 30a
结 语
本研究通过转录组测序研究翡翠贻贝足丝蛋白,以及blast同源性搜索来自其他贻贝足丝蛋白的已知序列,结合现有的转录组数据库,以高通量方式快速预测和鉴定大量的蛋白质序列,得到类翡翠贻贝足丝蛋白编码序列.其中,pvfp6基因编码的蛋白序列富含半胱氨酸和酪氨酸残基的足丝蛋白,这可能是重金属结合的关键因素,这些结论在实验中得到证实.该研究可为转录数据库的构建提供资源支持,用于发现和识别其他重要的重金属结合相关蛋白,以指导进一步的重组蛋白质工程和仿生材料处理,为海洋环境中重金属污染的生物治理提供实验参考.

