基于咪唑并吡啶pH探针的合成及其光谱性质
张月鹏,陈 芳,黄 珂,王帅珂,王 瑞
1)聊城大学药学院,山东聊城 252000;2)聊城市第四人民医院,山东聊城 252000
氢离子(H+)是重要的细胞内物质之一,许多疾病与细胞内异常的H+浓度有关[1-3],因此,构建优秀的pH荧光探针用于准确跟踪和监测细胞内pH值的波动具有重要的意义[4]. 目前, 大多数荧光pH探针适用于弱酸性细胞器或近中性的细胞质[5-8],而用于极酸性环境(pH<4)的pH荧光探针十分稀缺.虽然极酸性环境对大多数的生命体是致命的[9],但是一些原核细胞不仅可以在极酸性的环境下生存[10],还能打破生命体防御机制并导致许多的疾病.例如,胃液的pH值为1.5~2.5,胃肠道细菌如幽门螺旋杆菌会导致胃溃疡,甚至胃癌[11];弧菌霍乱导致呕吐腹泻,大量水分的流失最终会使人体的循环系统崩溃[12];大肠杆菌易引起血性腹泻,严重的会引发肾衰竭导致死亡[13-14].此外,在真核细胞中,酸性条件对于细胞器中的内吞和分泌途径起着关键的作用[15].因此,本研究选用咪唑并[1,2-a]吡啶类化合物作为受体,以双键作为桥梁连接供电体,设计合成了适用于极酸性环境的pH荧光探针,并测试其紫外吸收和荧光发射光谱性能,计算其解离常数pKa值,确定适用的pH值范围.合成路线如图 1.
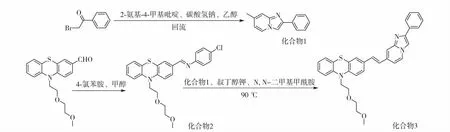
图1 10-(2-(2-甲氧基乙氧基)乙基)-3-(2-(2-苯基咪唑并[1,2-a]吡啶-7-基)乙烯基)-10H-吩噻嗪的化学合成路线Fig.1 Synthetic route of 10-(2-(2-methoxyethoxy)ethyl-3-(2-(2-phenylimidazo[1,2-a]pyridin-7-yl)vinyl)-10H-phenothiazine
1 实验方法
1.1 试剂和仪器
实验试剂均为市售化学纯或者分析纯产品,所需测试的样品溶剂均在测试之前配制;四甲基硅烷(tetramethyl silane, TMS)为内标.Bruker-advanced Ⅲ400 核磁共振仪购自美国Bruker公司;飞行时间高分辨质谱仪购自美国Evisa公司;UV-300紫外分光光度计购自美国Varian Cary公司;PTI-QM4荧光分光光度计购自美国PTI公司;Orion A420 pH计购自美国Thermo Scientific公司.
1.2 化合物3的合成
1.2.1 化合物1的合成[16]
将0.20 g(0.01 mmol)2-溴苯乙酮、0.11 g (0.01 mmol)2-氨基-4-甲基吡啶和0.84 g(0.01 mol)NaHCO3溶于20 mL体积分数为95%的乙醇溶液中,回流搅拌20 h.冷却至室温,过滤,滤饼用乙醚洗涤,真空干燥,得到黄色固体 0.15 g,为化合物1,即7-甲基-2-苯基咪唑并[1,2-a]吡啶产率70 %.
1.2.2 化合物3的合成
将0.33 g(0.001 mol)的10-(2-(2-甲氧基乙氧基)乙基)-10H-酚噻嗪-3-甲醛与0.13 g(0.001 mol)的对氯苯胺溶于20 mL甲醇溶液中,常温下搅拌,析出白色固体化合物2为(N-(4-氯苯基)-1-(10-(2-(2-甲氧基乙氧基)乙基-10H-吩噻嗪-3-基)甲亚胺).将未经纯化的化合物2与0.21 g(0.001 mol)化合物1、1.2 g(0.01 mol)叔丁醇钾直接溶于20 mL N,N-二甲基甲酰胺(N,N-Dimethylformamide, DMF)中,90 ℃下加热反应20 h.冷却至室温,减压除去溶剂,剩余固体经硅胶色谱柱层析分离,洗脱剂V(石油醚)∶V(乙酸乙酯)=2∶1,得到0.31 g淡黄色固体,产率为60%.氢(1H)核磁共振谱(1H nuclear magnetic resonance,1H NMR) (400 MHz, CDCl3) 化学位移δ(mg/L)分别为:3.39 (s, 3H)、4.13 (t, 耦合常数J=6.0 Hz, 2H)、3.86 (t,J=6.0 Hz, 2H)、3.66 (t,J=6.0 Hz, 2H)、3.56 (t,J=4.0 Hz, 2H)、6.88~7.04 (m, 6H)、7.12~7.15 (m, 2H)、7.28~7.30 (m, 2H)、7.34 (t,J=8.0 Hz, 1H)、7.44 (t,J=8.0 Hz, 2H)、7.59 (s, 1H)、7.81 (s, 1H)、7.97 (d,J=8.0 Hz, 2H)和8.05 (d,J=8.0 Hz, 1H).13C NMR (100 MHz, DMSO-d6)δ(mg/L)分别为:45.6、47.2、58.1、67.4、69.7、71.2、109.4、109.6、114.1、115.8、122.7、122.8、123.6、124.7、125.4、125.5、126.5、127.1、127.7、128.7、131.5、133.8、134.3、144.0、144.1、145.0和145.3. 通过高分辨电喷雾质谱得到C32H30N3O2S[M+H]+分子量理论值为520.205 9, 实测分子量为520.207 1,确定该物质为化合物3,其化学式为C32H29N3O2S.
1.3 待测液的配置
准确称取适量的化合物3,溶于25 mL二甲基亚砜(dimethyl sulfoxide, DMSO)中,配成浓度为1.0 mmol/L储备溶液,配置不同浓度的盐酸溶液(0.25、0.5和1.0 mol/L),移取4 mL的储备液并通过二甲基亚砜-水体系(体积比为1∶5)将溶液稀释至10 μmol/L,通过加入微量不同浓度的盐酸溶液得到一系列不同的pH值溶液用于紫外和荧光光谱的测定.
2 结果与讨论
2.1 化合物3的合成物点
化合物1的制备,反应简单,反应后直接生成沉淀,无须进一步纯化,适合大量制备,直接进行下一步的反应操作.化合物2通过醛基和氨基缩合反应制备,反应在常温下进行,不需要惰性气体保护,方便安全,搅拌后得到白色的沉淀,过滤干燥即可进行下一步的反应.化合物3由化合物1和2在强碱的参与下反应得到,反应时间较长产率不高,主要因为化合物中较大的π共轭结构降低了电子云密度,不利于反应进行.
2.2 化合物3的紫外-可见吸收光谱
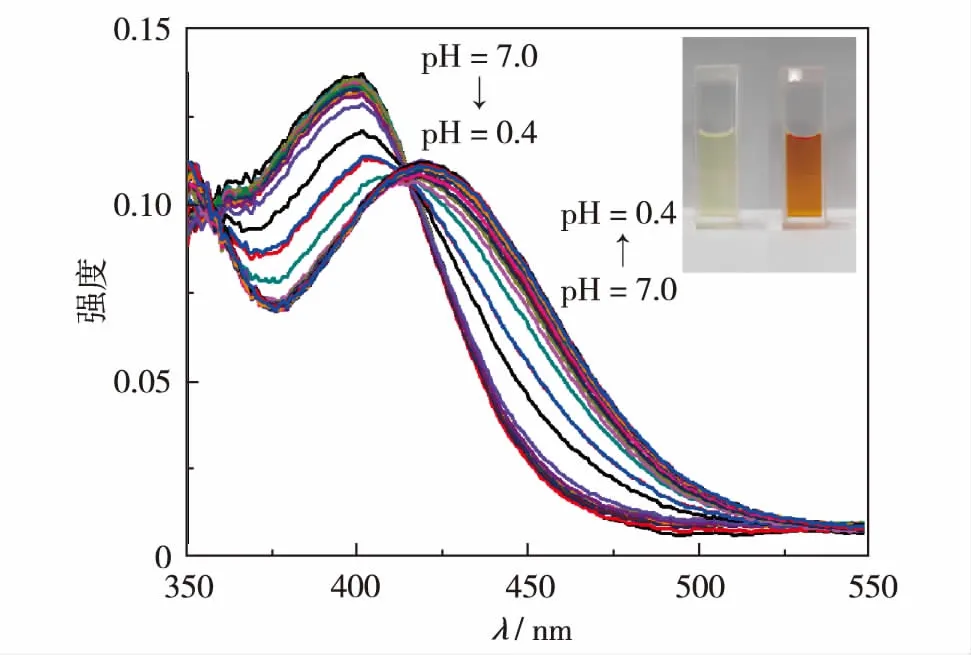
图2 化合物3在不同的pH值下的紫外-可见吸收光谱Fig.2 UV absorption spectra of compound 3 at different pH values
化合物3在pH值为0.4~7.0溶液中的紫外-可见吸收光谱如图2.由图2可见,化合物3在中性条件下(pH=7.0)有一个吸收带,λmax=399 nm,溶液为淡黄色.随溶液pH值降低,化合物3在399 nm的最大吸收峰强度逐渐降低,并伴随红移逐渐在419 nm出现一个新的吸收带.溶液pH = 0.4时,化合物3在399 nm处的吸收峰完全消失,且溶液变为橙黄色.因为咪唑并[1,2-a]吡啶上的氮原子有孤对电子,可以与氢质子相结合,当氮原子被质子化后,咪唑并[1,2-a]吡啶以阳离子的形态而存在,具有吸电子效应,而吩噻嗪分子内π-π共轭使电子云密度增强,因此,随环境pH值的降低,化合物3分子内电子转移效应增强,紫外吸收峰红移.
2.3 化合物3的荧光发射光谱
化合物3在pH值为0.4~7.0溶液中的荧光发射光谱如图3.
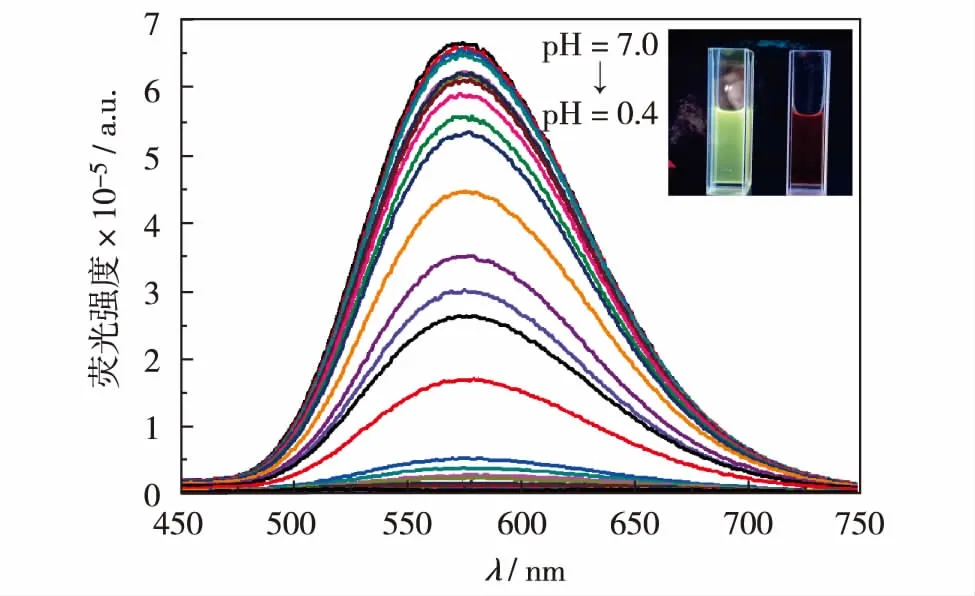
图3 化合物3在不同的pH值条件下的荧光发射光谱Fig.3 Fluorescence emission spectra of compound 3 at different pH values
当溶液pH值从7.0降到0.4时,化合物3在573 nm的荧光发射强度逐渐减弱,荧光强度的最大相差倍数超过了130倍.主要因为在酸性条件下,咪唑并[1,2-a]吡啶上的氮发生了质子化反应,化合物以阳离子的形态存在,从而形成了强吸电子效应,使得吩噻嗪分子上的电子经过双键进行传递,光诱导分子内电子转移效应增强,荧光基团在激发态时进行氧化还原反应,使得荧光强度逐渐减弱.在pH=7.0时化合物3的相对荧光量子产率Φ=0.150, 而在pH=0.4时Φ=0.005. 通过在573 nm的荧光发射强度随pH值变化曲线进行Sigmoidal拟合求得化合物3的pKa值.如图4,化合物3的pKa=3.07,说明作为pH荧光探针可以适用于极酸性环境.
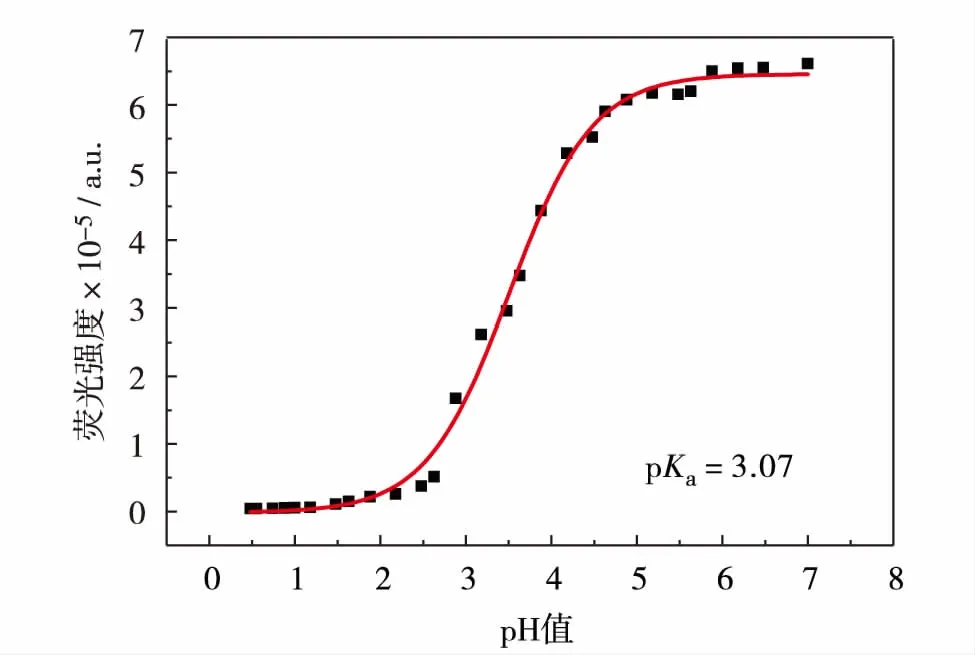
图4 化合物3在573 nm处的荧光强度与pH值的关系Fig.4 Relationship between fluorescence intensity of compound 3 at 573 nm and pH value
2.4 化合物3的光稳定性和光可逆性研究
探针在生物体中的表征需要使用共聚焦激光扫描显微镜,因此不同波段的高能量激光对于探针的稳定性有较高的要求.对不同pH值下化合物3的光稳定性进行研究,随着时间的推移,化合物3没有荧光衰减的情况,如图5.可逆性能使探针监测到细微的pH值变化,在生物成像时提供更多细微详细的生物信息.图6表明,化合物3在极酸和中性的条件下可以对H+完全响应,且几乎是即时完全转换.说明pH荧光探针可在极短时间内根据工作环境的微小变化进行即时监测,且在连续的酸碱环境变化下保持稳定的工作状态.

图5 不同的pH值下化合物3的光稳定性Fig.5 Photostability of compound 3 at different pH value
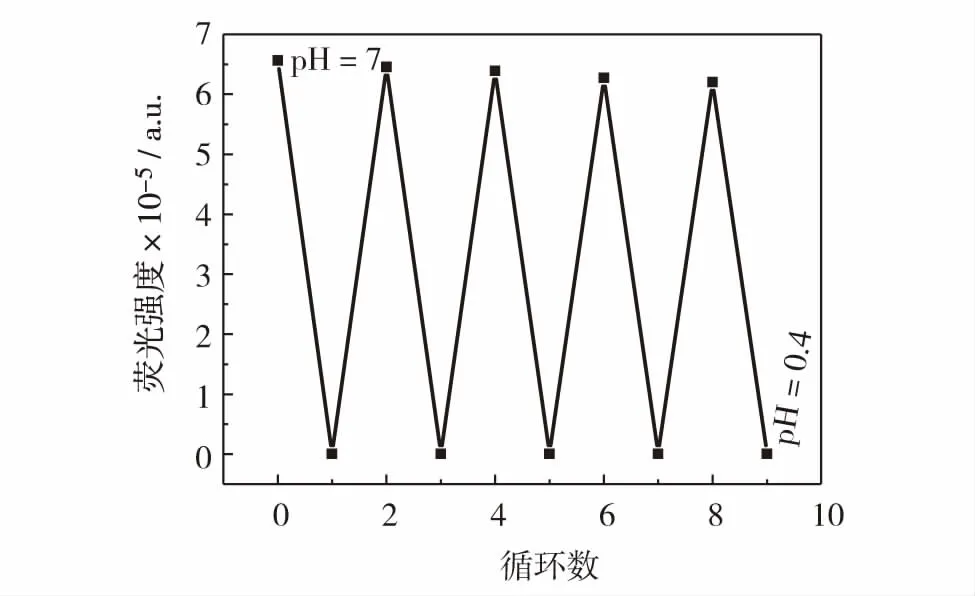
图6 pH=7.0和pH=0.4时化合物3的可逆性Fig.6 Reversibility of compound 3 at pH=7.0 and pH=0.4
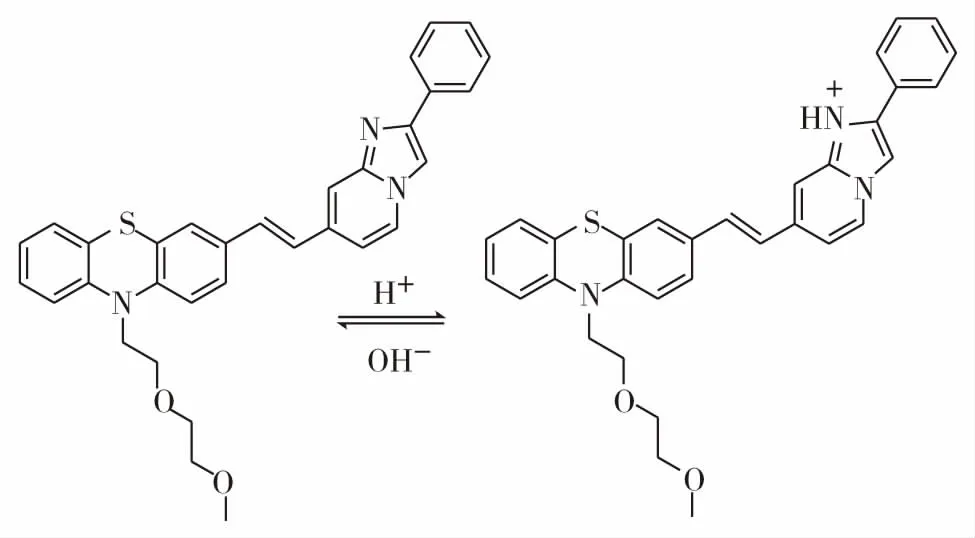
图7 化合物3与H+结合方式Fig.7 Combination of compound 3 and H+
2.5 化合物3与H+结合机理
化合物3对不同pH值的响应通过咪唑并[1,2-a]吡啶上的N原子与H+的结合产生(图7),为验证这一结合方式,进行了核磁滴定实验.如图8(a)至(e)所示,当H+的浓度越大时,咪唑并[1,2-a]吡啶上氮原子吸收H+化合物中的越多,吸电子效应增强.咪唑并[1,2-a]吡啶上的H11和H13向低场移动,氢原子序号和位置如图8,而其他碳上的氢原子受到的影响较小从而保持化学位移不变.
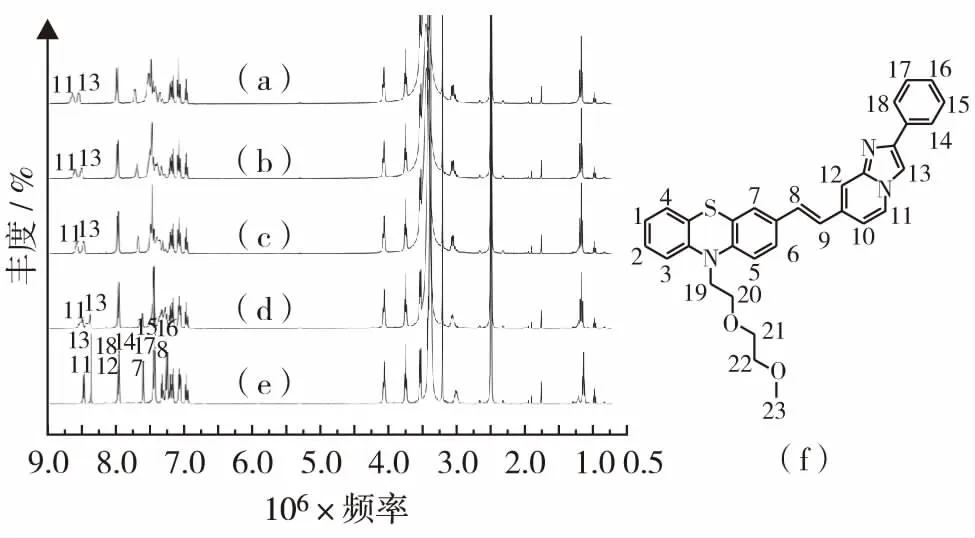
(a)加入1.5倍的n(H+);(b)加入1倍n(H+);(c)加入0.5倍n(H+);(d)加入0.25倍n(H+);(e)无n(H+);(f)C32H29N3O2S图8 化合物3的核磁共振氢谱Fig.8 1H NMR spectra of compound 3
结 语
本研究合成了10-(2-(2-甲氧基乙氧基)乙基)-3-(2-(2-苯基咪唑并[1,2-a]吡啶-7-基)乙烯基)-10H-吩噻嗪, 通过对其光谱性质的研究,发现该化合物可作为一种新型的 pH荧光探针.此外,该化合物的pKa=3.07,作为pH荧光探针可适用于极酸性环境,其进一步的应用还在研究中.

