固定化双酶耦联体系制备手性胺
任 红,郭敏杰,霍鹤宇,姚光晓,王世珍,2
1)厦门大学化学化工学院,福建厦门361005; 2)厦门市合成生物学重点实验室,福建厦门 310065
手性胺是香料、医药和有机合成工业的重要中间体[1].手性胺不同对映异构体的立体结构的差异使不同的手性对映体的活性不同,作用于生命体时表现出的生理活性和毒害作用也不同[2].因此,手性逐渐成为检验药物安全性和药效的重要因素,单一手性对映体药物的比例逐年上升[3].手性胺的制备方法主要有化学法和生物催化法,与传统的化学催化剂相比,生物酶催化剂对手性分子的两种对映体具有天然的识别能力,使生物催化技术在手性药物选择性合成中具有显著的优势[4-5].此外,生物催化还具有高效、高选择性、条件温和以及环境友好等优点.
胺脱氢酶(amine dehydrogenase, AmDH)能够在辅酶的作用下催化前手性酮和游离氨不对称合成手性胺的,而催化反应过程需要辅酶作为电子传递体参与反应,可以使该反应与辅酶再生系统耦联,如葡萄糖-葡萄糖脱氢酶或甲酸盐-甲酸脱氢酶(formate dehydrogenase, FDH)系统.CHEN等[6]构建了双酶耦联级联反应,利用亮氨酸脱氢酶(EsLeuDH)为模板定向设计获得突变体K77S/N270L与醇脱氢酶耦联合成手性胺.YE等[7]利用PheDH作为骨架进行酶改造获得的AmDH与葡萄糖脱氢酶耦联制备手性胺,其产物对映体选择性可达99%(对映体过量值). 酶有一般化学催化剂难以匹敌的优点,但仍有一些缺点令它难以在工业生产中广泛使用,其中影响最大的就是酶的稳定性较差.将酶蛋白进行固定化不仅能够提高酶的稳定性,且能够回收重复使用酶蛋白.仿生合成也称模板合成[8],是模拟生物矿化中生物矿物的形成过程,选择有机物作为模板,在模板的诱导或调控下生成无机物的一种合成方法. 2003年,SUMEREL等[9]首次将硅蛋白(silicatein)用于氧化钛的合成中,结果发现,硅蛋白能作为催化剂诱导钛前驱体二(2-羟基丙酸(二氢氧化二铵合钛))(titanium(IV)bis-(ammoniumlactato)-dihydroxide, Ti-BALDH)的水解和缩聚,并生成无定形的氧化钛,该研究开启了仿生钛化的新篇章.近年来,已有诸多有关基于仿生钛化的有机-无机杂化层层自组装的研究成果应用于酶的固定化方面[10-12].支链聚乙烯亚胺(polyethyleneimine, PEI)携有大量带正电的氨基,能够通过静电引力和氢键催化钛前驱体和硅前驱体缩聚,因此,可以用于仿生钛化[8,13-14].
本文分别研究了游离AmDH-FDH耦联体系和仿生钛化的AmDH-FDH制备手性胺,旨在探究一种辅酶循环效率高的多酶耦联体系.
1 材料与方法
1.1 菌株培养及纯酶制备
所用菌株为实验室保存的表达AmDH(源自Bacillusbadius, Genebank D50261 436-1578)以及表达FDH(源自Candidaboidinii, Genebank number AJ011046.2)的重组大肠杆菌. 将菌种(接种体积分数量1%)接种到10 mL含50 μg/L卡那霉素的液体LB培养基中,于37 ℃、200 r/min下过夜培养.取体积分数为1%的培养菌液转接到100 mL含50 μg/L卡那霉素液体LB培养基中,37 ℃下培养2~3 h至光密度D(600)为0.6~0.8.加入异丙基 β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)至终浓度为0.1 mmol/L,25 ℃培养12 h后离心收集重组菌菌体.将菌体用PBS缓冲液冲洗两次后重悬制备菌悬液,用细胞超声破碎仪破壁后离心,上清液即为粗酶液.由于pET-28a(+)质粒带有His6-tag标记,使表达得到的AmDH与FDH带有His6-tag,因而选择GE公司的HisTrap HP柱进行纯化.纯化方法如下:首先用结合缓冲液进行预平衡10个Histrap HP柱体积,平衡后将蛋白样品注入Histrap柱,用结合缓冲液平衡20个柱体积,接着用洗脱缓冲液20 mmol/L的磷酸钠缓冲液(含0.5 mol/L氯化钠, 500 mmol/L 咪唑, pH=7.4)进行梯度洗脱,自动收集流出液,检测其酶活性,收集具有酶活性的纯化样品,以Millipore超滤管(截留分子质量为10 kDa,1 Da=1 u)进行浓缩和脱盐后保存于4 ℃.
1.2 胺脱氢酶与甲酸脱氢酶反应体系及活性检测
AmDH和FDH分别是还原型辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)和氧化型辅酶NAD+依赖型氧化还原酶,NADH在340 nm波长附近有最大光密度值,因此,可通过检测辅酶NADH的消耗或生成速率来计算AmDH和FDH的活性.
酶活力单位的定义:规定条件下,单位体积每分钟催化生成或消耗1 μmol NADH所需酶量为1个酶活力单位(单位:U/mL).
酶活力单位=(VT×ΔD×K)/(ε×VS×L)
(1)
其中,VT为反应液总体积;VS为抽提液样品体积; ΔD为每分钟光密度变化值;K为样品稀释倍数;ε为摩尔吸光系数,ε=6.22 L/(mmol·cm);L为样品中的光程,L=0.5 cm.
1.3 手性胺的催化合成与产物分析
AmDH-FDH催化生成手性胺的反应体系包括:200 mmol/L的氯化铵-氨水缓冲液(pH=9.5)、20 mmol/L的苯氧基-2-丙酮、50 mmol/L的甲酸铵和0.05 mmol/L的NAD+.将上述溶液置于冰上,以氨水调节体系pH=9.5,加入适量的AmDH与FDH,于30 ℃、200 r/min条件下反应,每隔一段时间取样保存于-80 ℃待分析.
产物分析:将样品置于沸水浴中15 min后,于1.3×104g离心10 min去除蛋白质沉淀,加入等体积的正己烷萃取产物,摇匀,低速离心2 min,取上清,重复萃取3次,合并萃取液,以0.22 μm滤膜过滤2次后用于高效液相色谱(high performance liquid chromatography, HPLC)分析.底物酮浓度和产物胺的浓度及光学纯度以Chiral CEL OD-H液相色谱柱进行分析.
高效液相色谱条件为:流动相V(正己烷)∶V(乙醇)∶V(乙二胺)=90∶10∶0.1, 柱温为35 ℃,流速为1 mL/min,检测波长为254 nm.
2 结果与分析
2.1 胺脱氢酶的酶学性质及动力学性质
氧化还原酶与辅酶再生酶的耦联体系中,耦联并不是单纯的混合,而是基于各个酶单独的反应条件,即基于酶的活性和稳定性等因素来选择多酶体系的反应条件;各个酶反应动力学参数的匹配,综合考虑酶浓度配比、辅酶与底物的配比,以及辅酶循环效率等因素.同时,还要考虑到底物抑制和产物抑制等限制因素.因此,本研究分别测定了AmDH与FDH的酶学性质及其动力学参数.
利用HiSTrap HP柱对分别重组AmDH与FDH进行纯化得到纯酶,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析其纯度,结果如图1,两个酶的理论大小分别为41.5 kDa(ku)和42 kDa(ku),电泳结果符合预期.
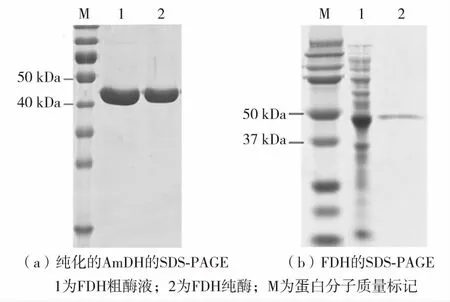
图1 AmDH和FDH的SDS-PAGE分析结果Fig.1 SDS-PAGE analysis of the purified AmDH and FDH
图2为AmDH及FDH的最适温度及最适pH值的测定结果.实验结果表明, FDH的最适温度为30 ℃,而AmDH的最适温度为35 ℃.对于FDH而言,温度对活性的影响并不大,35 ℃时,其活性能够达到最适温度条件下活性的90 %,因此,对于耦联体系的温度,选择AmDH的最适温度,该条件下FDH也保持了较高的酶活力.通过实验研究pH值分别对AmDH及FDH酶活的影响,结果如图2(c)和(d).由图2(c)和 (d)可见,两个酶均是在碱性条件下催化反应,AmDH的最适pH=9.5,FDH的最适pH=8.0,两酶的最适pH值相近,有利于双酶耦联体系的构建.双酶参与的反应是在同一反应pH值下发生的,这意味着pH值的选择会牺牲掉某个酶的部分活力,本实验测定的FDH活性高于AmDH,且FDH在pH=9.5条件下仍能保持80%的最高活性.同时,耦联体系是以AmDH反应为主体,因此采用能够为体系提供游离氨的氯化铵-氨水缓冲液.耦联反应的催化条件为35 ℃,pH=9.5的氯化铵-氨水缓冲液.
对纯化的AmDH及FDH分别以苯氧基-2-丙酮和甲酸铵为底物,测定2个酶的动力学参数.反应体系中苯氧基-2-丙酮的浓度为1.25~60 mmol/L,甲酸铵的浓度为1.25~100 mmol/L,在其他条件相同的情况下,测定不同底物浓度下的AmDH及FDH酶活力,根据Michaelis-Menten方程计算米氏常数Km和最大反应速率Vmax(表1).Km是表征酶与底物之间亲和力的常数,Km越小,表示酶与底物之间的亲和力越大,即达到最大反应速率1/2时所需要的酶量越小;kcat表示在最优条件下酶催化生成底物的速率.在表1中,根据动力学特征计算得到AmDH底物苯氧基-2-丙酮的Km=18.49 mmol/L,Vmax=0.22 mmol/(min·mL),FDH底物的Km=13.1 mmol/L,Vmax=0.23 mmol/(min·mL).FDH的Km(NAD+)与AmDH的Km(NADH)数值相近,可以推测,在FDH与AmDH的耦联反应体系中,FDH对氧化型辅酶NAD+的需求量与AmDH对还原型辅酶NADH的需求量相当.kcat/Km的值是衡量一个酶催化效率的最重要参数,也是考虑了酶转化底物的最大速率与酶与底物之间亲和力的一个综合参数.
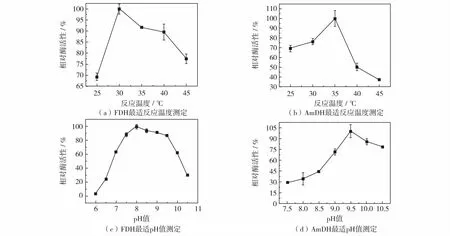
图2 AmDH和FDH的酶学性质(以各自最高酶活力为100%计算)Fig.2 The enzymatic property of AmDH and FDH (calculated by the maximum activity of 100%)
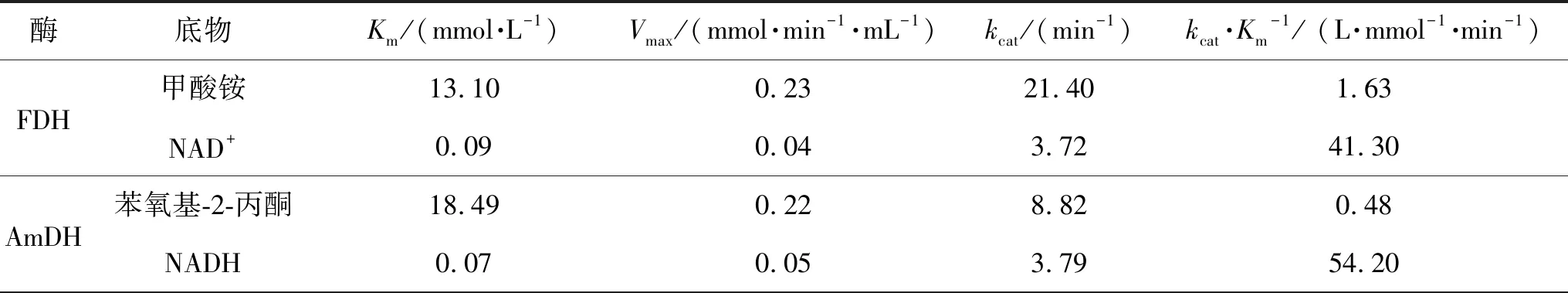
表1 AmDH及FDH的动力学参数Table 1 Kinetic parameters of AmDH and FDH
根据文献[15]研究工作,测定了AmDH游离酶及固定化酶在不同温度下的稳定性(图3),随着温度的提高,游离AmDH的失活速度越快. AmDH的稳定性不是很好,其游离AmDH在60 ℃下孵育5 min即失活;AmDH-PEI复合物的在60 ℃下孵育20 min仍可保存20%的活性,而AmDH-PEI-TiO2固定化酶则在60 ℃下孵育30 min仍可保存20%的活性.而FDH的稳定性较好,其游离酶可在60 ℃下保存30 min仍存有30%的反应活性[16].两个酶相比较而言,在30 ℃条件下,FDH比较稳定,且酶活力在反应后期的变化不是很大;而AmDH的稳定性较差,在反应初期存在一定的活性降低,中间有较长一段时间的稳定过程,当反应时间超过120 min后,AmDH仅保留10%左右的活性.而且FDH的活性远远高于AmDH,AmDH催化的还原胺化反应是整个耦联体系催化的限速步骤,因此,耦联体系的构建初始并未考虑酶稳定性的问题.
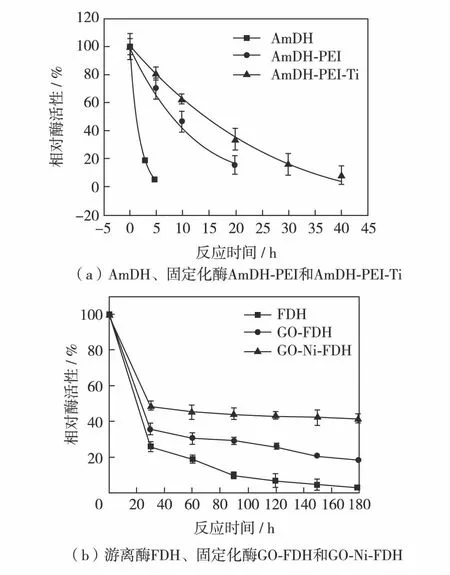
图3 AmDH、游离酶FDH与不同固定化酶的温度稳定性(60 ℃)Fig.3 Thermal stabilities of the free and different immobilized AmDH and FDH(at 60 ℃)
2.2 游离胺脱氢酶-甲酸脱氢酶耦联体系的构建
在双酶耦联的催化反应体系中,涉及到两个酶各自催化的氧化还原反应,它们各自催化氧化或还原底物,周而复始的实现辅酶NADH的再生与消耗,既相互独立又相互影响.由于涉及到两个同时发生的氧化还原反应,这使得协调两个酶各自催化反应的速率,进而使提高酶催化效率的过程变得更加重要.如果一个反应速率过快或过慢,势必会对总体的催化效率及辅酶循环效率产生不利的影响.纯酶催化体系可以通过在体系中调节适当比例的双酶浓度,使参与反应的两个酶保持较高的催化效率.因此,实验中研究了酶浓度配比、底物浓度和辅酶浓度对游离双酶耦联体系的影响.

图4 c(AmDH)/c(FDH)、辅酶浓度、底物浓度对生物催化过程的影响Fig.4 Effects of AmDH/FDH ratio, coenzyme and substrate concentration on biocatalytic process
实验过程中检测到的FDH活性远高于AmDH,因此,AmDH的催化反应是整个催化过程中的限速步骤,在体系中提高AmDH酶和FDH酶浓度比,即提高c(AmDH)/c(FDH)比值, 会大大加速反应的初速度.但AmDH与FDH的酶稳定性不同也会影响耦联体系催化的过程,如图4(a),随着反应时间的延长,酶浓度对于反应速率的影响逐渐减小,最终反应的转化率没有明显差异,原因可能是随着反应时间的延长,AmDH的活性逐渐下降,对反应的催化作用减弱.由图4(b)可见,随着辅酶NAD+浓度的升高,产物转化效率明显下降.原因可能是体系中的辅酶NAD+同时参与AmDH的氧化脱氨反应,随着辅酶NAD+浓度的升高,产物氧化脱氨的速率加快,导致了产物的总生成速率下降.同样,随着反应时间的延长,AmDH的活性下降,辅酶浓度对于反应速率的影响逐渐下降,且对转化率无明显影响.由图4(c)可见,随着底物浓度的升高,产物的生成速率升高,但是最终反应的转化率会明显降低.原因可能是酶的结合位点有限,随着底物浓度升高,反应速率会达到饱和,同时随着反应时间的延长,AmDH活性逐渐降低,催化效果下降,最终导致转化率降低.分析双酶浓度比、底物浓度和辅酶浓度对游离双酶耦联体系的影响时发现,AmDH酶的稳定性会大大影响耦联体系的反应速率及转化率,因此,提高AmDH的稳定性成为影响耦联体系催化效率的重要因素.
2.3 固定化胺脱氢酶-甲酸脱氢酶体系的构建
PEI是一种水溶性的大分子聚胺,链上拥有大量的氨基(支链PEI,分子链上有伯仲叔胺).PEI上带有大量的氨基,当pH<10时,其分子链上的氨基多处于质子化状态,而AmDH与FDH在pH<10时带负电,所以,PEI对酶分子具有一定的静电吸引作用,能够通过静电作用使酶分子发生离子吸附而被固定化[17].PEI如“绳子”一般缠绕在酶分子表面,能够在一定程度上抑制多亚基酶亚基之间的解离.同时,PEI可以作为模板和催化剂催化钛前驱体水解缩聚形成二氧化钛[14],进一步固定化已经被PEI包裹的酶分子,提高酶分子的稳定性.
根据文献[15]工作,选择pH=8.5的PEI对AmDH-FDH进行包裹,使PEI终浓度达到0.25 mmol/L时,酶的活力达到最大,且稳定效果也最好.利用AmDH-FDH-PEI复合体作为诱导剂催化钛前驱体Ti-BLADH水解缩聚形成包裹着酶分子的TiO2颗粒球.如表2,对3种耦联体系来讲,底物浓度不变时,辅酶浓度提高,总转化率(total turnover number, TTN)值会下降,说明辅酶重复利用率会下降.固定辅酶浓度,提高底物浓度虽然会提高反应速率,但是转化率会明显降低.

表2 底物浓度与辅酶浓度对于游离体系及两种固定化多酶耦联体系的影响Table 2 Effects of the concentration of substrate and coenzyme on the free system and immobilized multi-enzyme coupling system
综合考虑辅酶的利用率和底物的转化率,选择辅酶浓度为0.025 mmol/L、底物浓度为10 mmol/L作为最适反应条件做进一步研究.其反应过程的进程曲线如图5.耦联体系刚开始反应时,游离体系的转化率最高,但随着时间的推移,游离酶活性逐渐降低,转化率随之下降,而其他两种固定化酶耦联体系能够较好地维持反应速率.PEI固定化体系虽然能够在一定程度上抑制酶亚基的解离,进而稳定酶的活性,但是,PEI与酶分子之间是通过静电作用吸附而交联固定的,其过程是可逆的.而AmDH-FDH-PEI复合物诱导钛前驱体Ti-BALDH形成的TiO2包裹的耦联体系,是化学反应,形成了有限空间的“笼效应”,并为催化反应提供了适宜的微环境,其耦联体系酶活力得以保存,因此,随着时间的延长有更好的催化能力.辅酶可在固定化酶体系所创造的微环境中高效循环再生,因而提高了多酶耦联体系的催化效率.
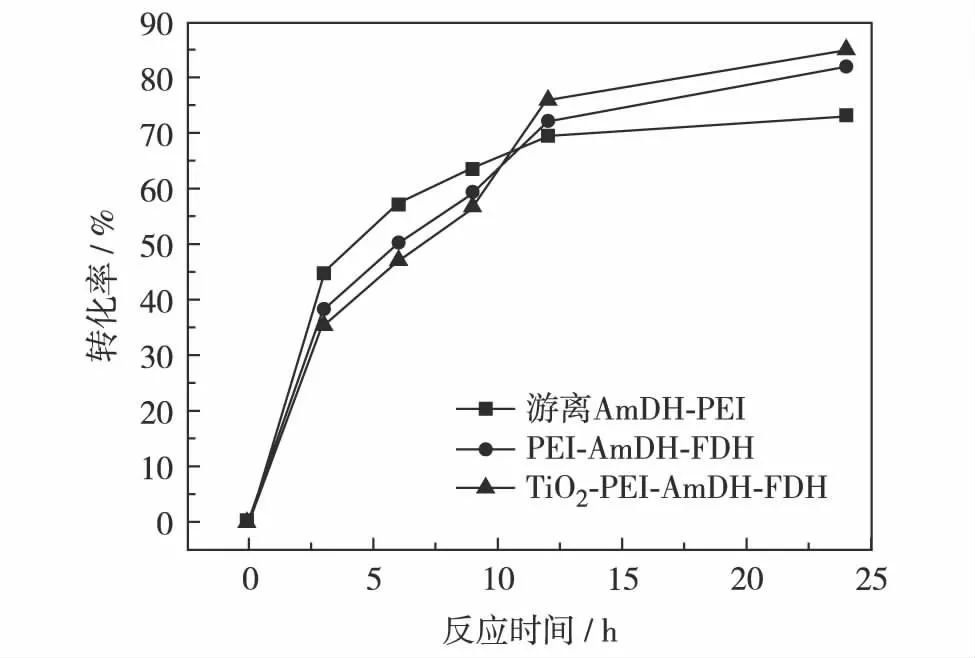
图5 游离体系、PEI固定化体系和仿生矿化固定化体系的反应时间-转化率曲线Fig.5 Reaction time conversion curve of free system, PEI immobilized system and biomimetic mineralization immobilized system
实验过程均采用纯酶进行反应,其产物均为R-苯氧基-2-丙胺,未能检测到S型产物,3种耦联体系反应在产物光学纯度上都表现出较好的对映体纯度 (对映体过量值>99.9%).
结 语
通过分别研究AmDH与FDH的单酶理化与动力学性质,并基于以上性质对参与耦联体系的双酶的酶活力配比、底物浓度和辅酶浓度进行优化,进而实现高效经济的辅酶再生循环.采用PEI对耦联体系进行固定化,并进一步利用PEI-酶复合物诱导钛前驱体Ti-BALDH水解缩聚形成TiO2,同时包裹PEI-AmDH-FDH形成固定化耦联体系.两种固定化方法过程简单,所需时间短,固定化后的酶保持了较高的酶活,同时具有更高的稳定性.相比游离酶耦联体系,固定化耦联酶体系可以在低底物浓度和低辅酶浓度条件下保持较高的催化效率.

