N-乙酰半胱氨酸对脂多糖诱导的人牙周膜成纤维细胞表达相关蛋白和基因的影响
郑 睿,谭裕洁,古萌琴,康 婷,郭 玲
牙周炎(periodontitis, PD)是由特定微生物引起的一种常见的口腔疾病,可导致牙周支持组织的破坏[1-2]。脂多糖(lipopolysaccharide, LPS)通过诱导炎性细胞因子如肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 和白细胞介素-1β (interleukin-1β, IL-1β) 等的释放,并使口腔微生物群从共生状态转变为生态不良状态来诱导牙周炎症。N-乙酰半胱氨酸(N-acetyl cysteine, NAC)作为一种抗氧化剂和谷胱甘肽(glutathione, GSH)的前体,能促进GSH的合成,从而发挥抗氧化、稳定细胞膜及抗炎等作用[3-4]。课题组前期研究[5]表明NAC能抑制成骨细胞中LPS诱导的核转录因子(nuclear factor-kappa B, NF-κB)的活化以及IL-6等炎症因子的表达,但关于NAC作用于人牙周膜成纤维细胞 (human periodontal ligament fibroblast cells, hPDLFs) 的报道较少。该实验以hPDLFs为研究对象,采用原代培养法建立体外细胞模型,研究NAC作为抗氧化剂对LPS介导的TNF-α和IL-1β合成的影响。此外,实验还通过研究NF-κB蛋白的活化探索了NAC潜在抗炎作用的分子机制。
1 材料与方法
1.1 材料hPDLFs(原代培养);实时定量聚合酶链式反应 (real-time quantitative polymerase chain reaction, RT-qPCR) 试剂盒购自德国Hamburg公司;波形蛋白和细胞角蛋白抗体购自美国Proteintech Group公司;青-链霉素混合液、IL-1β、TNF-α、NF-κB ELISA试剂盒购自日本同仁化学研究所;DMEM低糖培养基、胎牛血清购自美国Hyclone公司;LPS(大肠杆菌属)和NAC购自美国Sigma公司;细胞计数试剂盒 (cell counting kit-8, CCK-8) 购自北京正四柏生物科技有限公司。
1.2 方法
1.2.1原代细胞培养 2018年1月~3月期间从西南医科大学附属口腔医院口腔外科收集年龄范围为12~15岁,中位年龄为13岁,患者的健康前磨牙(共30颗)。并从患者父母处获得知情同意书以及西南医科大学附属口腔医院伦理道德委员会的批准。所有样本用含5%青-链霉素(成品)的磷酸盐缓冲液(PBS)彻底洗涤。从牙根中三分之一切取牙周组织,手术刀切成1 mm3的小片。加入0.1%胶原酶-I,在CO2培养箱中孵40 min后,补充加入10%胎牛血清的DMEM培养基(低糖)及2%的青-链霉素,在5%CO2、37 ℃的培养箱中培养。每3 d更新一次培养基,用倒置相差显微镜观察,当细胞爬出约占培养皿底部80%时开始传代,传至P 4冻存备用。
1.2.2CCK-8法测定NAC/LPS对hPDLFs增殖的影响 将第4代处于对数生长期的hPDLFs以1×105/ml的密度接种到96孔板中,每孔100 μl,在5% CO2、37 ℃的培养箱中培养24 h后,更换无血清DMEM培养基(低糖)培养12 h,分别加入100 μl预先设计好浓度的LPS(0.1、0.5、1、2.5、5 μg/ml),NAC(0.25、0.5、1、2.5、5 mmol/L),培养24、48、72 h,并设置未添加任何药物的对照组,以及不含细胞的空白组,每组4个复孔。培养相应时间后,更换100 μl单纯DEME低糖培养基,每孔加入10 μl CCK-8试剂,培养4 h后在酶联免疫检测仪上以450 nm波长测定每孔的吸光度(optical density,OD)值,取平均值为样本检测值,实验重复3次。
1.2.3RT-qPCR法测量IL-1β、TNF-α、NF-κB mRNA的相对表达量 将第4代处于对数生长期的hPDLFs以1×105/ml的密度接种到6孔板中,每孔2 ml。在5% CO2、37 ℃的培养箱中培养24 h后更换2 ml无血清DMEM培养基(低糖)培养12 h。细胞随机分为4组:对照组 ,LPS组(1 ug/ml),NAC组(1 mmol/L),LPS+NAC组(NAC预先作用30 min后,再使用LPS与NAC一起作用),每组3个复孔。在5% CO2、37 ℃的培养箱中培养3、6、12 h后,按照试剂盒说明书,快速提取细胞总RNA,以RT-qPCR法测量IL-1β、TNF-α、NF-κB mRNA的相对表达量,实验重复3次。RT-qPCR法所用引物见表1。

表1 RT-qPCR引物
1.2.4ELISA法检测人牙周膜成纤维细胞IL-1β、TNF-α、NF-κB蛋白表达量 将第4代处于对数生长期的hPDLFs以1×105/ml的密度接种到6孔板中,每孔2 ml。在5%CO2、37℃的培养箱中培养24 h后更换2 ml无血清DMEM培养基(低糖)培养12 h。细胞随机分为4组:对照组 ,LPS组(1 μg/ml),NAC组(1 mmol/L),LPS+NAC组(NAC预先作用30 min后,再使用LPS与NAC一起作用),每个组3个复孔。在5%CO2、37 ℃的培养箱中培养12、24、48 h后,收集上清液,按照ELISA试剂盒说明书进行IL-1β、TNF-α蛋白的测定,余下细胞沉淀用于检测NF-κB的蛋白表达量,实验重复3次。
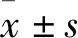
2 结果
2.1 细胞原代培养与鉴定在第4天时观察到组织块中有细胞爬出,细胞表现为星形和长梭形,见图1A。取第四代生长良好的细胞,以5×104/ml的密度接种至预先放置好玻璃爬片的6孔板中,待细胞长至约80%时进行多聚甲醛的固定并根据免疫组化试剂盒说明书进行细胞爬片的染色鉴定,光学显微镜下见细胞抗波形丝蛋白染色结果阳性见图1B,细胞抗角蛋白染色结果阴性见图1C。证明细胞来源于间充质而非上皮,结合细胞形态,可以确定原代培养结果为hPDLFs。
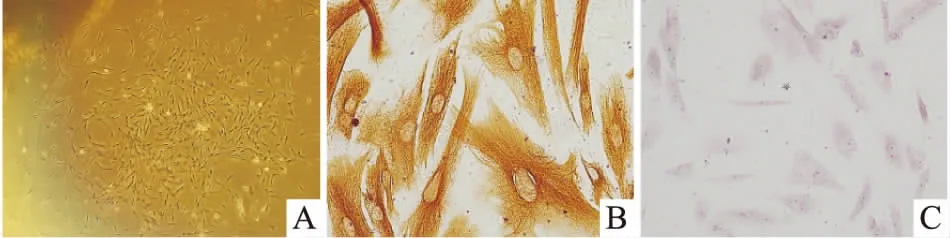
图1 细胞原代培养及鉴定
A: 细胞从组织块爬出 ×40; B:抗波形丝蛋白染色阳性 ×100; C:抗角蛋白染色阴性 ×100
2.2 CCK-8检测在不同浓度的LPS/NAC影响下hPDLFs增殖率的变化各实验组与对照组之间均有统计学意义(LPS组:F24 h=45.92,F48 h=42.81,F72 h=37.24;NAC组:F24 h=38.51,F48 h=31.98,F72 h=46.11;P<0.05),低浓度LPS对成纤维细胞的细增殖有促进作用,并在1 μg/ml时到达顶峰,增殖率随LPS浓度增高而下降,见图2,最终确定试验用LPS浓度为1 ug/ml。NAC也表现出类似的趋势见图3。最终确定1 mmol/L为实验所用NAC浓度。
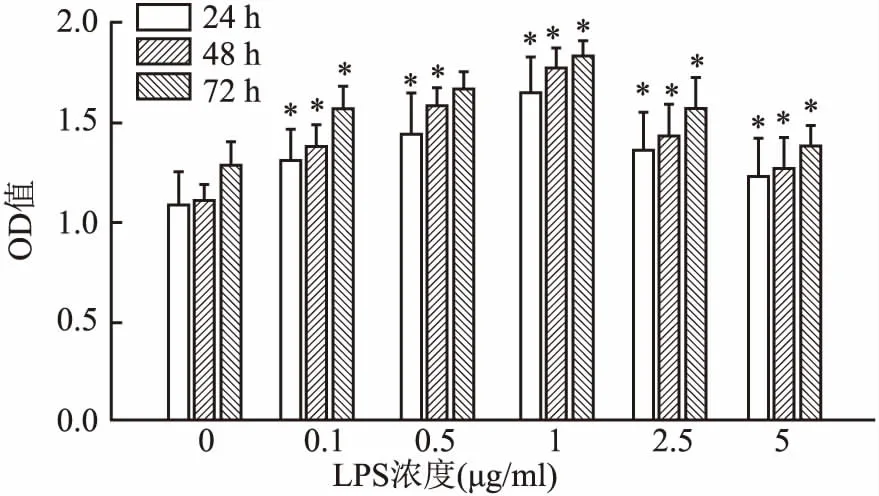
图2 hPDLFs在不同浓度LPS刺激下细胞增殖率的变化与对照组(LPS 0 μg/ml)比较:*P<0.05
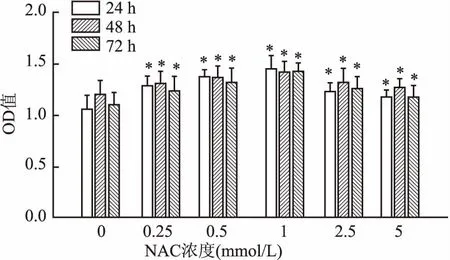
图3 hPDLFs在不同浓度NAC刺激下细胞增殖率的变化与对照组(NAC 0 mmol/L)比较:*P<0.05
2.3 NAC对LPS刺激下的hPDLFs分泌IL-1β、TNF-α、NF-κB mRNA的影响RT-qPCR法结果显示hPDLFs在LPS的刺激下,IL-1β(F=2 199.07,图4)、TNF-α(F=174.35,图5)、NF-κB(F=1 525.11,图6)mRNA的相对表达量增加,与对照组比较,差异有统计学意义(P<0.05),加入NAC后该作用受到抑制,与LPS组比较,差异有统计学意义(P<0.05)。与此同时,单纯加入NAC时,IL-1β、TNF-α、NF-κB mRNA的相对表达量相比于对照组,也有所下降。表明NAC对LPS上调人牙周膜成纤维细胞IL-1β、TNF-α、NF-κB mRNA有抑制作用。
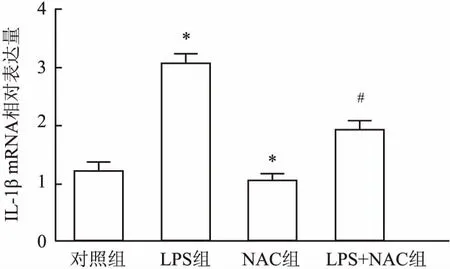
图4 12 h时NAC对LPS诱导人hPDLFs表达IL-1β mRNA的影响与对照组比较: *P<0.05; 与LPS组比较:#P<0.05
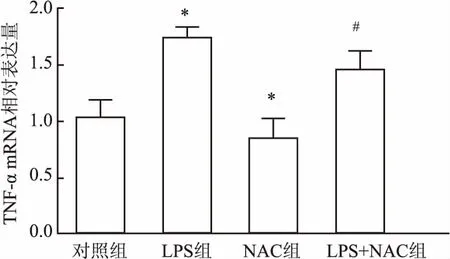
图5 12 h时NAC对LPS诱导hPDLFs表达TNF-α mRNA的影响与对照组比较: *P<0.05; 与LPS组比较:#P<0.05
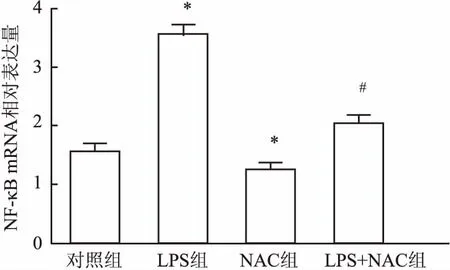
图6 12 h时NAC对LPS诱导hPDLFs表达NF-κB mRNA的影响与对照组比较:*P<0.05; 与LPS组比较:#P<0.05
2.4 NAC对LPS刺激下的hPDLFs分泌IL-1β、TNF-α、NF-κB蛋白的影响IL-1β(F12 h=22.25,F24 h=29.52,F48 h=148.49)、TNF-α(F12 h=977.37,F24 h=773.86,F48 h=999.28)、NF-κB(F3 h=41.12,F6 h=69.12,F12 h=34.38),LPS组与对照组相比,IL-1β、TNF-α和NF-κB的蛋白量均有所增加。LPS+NAC组结果提示NAC抑制了LPS介导的IL-1β、TNF-α以及NF-κB蛋白的表达。见表2~4。
表2 不同时间点NAC对LPS诱导的hPDLFs表达IL-1β的影响
与对照组比较:*P<0.05;与 LPS组比较:#P<0.05
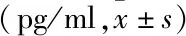

组别12h24h48h对照25.83±0.9142.93±0.6445.03±0.76LPS53.93±0.51∗67.93±0.91∗71.43±0.87∗NAC21.30±0.71∗35.83±0.60∗37.80±0.96∗LPS+NAC37.63±0.74#56.56±0.93#59.56±0.88#
与对照组比较:*P<0.05;与 LPS组比较:#P<0.05
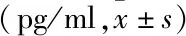

组别3h6h12h对照810.88±21.62 785.10±18.77 781.35±24.58 LPS927.97±13.97∗899.24±13.15∗888.57±12.15∗NAC732.46±15.99∗713.47±12.11∗728.91±15.64∗LPS+NAC882.02±15.58#864.01±11.14#854.93±12.30#
与对照组比较:*P<0.05;与 LPS组比较:#P<0.05
3 讨论
PD是一种常见的口腔疾病,通常表现为牙周支持组织的丧失以及牙齿的松动甚至脱落[6-7]。与PD相关的主要病原体是革兰阴性细菌,如牙龈卟啉单胞菌[8],作为革兰阴性菌的毒力因子,LPS可刺激hPDLFs分泌产生IL-1β和TNF-α。研究[9]表明IL-1β和TNF-α具有相互重叠、促进的作用,并诱导破骨细胞形成,加剧牙周骨组织的破坏,如果能找到一种同时抑制IL-1β和TNF-α的药物,对于牙周组织炎症的控制和牙槽骨的吸收破坏将具有一定的积极意义。
NF-κB广泛存在于哺乳动物的细胞中,通过调节基因的中心转录参与炎症以及细胞凋亡等多种细胞生理过程的早期阶段。NF-κB蛋白的活化导致下游受其调控的各类炎症因子的合成,研究[10-11]证明IL-1β和TNF-α的合成受上游NF-κB蛋白的调控。本研究NF-κB蛋白的测定在3、6、12 h三个时间点均得到较明显阳性结果,提示药物干预后3 h,hPDLFs中已经出现了NF-κB蛋白的变化,IL-1β与TNF-α蛋白测量的阳性结果则是在在12、24、48 h时出现。
NAC作为GSH的前体,具有抗氧化、清除氧自由基等作用。NAC可以促进GSH的合成,预防或调节体内氧化还原反应的失衡,抑制体内活性氧 及其衍生物产生的核转录因子抑制蛋白活化酶的活化,导致NF-κB的激活被抑制,从而抑制IL-1β、TNF-α等受NF-κB调控的炎性细胞因子的释放[12-15]。
本研究免疫组化结果显示细胞波形丝蛋白染色阳性及角蛋白染色阴性,证明细胞源于间充质,结合细胞形态,可以判定原代细胞为hPDLFs,符合实验要求。CCK-8结果提示低浓度NAC对hPDLFs增殖有促进作用,当浓度超过1 mmol/L后,细胞增殖开始受到抑制,表明高浓度NAC(大于1 mmol/L)能抑制hPDLFs的增殖。ELISA实验结果显示LPS组(1 μg/ml)与对照组相比,IL-1β、TNF-α和NF-κB的蛋白表达量显著升高,而LPS+NAC组中以NAC(1 mmol/L)预处理细胞30 min后,再用LPS(1 μg/ml)刺激细胞,显示IL-1β、TNF-α和NF-κB的蛋白表达量均显著低于LPS组。RT-qPCR结果提示LPS上调hPDLFs中NF-κB以及IL-1β和TNF-α的mRNA的相对表达量,NAC抑制了LPS诱导的IL-1β、TNF-α和NF-κB mRNA相对表达量的增高,结合ELISA结果说明NAC可以抑制LPS诱导的hPDLFs中NF-κB的活化,进而抑制IL-1β和TNF-α的合成,从而减轻了由IL-1β和TNF-α引起的牙周炎症及牙周支持组织的破坏。
作为一种危害人类口腔健康的主要疾病,PD及其相关治疗已成为一个研究热点。NAC通过抑制NF-κB的活化从而抑制LPS诱导的人hPDLFs中TNF-α和IL-1β的合成,这可能为临床预防和治疗牙周组织炎症提供一种具有潜力的、崭新的药物,但在应用于临床前还需要进一步的深入研究和临床试验来验证。

