NO诱导富含miR-126的胎盘间充质干细胞外泌体治疗大鼠脓毒症
张国虎,李友军,夏金明,吕世进,王锦权
脓毒症是由感染引起,因患者全身反应失调而导致的危及生命的多脏器功能障碍。其中,微血管损伤及功能障碍是最终导致多器官功能障碍的重要原因之一,但目前临床对此还缺乏有效的治疗手段。有研究[1]表明,一氧化氮(nitric oxide,NO)可有效诱导胎盘间充质干细胞(placental mesenchymal stem cells,PMSCs)分泌富含miR-126的外泌体,该外泌体可有效促进损伤血管的再生。该实验试图利用该类型外泌体尝试治疗脓毒症大鼠,观察其治疗效果以及可能的作用机制。
1 材料与方法
1.1 实验材料及设备试剂
1.1.1人足月龄胎盘 经安徽医科大学伦理委员会审议并批准本次实验。在征得产妇及其家属知情同意后,于2018年1月1日从安徽医科大学第一附属医院妇产科无菌条件下获取一枚健康、完整胎盘。产妇无各类遗传病、传染病、妊娠并发症,且健康足月生产。
1.1.2大鼠 由安徽医科大学实验动物中心提供并饲养雄性SD大鼠160只(清洁级,7~8周龄,许可证号:scxk(皖)2018-03),体质量(240±20)g,正常饮食和水,12 h/12 h昼夜交替,饲养1周。
1.1.3主要设备和试剂
1.1.3.1主要设备 细胞培养箱购于日本SANYO公司;差速离心机购于德国EPPENDORF公司;HT7700透射电镜购于日本Hitachi公司;全自动生化分析仪购于深圳迈瑞生物公司、CFX96实时PCR系统购于美国Bio-Rad公司。
1.1.3.2主要试剂 10%胎牛血清购于澳大利亚FBS公司;复合消化酶、DAEM/F12培养基购于美国Gibco公司;CS-NO[2]购于上海生工生物工程公司;β-半乳糖苷酶购于上海吉至生化公司;Opti-MEM减血清培养基购于美国Invitrogen公司;miR-126抑制剂及qPCR引物购于广州锐博生物有限公司;水合氯醛、异氟烷购于山东鲁南贝特公司;ELISA检测试剂盒购于武汉贝茵莱公司;QIAGEN miRNA Reverse Transcription Kit反转录试剂盒、SYBR Green master mix、miR Neasy试剂盒购于美国QIAGEN公司;BCA蛋白质测定试剂盒购于美国Promega公司;聚偏二氟乙烯膜、兔抗大鼠一抗、过氧化物酶标记的二抗购于美国GE Healthcare公司。
1.2 方法
1.2.1人胎盘间充质干细胞的培养 无菌条件下,取胎儿蜕膜侧胎盘组织,剪成1~3 mm3组织块。利用复合消化酶(0.2%胶原酶+0.35%透明质酸酶+100 U/ml DNA酶)消化50 min。离心获取细胞接种于DAEM/F12培养基,37 ℃,5% CO2培养箱中培养。贴壁克隆样生长的细胞经0.25%胰酶消化传代,取第4代PMSCs用于实验。
1.2.2NO和miR-126抑制剂诱导培养 取第4代PMSCs,等分为3组,分别为A1、A2和A3。首先,向A1、A2的培养基中分别加入0.25 mg/ml的NO缓释剂(CS-NO),向A3培养基中加入等量的蒸馏水,培养24 h。然后,按照转染试剂盒使用说明书,利用Lipofectamine® 2000转染试剂和Opti-MEM减血清培养基进行转染。其中A2中加入miR-126-3p和miR-126-5p抑制剂各50 nmol/L,向A1和A3中则加入等量的无效对照抑制剂,转染5 h。最终分别获得A1(经NO诱导的PMSCs、NO-PMSCs)、A2(miR-126抑制剂诱导的PMSCs、I-NO-PMSCs)、A3(无诱导的PMSCs)。
1.2.3外泌体的提取 分别收集3种诱导培养干细胞(NO-PMSCs、I-NO-PMSCs和PMSCs)的条件培养基各200 ml,先2 307 r/min离心10 min;然后,11 304 r/min离心20 min;最后,32 630 r/min离心70 min。从而分别获得两种对应的外泌体(N-Exo、I-Exo和Exo)。
1.2.4透射电镜观察外泌体 取一滴外泌体悬液放置于栽样铜网上,室温下静置孵育5 min,用2%乙酸铀酰对样品进行染色30 s,然后放置晾干60 min,最后使用透射电镜进行观察。
1.2.5脓毒症大鼠模型(CLP)的建立及分组治疗 术前大鼠称重,首先使用4%的混合气体(异氟烷+纯氧)对大鼠进行吸入麻醉,后改用2%的混合气体进行维持麻醉。大鼠仰卧位备皮并消毒。腹正中切口,钝性分离腹肌,进入腹膜,于右下腹寻找并分离盲肠,找到回盲口,使用4-0丝线在回盲部和盲肠末端中点位置避开肠系膜血管进行结扎,不中断肠连续性。在盲肠末端上约0.5 cm处,使用18号针头贯通穿刺盲肠2 次,挤出约黄豆粒大小的粪便,然后将盲肠还纳腹腔。丝线逐层缝合腹膜、腹壁及皮肤。术后使用预热(37 ℃)的生理盐水输液(30 ml/kg)复苏,并于术后6 h、24 h和48 h,给每只大鼠分别皮下注射25 mg/kg的亚胺培南。
所有160只大鼠随机等分为4 组,即对照组(假手术+PBS)、脓毒症组(CLP+PBS)、Exo组(CLP+N-Exo)、I-Exo组(CLP+I-Exo),每组40 只大鼠。然后,在每组大鼠中,再次随机抽取20只,用于存活率观察实验;剩余的20只则用于病理学分析及分子生物学实验。所有干预治疗均为术后4 h,通过尾静脉注射,剂量为2 mg/kg,外泌体浓度为1 g/L。
1.2.6大鼠存活率 CLP术后开始监测所有大鼠的活动,每日2 pm记录1次大鼠状态,连续监测7 d,统计各组大鼠7 d存活率。
1.2.7肝肾功能、炎性因子监测及主要脏器病理检验 术后48 h,使用水合氯醛(10%、300 mg/kg)腹腔注射麻醉,开腹,夹闭腹主动脉近心端,采血针缓慢抽取全血。静置(室温、30 min)、离心(3 000 r/min、10 min),取上清液,-80 ℃冰箱保存。
使用全自动生化分析仪检测血清ALT、AST和BUN的含量。按照ELISA检测试剂盒的操作规范,首先试剂盒复温(室温、30 min)。然后,取所测指标(IL-6、IL-10、TNF-α、IFN-γ、IL-1β)的标准品,各加入1 ml稀释液,静置(20 ℃、15 min),然后慢慢搅匀,然后根据需要进行稀释。在样板条的每个孔中加入100 μl标准品或是血清,恒温孵育(37 ℃、90 min),然后洗板(4~5 次、350 μl/孔)。接着,加入生物素化的抗体(100 μl/孔),再次封板孵育(37 ℃、60 min),然后再次洗板。最后,加入显色底物(TMB、100 μl/孔),再次避光孵育(37 ℃、15 min)。然后加入终止液(100 μl/孔),并于3 min内使用多功能酶标仪测OD值,通过每种检测指标的标准曲线算的对应浓度。
打开大鼠胸、腹腔,快速分离肺脏和肾脏,10%福尔马林固定,石蜡包埋,制作5 mm切片,HE染色,显微镜下观察。调节相同的光圈及放大倍数,每张切片随机选取10个视野,由两名病理专业医师,根据肺[3]、肾[4]损伤评分标准进行盲法评分,并对评分进行统计。肺脏病理评分标准:1分:正常;2分:肺间质炎性细胞浸润<50%;3分:肺间质炎性细胞浸润>50%;4分:肺实变及免疫细胞浸润<50%;5分:肺实变及免疫细胞浸润>50%。每组所得分数进行统计分析。肾脏病理评分标准:1分:单细胞或点状坏死;2分:肾小管受损面积<25%;3 分:肾小管受损面积为25%~50%;4分:肾小管受损免疫为50%~75%;5分:肾小管受损免疫>75%。
1.2.8肺和肾血管微渗漏和干/湿重之比 术后48 h,通过尾静脉给所有大鼠注射伊文思蓝(2%、4 ml/kg),40 min后处死大鼠,打开胸腔,使用生理盐水从左心室进行灌注,直至右心耳流出无色液体为止。完整摘取双侧肺脏和肾脏。将左侧肺脏和肾脏分别浸入甲酰胺溶液(3 ml)中,在恒温箱中孵育48 h后,离心(3 000 r/min、8 min),取上清液,以甲酰胺溶液为空白对照,在620 nm波长处测定OD值。将右侧肺脏和肾脏表面水分用滤纸拭干,称取湿重。然后将组织放入烤箱中干燥(60 ℃、48 h),再称取干重,并计算干/湿重比。
1.2.9实时荧光PCR 取各组大鼠肾脏组织和两种外泌体,利用miR Neasy试剂盒从细胞或肾脏组织中分离总RNA。然后,按照QIAGEN miRNA Reverse Transcription Kit反转录试剂盒的使用说明,对RNA进行逆转录。cDNA合成完毕后,利用SYBR Green master mix的实时检测方法,通过CFX96实时PCR系统测定miR-126-3p或miR-126-5p的水平,引物序列如表1。使用细胞内snRNA U6作为内参,使用2-△△CT值进行定量计算。

表1 引物序列
1.2.10蛋白质印迹分析 取各组大鼠肾脏组织,在RIPA裂解缓冲液中收获细胞,利用BCA蛋白质测定试剂盒进行蛋白定量,通过10%SDS-PAGE进行分离,然后转移到聚偏二氟乙烯膜上。将膜在5%脱脂乳中封闭1 h,并在4 ℃条件下,一抗中孵育过夜,然后在室温条件下,与辣根过氧化物酶偶联的第二抗孵育1 h。用荧光显色剂显色。 使用β-肌动蛋白用作内部对照。一抗:HMGB1(1 ∶1 000;兔IgG)、RAGE(1 ∶1 000;兔IgG)、TRL-2(1 ∶1 000;兔IgG)、TRL-4(1 ∶1 000;兔IgG)、p-p65(1 ∶1 000;兔IgG)、t-p65(1 ∶1 000;兔IgG)和β-肌动蛋白(1 ∶1 000;兔IgG);二抗:经过氧化物酶标记的羊抗兔抗体。
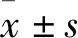
2 结果
2.1 外泌体的获得和鉴定分析电镜检测结果显示,N-Exo和I-Exo两种外泌体均为直径约为70 nm的圆形膜囊泡,两者在形态上无显著差异,如图1。但3种外泌体miR-126的含量,I-Exo显著低于Exo,而Exo则显著低于N-Exo,差异有统计学意义(P<0.05),见图2。提示本实验成功提取了外泌体,且NO诱导培养显著增加了N-Exo中miR-126的含量,而miR-126抑制剂的培养则显著降低了I-Exo中miR-126的含量。
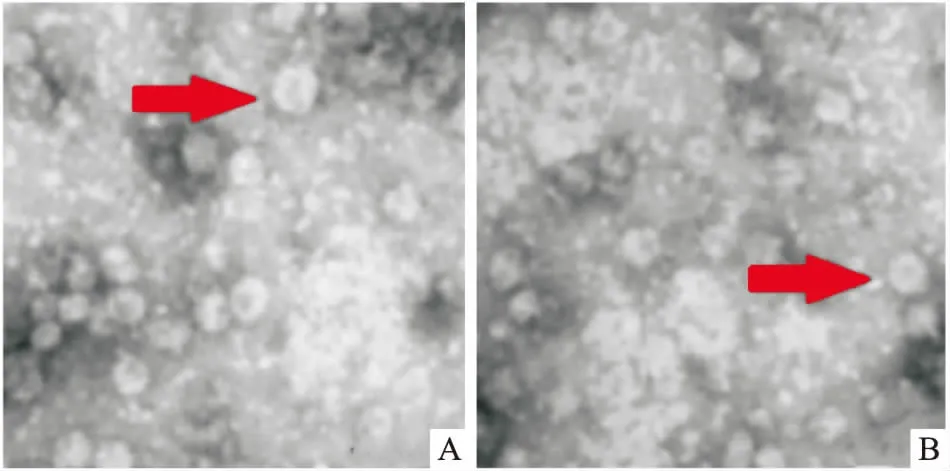
图1 外泌体透射电镜照片 ×100 000
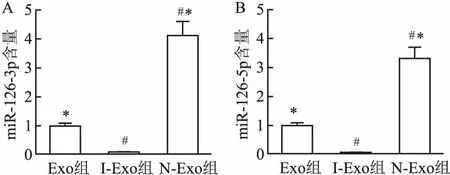
图2 不同外泌体内miR-126-3p和miR-126-5p的含量
A:miR-126-3p;B:miR-126-5p;与Exo组比较:#P<0.05;与I-Exo组比较:*P<0.05
2.2 外泌体对于脓毒症大鼠的治疗效果
2.2.1生存分析 各组大鼠进行7 d存活率统计并绘制生存曲线图(图3)。其中脓毒症组和I-Exo组间差异无统计学意义(χ2=0.38,P>0.05),但N-Exo组大鼠生存率显著高于脓毒症组和I-Exo组,差异有统计学意义(χ2=7.02、6.89,P<0.05)。提示N-Exo可以显著提高脓毒症大鼠的7 d生存率。
2.2.2血生化分析 N-Exo组显著降低了各项血生化指标及炎症因子的含量,与对照组间差异无统计学意义(P>0.05);I-Exo组则未降低各项生化指标及炎症因子的含量,与脓毒症组间差异无统计学意义(P>0.05)。N-Exo组和对照组各项生化指标及炎症因子均显著低于脓毒症组和I-Exo组,差异有统计学意义(P<0.001)。见表2。
2.2.3肺肾病理分析 术后2天,N-Exo显著降低了肺脏和肾脏的损伤,损伤评分与对照组间差异无统计学意义;I-Exo组和脓毒症组则出现肺泡壁增厚、肺间质间隙增大、肺泡内炎症细胞浸润增多;肾脏出现毛细血管充血,肾小管损伤和刷状缘丧失,见图4。I-Exo组和脓毒症组病理损伤评分显著高于对照组和N-Exo组,差异有统计学意义(P<0.05),见图5。
2.2.4肺脏和肾脏的血管微渗漏及干/湿重比 N-Exo组有效缓解了脓毒症造成的微血管损伤,血管微渗漏和器官干/湿重比均显著降低,与对照组间差异无统计学意义;而I-Exo组则无显著的治疗作用,与脓毒症组间差异无统计学意义,且均显著高于N-Exo组和对照组,差异有统计学意义(P<0.05),见图6。
2.3 肾脏中miR-126、HMGB1及其下游关键靶点蛋白含量的变化对照组和N-Exo组、脓毒症组和I-Exo组大鼠肾脏内miR-126-3p和miR-126-5p含量差异无统计学意义(P>0.05);但对照组和N-Exo组大鼠肾脏内miR-126-3p和miR-126-5p含量显著高于脓毒症组和I-Exo组,且差异具有统计学意义(P<0.05),见图7。提示脓毒症导致大鼠肾脏内miR-126表达降低,而富含miR-126的N-Exo提高了肾脏内miR-126的含量,而缺乏miR-126的I-Exo则无此功能。
图3 各组大鼠生存分析曲线图
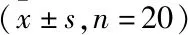
表2 各组大鼠血清多项生化指标统计表
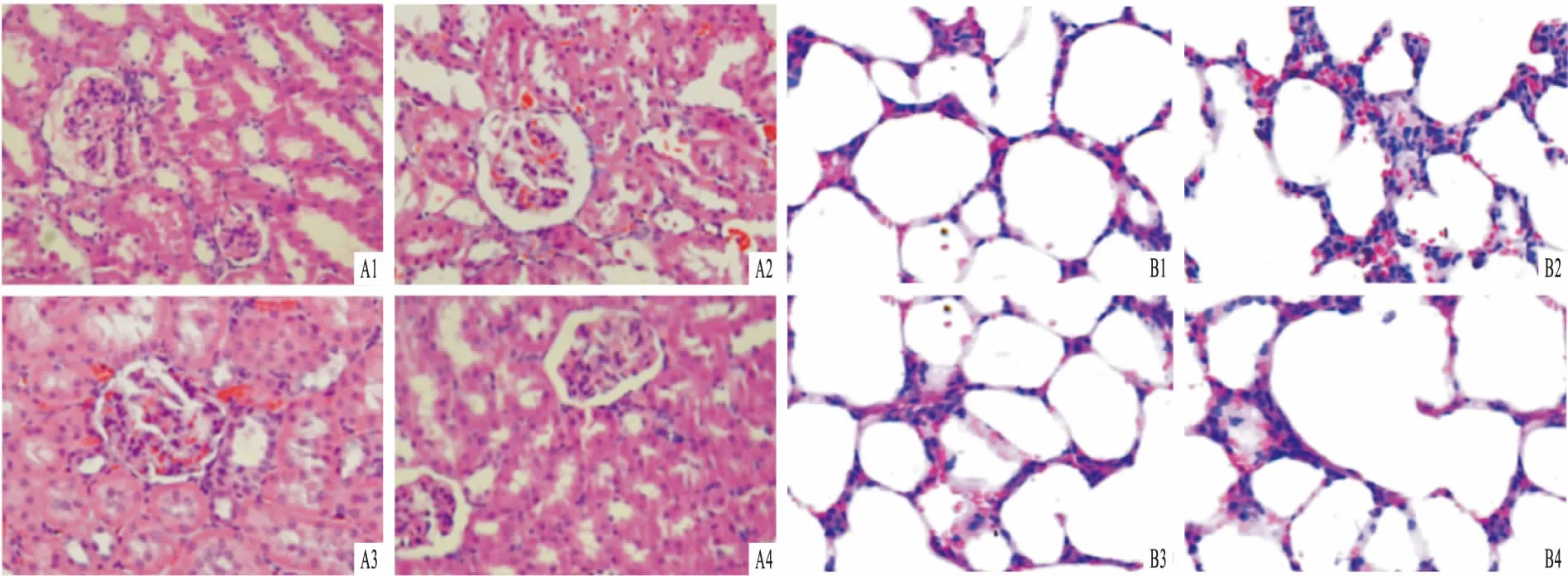
图4 各组大鼠肺脏和肾脏病理切片 HE染色×100

图5 各组大鼠肺脏和肾脏病理损伤评分统计图
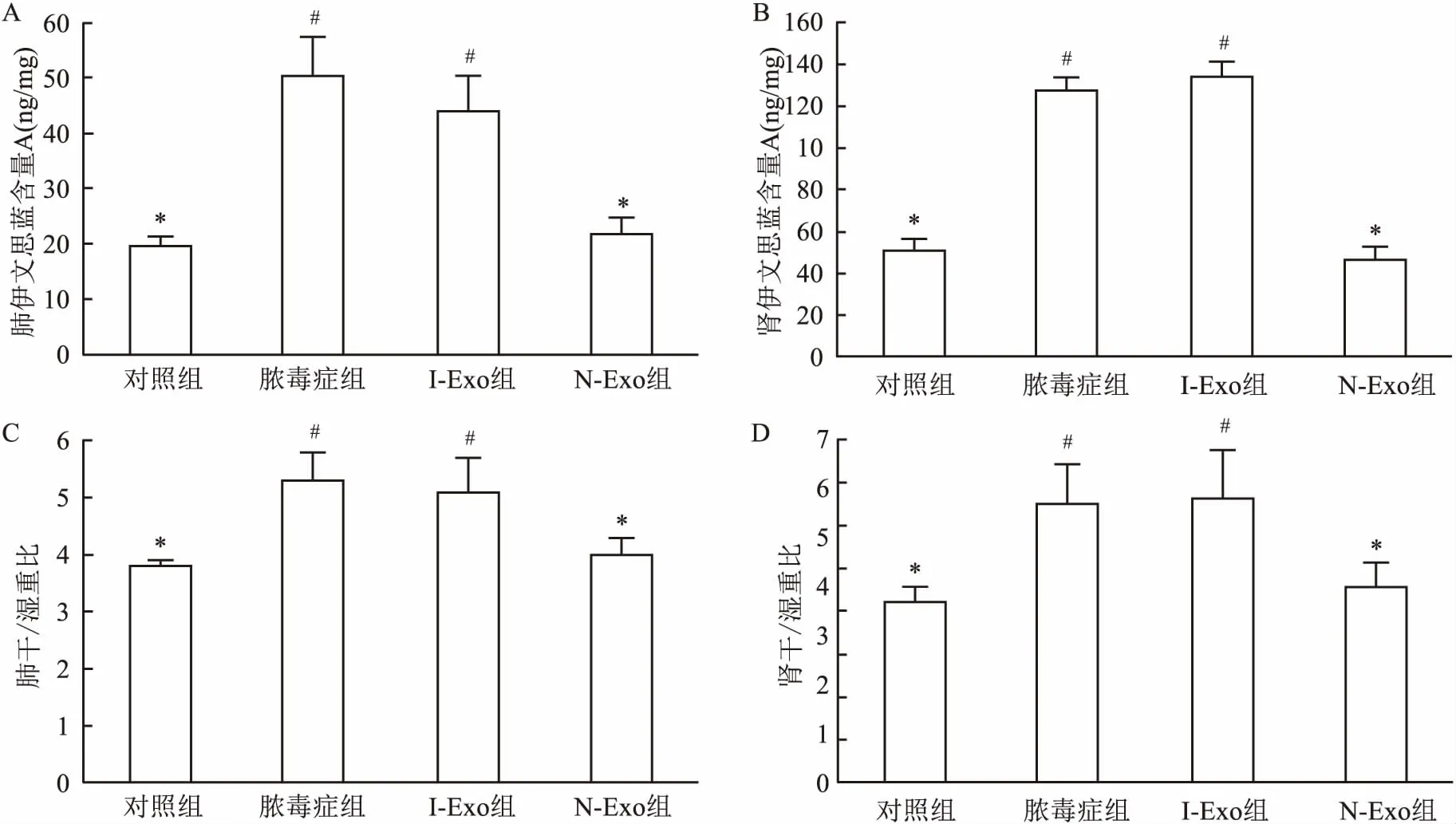
图6 各组肺脏和肾脏血管微渗漏及肾脏干/湿重比统计图
A:肺伊文思蓝含量;B:肾伊文思蓝含量;C:肺干/湿重比;D:肾干/湿重比;与对照组比较:#P<0.05; 与脓毒症组比较:*P<0.05
图7 各组大鼠肾脏内miR-126-3p和miR-126-5p含量统计图

图8 各组大鼠肾脏内HMGB1及其下游关键靶点蛋白含量统计图
A:HMGB1含量; B:RAGE含量;C:TRL-2含量;D:TRL-4含量;E:p-p65含量;与对照组比较:#P<0.05;与脓毒症组比较:*P<0.05
对照组和N-Exo组、脓毒症组和I-Exo组大鼠肾脏内HMGB1、RAGE、TRL-2、TRL-4和p-p65含量差异无统计学意义(P>0.05);但对照组和N-Exo组大鼠肾脏内HMGB1、RAGE、TRL-2、TRL-4和p-p65的含量显著高于脓毒症组和I-Exo组,且差异具有统计学意义(P<0.05),见图8。提示脓毒症导致大鼠肾脏内HMGB1表达升高,同时导致HMGB1下游靶点受体RAGE、TRL-2、TRL-4的表达升高,最终引起核心炎症因子NF-κB的p-p65的含量升高。N-Exo对该病理过程具有逆转作用,这可能就是N-Exo的药理机制。
3 讨论
miR-126主要表达在富含血管的组织内,例如心脏,肺和肾脏之中[5],因此本研究主要集中于大鼠富含血管的肾脏组织中。miR-126的单链RNA前体,经过Dicer酶的加工,其大小臂分别形成一条具有功能的成熟miRNA,即miR-126-3p和miR-126-5p。既往的研究主要集中于miR-126-3p,发现了众多的作用靶点。然而,对于miR-126-5p的研究则相对较少,发现的作用靶点也较少,HMGB1就是其中之一。Tang et al[6]通过miR-126的类似物和抑制剂人为增高或降低高糖培养条件下的人脐静脉内皮细胞(HUVEC)中miR-126的水平,通过荧光素酶报告基因测定,证实了HMGB1基因的3'-UTR是miR-126的直接靶点;同时,过表达miR-126可通过降低HMGB1的表达水平,进而抑制TNF-α表达以及ROS含量和NADPH氧化酶的活性,可能是通过激活Akt-NOS信号通路来发挥抗炎保护作用;抑制miR-126的表达,则获得相反的实验结果。
HMGB1几乎存在于人体所有的细胞内,主要位于细胞核和细胞质内;生理条件下,细胞外无HMGB1。脓毒症中,由于激烈的炎症反应和大量的细胞坏死,活化的单核/巨噬细胞以及损伤坏死细胞,均可释放大量的HMGB1至细胞外,它们通过介导早期和晚期炎症反应以及适应性免疫应答,在脓毒症的发生、发展中起到重要的作用,同时也是脓毒症的候选治疗靶点之一[7]。有研究[8-9]表明,HMGB1在脓毒症小鼠体内是重要的内源性致死因子。另一方面,HMGB1的水平也可反映脓毒症中机体炎症及损伤程度,甚至直接关系到脓毒症的预后。HMGB1的主要受体分子有TLRs[10]、RAGE[11]、T细胞免疫球蛋白黏液素3(TIM3)[12]以及CXCR4[13]等。其中,TLRs主要通过调节髓样分化因子(MyD88)或p38MAPK途径,促使NF-κB活化,从而导致多种炎症因子的释放;RAGE则通过激活p38MAPK和细胞外调节蛋白激酶(ERK1/2),进而导致IΚB的磷酸化和降解,最终也是通过激活NF-κB,促进其核转移,以正反馈的形式进一步增强RAGE表达。TIM3则主要抑制单核/巨噬细胞的活化,同时介导T细胞的凋亡,且与TLRs途径相互抑制。CXCR4则主要通过对多种免疫细胞的趋化作用,从而促进炎症反应的发生发展。本实验结果显示富含miR-126的N-Exo不光显著降低了脓毒症大鼠肾脏组织内的HMGB1水平,也降低了TLR-2、TLR-4以及RAGE的水平,同时还降低了这些受体信号通路的交汇点—NF-κB的p65的磷酸化水平。因此,提示N-Exo可能是通过miR-126的输注,降低了脓毒症大鼠HMGB1的水平,进而通过TLR-2、TLR-4以及RAGE受体的信号转导,抑制NF-κB的激活,进而抑制多种炎症因子的释放并缓解炎症反应,从而降低血管内皮细胞的损伤和血管微渗漏,保护多种器官的功能,最终提高脓毒症大鼠的生存率。本实验结果提示,利用NO诱导的富含miR-126的PMSCs外泌体有望成为治疗脓毒症的新型生物制剂。下一步的研究主要集中于如何通过调节NO浓度调节外泌体内miR-126含量以及探索治疗脓毒症最适外泌体浓度。

