HOXB7基因敲减对裸鼠结肠癌肝转移模型的抑癌机制研究
王 艺,赵雪峰
结直肠癌被确诊后肝转移的发生率约占1/4,而经受根治术后肝转移发生率也约占1/4~1/2,且肝转移为结直肠癌死亡率增高的主要原因[1]。结直肠癌肝转移分子机制的逐步修订或抗肿瘤药物的特异性筛选之需求,选择恰当的动物模型至关重要[2]。但更加迫切的任务是,结直肠癌肝转移的专有肿瘤分子标记物研发、想方设法提前发现转移迹象、转移线路的尽早阻断。近期研究证实,HOXB7基因在诸多恶性肿瘤中主要调控肿瘤血管生成或早期转移,但其在结直肠癌和/或肝转移的研究寥寥无几[3-4]。该研究将转染pcDNA3.1-HOXB7敲减或pcDNA3.1-scramble重组质粒的人结肠癌细胞株HT29经裸鼠脾脏接种建立稳定的肝转移模型后,观察研究HOXB7基因敲减对裸鼠结肠癌肝转移模型的抑癌机制。
1 材料与方法
1.1 实验动物和材料体质量18~20 g,7周龄雄性,BALb/c品系20只实验裸鼠购自大连医科大学实验动物中心。转染pcDNA3.1-HOXB7敲减或pcDNA3.1-scramble重组质粒的人结肠癌细胞株HT29由大连大学附属新华医院医学研究中心构建并提供。人结肠癌细胞株HT29、细胞培养试剂及组织染色试剂由大连大学附属新华医院医学研究中心购入并提供。本研究由经大连大学附属新华医院医学研究伦理委员会审批通过。
1.2 方法
1.2.1细胞培养和细胞混悬液制备 将已被转染的人结肠癌细胞株HT29在37 ℃、5% CO2,含10%小牛血清的RPMI 1640培养液内传代培养,每2~3 d洗换1次培养液。培养细胞融合达80%~90%,采用胰酶消化后,1 000 r/min离心3 min,弃上清液,将细胞加入无小牛血清的RPMI 1640培养液洗涤3次,显微镜下细胞计数,用无小牛血清RPMI 1640培养液调整细胞浓度至2×107/ml,共备2 ml。将已制备的细胞混悬液在冰浴中保存,备30 min之内完成接种。
1.2.2模型设计 制模前1周为实验裸鼠安定期,需对实验裸鼠禁止进行一切刺激性操作。参与模型的实验裸鼠共20只,其中10只HOXB7基因敲减鼠列为研究组,而10只scramble鼠列为对照组。制模后实验裸鼠观察周期为4周。见图1。
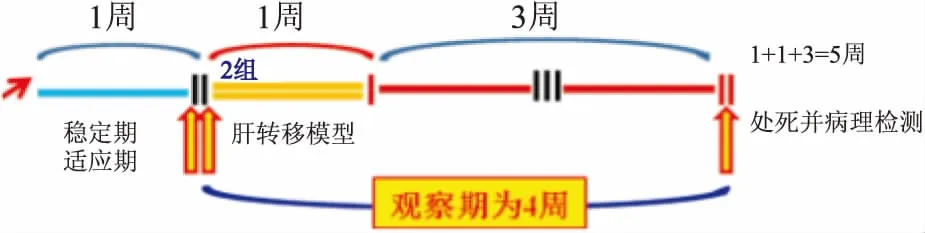
图1 模型设计
1.2.3建立显微镜辅助下结肠癌肝转移模型和制定结肠癌肝转移评分标准 选用地氟醚进行裸鼠全身麻醉。制模全程采用SMZ-B2/T2体视显微镜完成操作。首先,取上腹正中5 mm小切口进入腹腔,利用无损伤镊子轻柔牵出网膜并显露脾脏至腹外。随后,采用31号注射器经脾脏被膜进针至脾实质内约2 mm,缓慢注入已被转染的人结肠癌细胞株HT29混悬液100 μl (细胞数为2×106),确认注射部位脾脏颜色变白、肿胀及无渗漏,采用止血纱布外加湿纱布覆盖注射部位5 min。最后,掀开湿纱布见脾脏无出血后离断脾脏血管、移除脾脏,将网膜及周围组织送入腹腔,逐层关腹,术毕。结肠癌肝转移评分参照本研究组制定的肝转移评分标准[5]。
1.2.4解剖裸鼠和观察指标 每天常观察、记录实验裸鼠的一般状态,实验裸鼠观察期满予以处死。处死后立即解剖观察腹腔内血性腹水、淋巴结肿大、腹膜种植及肝转移瘤形成情况;具体记录实验裸鼠的肝转移瘤大小、肝体质量、病灶间融合、肝表面隆凸及肝转移评分。完整移除的肝脏利用4%多聚甲醛充分固定,肝转移瘤最大直径为中心切开并制作组织蜡块,4 μm厚度切片后进行HE染色,显微镜下观察肝转移瘤细胞情况;具体记录实验裸鼠的肿瘤细胞排列、分布、中央区坏死或凋亡。
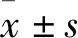
2 结果
2.1 两组组织形态学改变裸鼠结肠癌肝转移模型的成瘤率为100%(20/20)。组织形态学角度分析:与对照组比较,研究组显著抑制裸鼠模型的肝转移瘤形成;递减或衰减肝转移瘤的大小、肝体质量、病灶间融合、肝表面隆凸及肝转移评分,差异有统计学意义(P<0.05),见表1及图2A~C、图2E~2G。
2.2 两组组织病理学改变组织病理学角度分析:与对照组比较,研究组肿瘤细胞排列稀疏、边缘型分布、浸润深度浅、中央区坏死或凋亡成片,差异有统计学意义(P<0.05),见表2、图2D、2H。
3 讨论
针对结直肠癌早期筛查、早期诊断的不断丰富,并结直肠癌发病相关信号通路的揭示,且对结直肠癌浸润和转移规律的公示,显著改善了结直肠癌术后的复发率和生存率[6]。但仍有一部分结直肠癌发生远处转移,由于结直肠癌的远处转移具较强的特异性,且易发生在肝、肺等重要脏器,特别是以肝转移为主导[7]。一旦发生结直肠癌肝转移,治疗难度增加、生存质量下降、死亡率也剧增[8]。因此能否有效阻断肝转移对结肠癌的治疗至关重要,特别是如能提早阻断结直肠癌的转移环节尤为重要。
表1 两组组织形态学变化比较
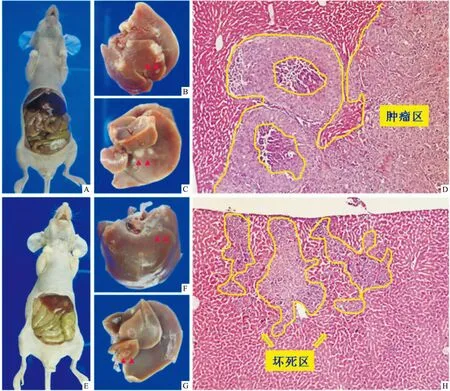
图2 两组结肠癌肝转移模型的组织形态学和组织病理学变化 ×200
A:对照组解剖裸鼠大体观;B:对照组肝脏正面观;C:对照组肝脏背面观;D:对照组肝脏显微镜下观;E:研究组解剖裸鼠大体观;F:研究组肝脏正面观;G:研究组肝脏背面观;H:研究组肝脏显微镜下观
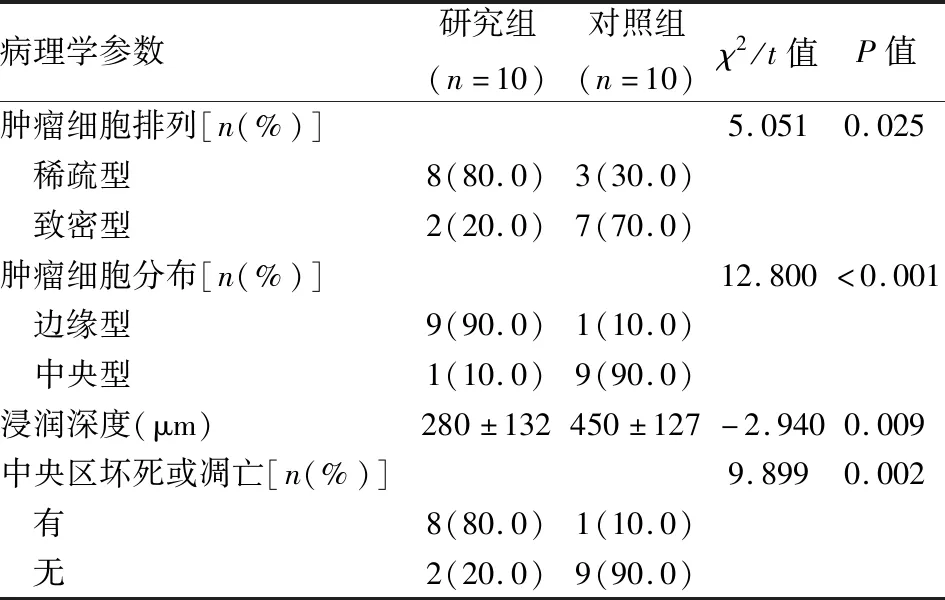
表2 两组组织病理学变化比较
近期研究[9]证实,HOXB7基因在胚胎生殖细胞主要负责调控细胞增殖、分化及迁移,并在成体细胞与上皮细胞间质转化相关,且在恶性肿瘤细胞主要负责调控增殖、黏附、侵袭、迁移、凋亡。目前在诸多原发性或转移性肿瘤中能检测到高表达HOXB7。结肠癌细胞中通过阻断HOXB7-RNAi表达,抑制Notch1信号通路,降低癌细胞的恶性增殖,从而诱导细胞凋亡[10]。肝癌细胞中也通过下调HOXB7表达,抑制癌细胞的异常增殖、黏附、侵袭、迁移,并将细胞滞留于G0-G1期[11]。肺腺癌细胞中HOXB7为细胞增殖和转移能力的重要调控因子,因此也为控制恶性肿瘤进展和转移的临床防治新靶点[12]。
本研究证实,研究组显著抑制裸鼠模型的肝转移瘤形成;递减或衰减肝转移瘤的大小、肝体质量、病灶间融合、肝表面隆凸及肝转移评分;研究组肿瘤细胞排列稀疏、边缘型分布、浸润深度浅、中央区坏死或凋亡成片。充分能说明HOXB7基因敲减能有效抑制裸鼠模型的结肠癌肝转移瘤形成。本研究的实验设计有如下优势:① HOXB7基因首次在结直肠癌肝转移中研究;② SMZ-B2/T2体视显微镜辅助下完成模型的建立;③ 通过动物实验验证HOXB7基因敲减或敲除的成功构建。
综上所述,HOXB7基因敲减可有效抑制裸鼠模型的结肠癌肝转移瘤形成,至于具体的抑癌模式和量化标准的制定有待于进一步考证。

