高脂饮食对兔睾丸组织损害机制及光甘草定保护作用研究
韦雯雯,郭 灿,丁俊丽,吕正梅
一般认为,肥胖的重要原因之一是长期摄入脂肪含量高的各类食物。而一系列疾病均可能由此引发,从而威胁现代人类健康。与之相关的代谢性异常是导致男性生育力低下/不育的重要原因之一[1]。光甘草定(glabridin, GLA)是经由光果甘草中提取而来,富含黄酮类多酚[2],它的抗氧化特性能够明显抑制代谢所产生的自由基、细胞壁和生物大分子等免受活性氧(reactive oxygen species,ROS)损伤[3]。在炎症、心血管、肿瘤治疗等方面多有报道[4-6],相关研究[7]表明,GLA对高脂模型兔的血管能够起到一定的保护作用。但在对肥胖相关代谢性疾病的睾丸间质细胞功能保护作用上尚未见报道,该研究采用此模型,探讨GLA对肥胖相关代谢异常导致睾丸间质细胞功能受损的保护作用及其可能的机制,为肥胖相关的男性生育力低下/不育提供可能的防治措施。
1 材料与方法
1.1 材料雄性新西兰大耳白兔(18只,正常兔饲料喂养,饲养环境室温20~25 ℃左右,湿度55%~60%,光线明暗各12 h)购自山东青岛康大集团;普通级,体质量(2.4±0.5)kg;GLA购自上海东苍生物科技有限公司;胆固醇(cholesterol, CH)购自中国医药集团上海化学试剂公司AR级;抗β-actin、沉默信息调节因子2相关酶1(silent information regulator 1, SIRT1)、类固醇合成快速调节蛋白(steroidogenic acute regulatory protein,StAR)抗体购自美国Santa Cruz Cell Signaling公司;抗葡萄糖调节蛋白78(glucose regulated protein 78, GRP78)GRP78/BiP (B前细胞中的免疫球蛋白重链结合蛋白,immunoglobulin heavy chain binding protein in pre-B cells,BiP)抗体购自英国Abcam公司;抗细胞色素P450 胆固醇侧链裂解酶(P450 cholesterol side chain cleavage,P450scc)、锰超氧化物歧化酶(manganese superoxide dismutase, MnSOD)、3β-羟类固醇脱氢酶(3 beta-hydroxysteroid dehydrogenase,3β-HSD)、多克隆抗体F4/80购自武汉BOSTER、proteintech Group公司;脂质氧化(malondialdehyde, MDA)检测试剂盒、总抗氧化能检测试剂盒[(2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid, ABTS)快速法]购自上海碧云天生物技术公司。
1.2 主要仪器电子天平FA1104购自上海精密科学仪器有限公司;VE-186转膜电泳槽购自上海天能科技公司;四度离心机购自美国Thermo Fisher Scientific INC 公司。
1.3 方法
1.3.1高脂模型的建立 将18只雄性新西兰大耳白兔随机分3组。正常对照组(A组):连续12周喂养基础饲料;高脂模型组(B组):连续12周喂养高脂饲料;GLA组(C组):喂养高脂饲料(含5%猪油及1% CH)的同时,自第7周给予剂量2 mg/(kg·d)的GLA一直至第12周。
1.3.2标本的制备 暴露兔耳缘静脉,3%戊巴比妥钠麻醉,取颈动脉血,离心血清,取上清-20 ℃保存备用。取出睾丸标记-80 ℃保存备用或常规制作石蜡切片。
1.3.3血脂测定 使用全自动化分析仪分析,酶偶联比色法测试项目。
1.3.4免疫组织化学法 石蜡切片脱蜡脱水;组织抗原修复;封闭;滴加稀释的一抗;滴加标记二抗;滴加辣根酶标记链酶卵白素工作液;DAB显色。
1.3.5Western blot法 称取组织标本,冰上充分研磨按步骤提取蛋白。样品与 SDS- PAGE蛋白上样缓冲液按照4 ∶1混匀。蛋白变性后-80 ℃保存备用。配胶,电泳,电转膜,封闭,洗膜,4 ℃孵育一抗过夜。次日洗膜,稀释二抗,孵育,洗膜,使用ECL显影曝光。
1.3.6脂质氧化(MDA)检测实验 取兔子睾丸组织,按照试剂盒说明书操作步骤检测睾丸组织脂质氧化水平。
1.3.7总抗氧化能力检测(ABTS快速法) 取兔子睾丸组织,按照试剂盒说明书操作步骤检测睾丸组织总氧化能力。
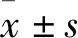
2 结果
2.1 GLA对高脂兔模型血脂的影响高脂模型组总胆固醇(total cholesterol,TCH )和三酰甘油(triglyceride, TG)显著升高,差异有统计学意义(P<0.05)。GLA给药后,TCH下降,差异有统计学意义(P<0.05);TG有所下降,但差异无统计学意义。见表1。
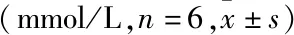
表1 各组兔血清中TCH和TG含量的比较
与正常对照组比较:*P<0.05;与高脂模型组比较:#P<0.05
2.2 睾丸间质细胞3β-HSD及巨噬细胞抗F4/80抗体表达变化3β-HSD抗体特异性标记睾丸间质细胞,阳性染色呈棕黄色。高脂模型组较对照组阳性表达明显变弱;GLA给药表达有所增强;抗F4/80抗体特异性标记巨噬细胞,高脂饮食后阳性染色细胞数量增加;经治疗数量减少。见图1、2。
2.3 GLA对高脂模型兔睾酮合成相关蛋白的影响Western blot研究转运蛋白StAR及合成类固醇酶P450scc水平变化。结果显示,经高脂饮食12周后,较对照组StAR、P450scc表达明显下调(P<0.05);GLA治疗6周,StAR、P450scc表达有所增加(P<0.05)。见图3。β-actin作为内参。t检验显示,与正常对照组比较,高脂模型组P450scc(t=3.997,P<0.05)和StAR(t=7.201,P<0.05)水平明显下降,差异有统计学意义;与高脂模型组比较,GLA组P450scc(t=4.290,P<0.05)和StAR(t=3.287,P<0.05)水平明显升高,差异有统计学意义。
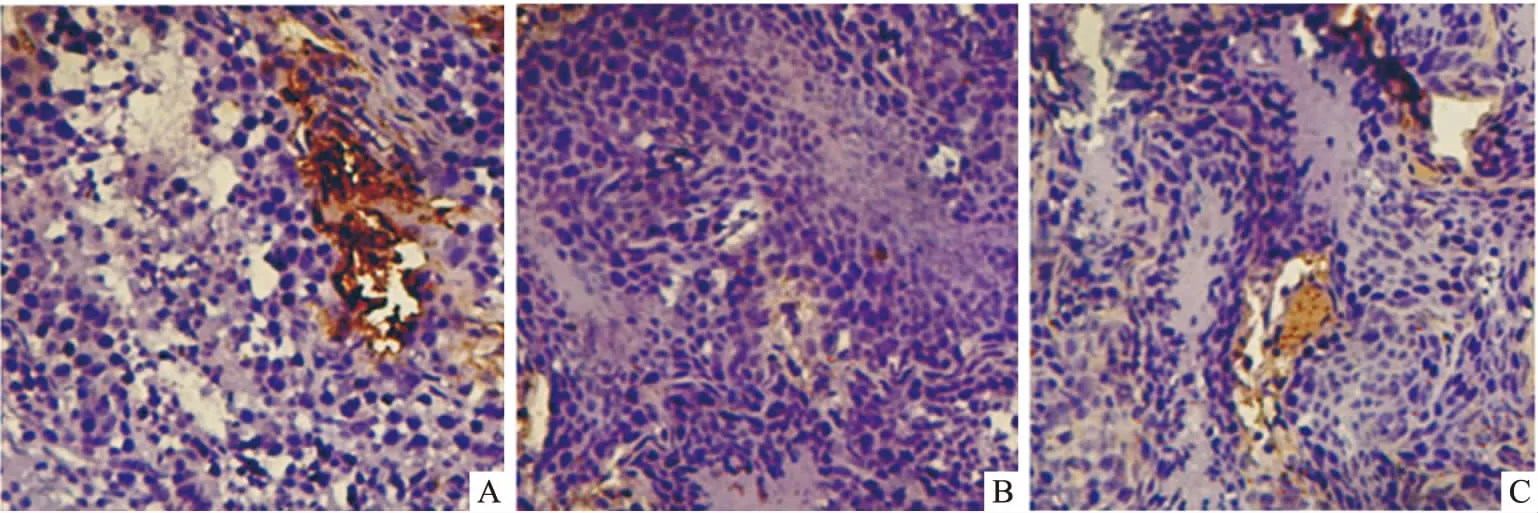
图1 兔睾丸组织间质细胞免疫组织化学染色 ×100
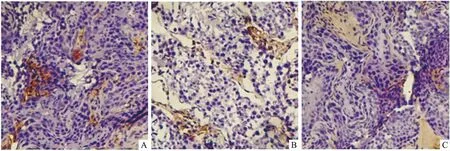
图2 兔睾丸组织巨噬细胞细胞免疫组织化学染色 ×100
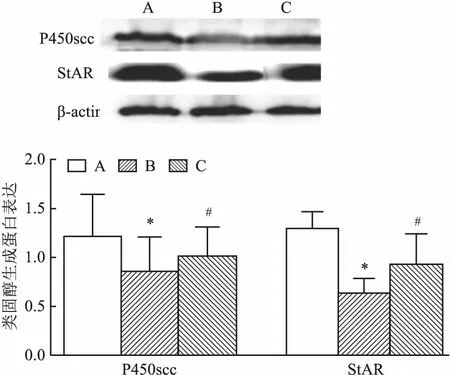
图3 Western blot法检测各组兔睾酮合成相关蛋白表达水平变化
A:正常对照组;B:高脂饮食组;C:GLA组;与正常对照组比较:*P<0.05;与光甘草定组比较:#P<0.05
2.4 GLA对高脂模型兔睾丸组织中抗氧化系统的影响
2.4.1Western blot检测结果 高脂饮食12周后,较正常对照组,SIRT1、MnSOD和人谷脱甘肽过氧化酶4(human glutenin peroxidase 4,GPx4)表达明显下调(P<0.05)。而GLA组可见SIRT1、MnSOD和GPx4表达增加(P<0.05)。见图4。β-actin作为内参,采用t检验结果发现,与正常对照组相比,高脂模型组GPx4(t=3.264,P<0.05)、MnSOD(t=4.929,P<0.05) 和SIRT(t=4.415,P<0.05);水平明显下降,差异有统计学意义。与高脂模型组相比,GLA组GPx4(t=3.246,P<0.05 ) 、MnSOD(t= 6.484,P<0.05) 和SIRT(t=3.709,P<0.05)水平明显升高,差异有统计学意义。
2.4.2脂质氧化变化 高脂模型组MDA较正常对照组浓度升高,差异无统计学意义;而GLA组MDA浓度下降明显,甚至低于正常对照组,但差异无统计学意义。见图5。采用t检验,分别为高脂模型组与正常对照组比较,以及GLA组与高脂模型组比较。
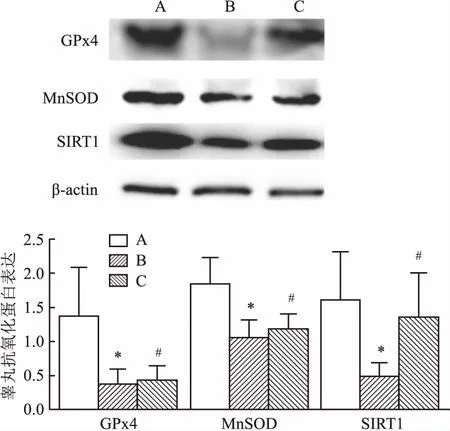
图4 Western blot法检各组兔睾丸组织中主要抗氧化物蛋白水平变化
A:正常对照组;B:高脂饮食组;C:GLA组;与正常对照组比较:*P<0.05;与GLA组比较:#P<0.05
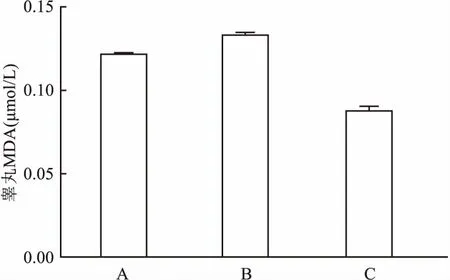
图5 高脂模型兔脂质氧化变化
2.4.3总抗氧化能力测定 ABTS快速法在414 nm测定ABTS+的吸光度即可测定并计算出组织的总抗氧化能力。结果显示,与对照组比较,高脂饮食组的组织总抗氧化能力降低,差异无统计学意义;GLA给药后总抗氧化能力明显升高,但差异无统计学意义。见图6。采用t检验,分别为高脂模型组与正常对照组比较,以及GLA组与高脂模型组比较。
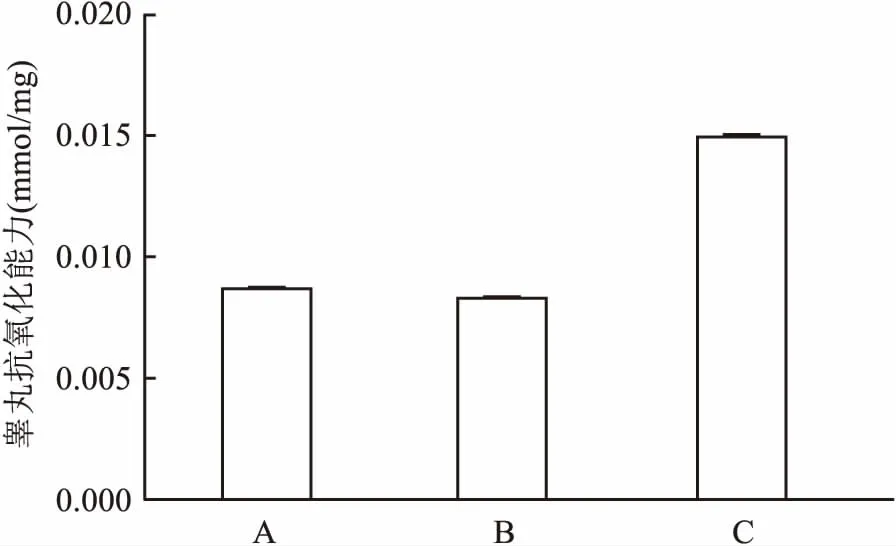
图6 各组兔睾丸组织总抗氧化能力变化
2.5 GLA对高脂模型兔睾丸组织内质网应激的影响Western blot技术检测睾丸组织内质网应激分子GRP78表达变化。与对照组比较,高脂模型组表达升高。GLA组较高脂模型组表达有所下降,但差异无统计学意义。见图7。β-actin作为内参,采用t检验,分别为高脂模型组与正常对照组比较,以及GLA组与高脂模型组比较。
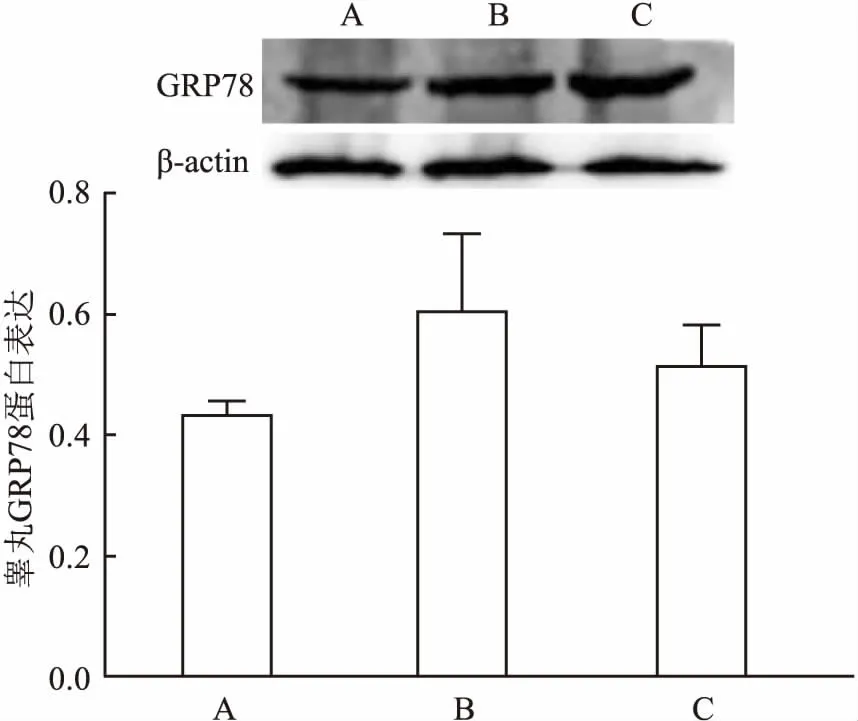
图7 Western blot法检测各组兔睾丸组织内质网应激分子水平变化
3 讨论
学术界对因肥胖导致的相关代谢性疾病并因而引发男性的生殖功能减退的问题一直非常关注[8]。该类疾病的成因多样化,但是其中因高糖、高胆固醇饮食习惯以及长期缺乏运动是较为重要的因素。
对于那些高脂饮食喂养的雄性小鼠,其睾丸组织呈现出超微结构下的损伤,其睾丸间质细胞线粒体的数目出现减少[9]。本研究用 Western blot法检测兔睾丸组织StAR和P450 scc在高脂模型组中的表达均较正常对照组下调;抗3β-HSD抗体高脂组阳性表达明显变弱;血清TCH、TG均升高。给药后StAR和 P450 scc表达较高脂组上调;抗3β-HSD抗体表达有所增强;TCH下降。
由肥胖引发的代谢异常以及由其导致的睾酮合成下调的另一个重要原因是睾丸间质内环境改变[10]。氧化应激对于睾丸间质细胞合成睾酮以及精子发生都易产生影响,睾丸局部代谢状态可能由于高脂饮食而发生改变,导致细胞内ROS的蓄积并使得氧化应激得到激发。MnSOD和GPx4是抗氧化防御系统中最重要的酶组分,当它们的对在细胞内蓄积的ROS难以消除,则细胞大分子会受到氧化破坏,继而加剧了氧化应激。 SIRT1可使得k基因结合核因子(nuclear factor-k-gene binding,NF-kB)、叉头转录因子等去乙酰化,在保护线粒体的功能方面非常重要,能够抑制细胞死亡、延缓衰老,应激状态下的细胞得以更多自我修复[11]。本研究采用Western blot法检测到SIRT1、MnSOD、GPx4在高脂模型组表达下调,吸光度值分析,睾丸组织因高脂饮食使得脂质氧化有所增加,同时,总抗氧化能力出现弱化。GLA给药后,SIRT1、MnSOD、GPx4表达上调,脂质氧化减轻,总抗氧化能力增加。睾丸间质中浸润的巨噬细胞产生促炎细胞因子和ROS,引起睾丸间质细胞出现了氧化应激,引致线粒体的功能损伤,同时合成睾酮蛋白/酶的表达受到抑制[12]。本研究显示高脂饮食后,睾丸间质中巨噬细胞数量增加,给药后,数量有所减少。
近年来,有观点认为氧化应激与内质网应激存在交叉作用[13]。氧化应激通过影响内质网蛋白的正确折叠引起内质网应激,而内质网应激的产生可以使ROS释放,加重氧化应激[14]。做为分子伴侣,BiP/GRP78可以感知错误折叠蛋白以及参与非折叠蛋白的反应,在内质网应激中发挥重要作用[15]。本研究数据显示,高脂模型组GRP78表达升高,经过GLA干预,表达有下降趋势。
综上所述,本研究结果支持以下基本结论:模型兔血脂由于高脂饮食导致了紊乱,以及睾丸间质细胞的睾酮相关蛋白/酶出现了下降,睾丸间质微环境改变;GLA通过调节模型兔的代谢状态,减轻睾丸间质氧化应激,发挥保护睾丸间质细胞功能的作用。
——疾病防治的新靶标

