前列腺基质细胞的原代培养方法
霍雨薇,丁雨,朱国念,吴思思
四川大学华西医院 a.精准医学研究中心,b.公共实验技术中心,四川 成都 610041
良性前列腺增生(benign prostatic hyperplasia,BPH)是泌尿外科最常见的疾病之一,由于BPH的高发病率及对生活质量的严重影响,尤其是老年男性患者[1-2],因此对BPH的治疗一直是临床研究的重点之一。研究显示,前列腺增生是上皮和基质成分混合增生的疾病。前列腺腺体可以分为上皮和基质两部分,这两个部分在正常前列腺体积中所占比例约为1∶2,随着年龄的增加,前列腺的基质细胞逐渐增多,而上皮细胞逐渐减少。所以基质增生为最主要的病理特征,在BPH的发病过程中发挥着重要作用[3-5]。BPH发病过程缓慢,而构建动物模型耗时、耗力。前列腺原代基质细胞(primary stromal cell,PSC)离体时间短,遗传性状和体内细胞相似,适于做细胞形态、功能和分化等研究[6],此时的细胞保持原有细胞的基本性质,所以培养前列腺PSC不但可以模拟BPH体内环境,而且成本较低,因而成为目前BPH基础研究的重要模型[7]。前列腺PSC原代培养成功率低,生存时间短,传代次数少,其中分离提取的前列腺PSC贴壁性差、增殖率低是最大瓶颈。且因为样本来源于临床老年患者,手术方式多为经尿道前列腺电切术,导致细胞活性低,爬出量极少。为此,我们在借鉴国内外学者研究方法的基础上,对3种不同的前列腺PSC培养方法进行了探索研究,最后确立一种胰酶消化组织块贴壁培养前列腺PSC的方法,为获取PSC提供更为简便的途径。
1 材料与方法
1.1 标本来源
四川大学华西医院泌尿外科2016-12~2017-08因良性前列腺增生经尿道前列腺电切术手术标本,供者年龄均大于70岁。所有前列腺标本均经病理检查诊断为良性前列腺增生,排除前列腺癌、膀胱移行细胞癌前列腺组织浸润等病变。
1.2 材料
澳洲特级胎牛血清(CLARK Bioscience公司);DMEM高糖培养基(Gibco公司);青霉素-链霉素溶液(双抗)、胰蛋白酶(Hyclone公司);平滑肌α肌动蛋白抗体(Abcam公司);波形蛋白抗体(武汉艾美捷科技有限公司)。
1.3 取材及预处理
手术室无菌条件下切取新鲜良性前列腺增生组织标本,置于无血清培养基中,冰上快速运至实验室。提前配制含青霉素(200 IU/mL)、链霉素(200 μg/mL)的双抗PBS缓冲液(仅用于组织预处理),在超净工作台中用眼科剪小心剪去电切烧焦、毛细血管等部分,用PBS缓冲液冲洗3次。
1.4 组织块法
取高温灭菌后的安瓿瓶,将预处理后的组织放入安瓿瓶中,剪切至1 mm3大小,分别将组织块以间距5 mm左右均匀铺于培养皿(预先用含双抗的培养基润洗底部)中,于37℃、5%CO2培养箱中培养,2 h后加入1 mL DMEM高糖完全培养基(含20%特级胎牛血清、双抗溶液),24 h后补加完全培养基至正常量。
1.5 胶原酶消化法
配置消化液[12 mgⅠ型胶原酶(1 mg/mL),0.6 mg DNA酶(0.1 mg/mL)]、终止液[无血清培养基DMEM,EDTA(2 mmol/L)]。组织样本经预处理后,剪切至1 mm3大小,加入3倍组织体积的消化液,37℃振荡消化10 min,800~1000 r/min离心去上清液,在组织块中加入新消化液,37℃振荡消化30~40 min,加入终止液终止消化,离心收集上清液,400 r/min离心,弃上清收集细胞,加入完全培养基(DMEM高糖+20%胎牛血清+双抗)重悬,37℃、5%CO2培养箱中培养。
1.6 胰酶消化组织块贴壁法
组织样本经预处理后,剪切至1 mm3大小,加入3倍组织体积的0.25%胰蛋白酶,于37℃恒温水浴箱内振荡消化10 min,瞬时离心弃上清后,再加3倍组织体积的0.25%胰蛋白酶,再次消化10~20 min,消化至组织块一经摇动即成细胞团块则认为消化充分。800 r/min离心3 min去除上清中的胶质团块并弃上清,加少量培养基重悬,以间距5 mm左右将组织块接种至培养皿(接种可用枪尖或镊子轻铺,培养皿预先用血清浸润处理),37℃、5%CO2培养箱中培养2 h后,沿培养皿壁缓慢加1 mL完全培养基继续培养,24 h后补加完全培养基至正常量。
1.7 细胞传代
培养至第2周,胰酶消化组织块贴壁法中组织块周围细胞游出及增殖量已达到培养皿的80%左右,进行第1次原代细胞传代。吸去培养基,用含双抗的PBS清洗2次,加入1 mL 0.25%胰蛋白酶于37℃消化,显微镜下观察,当呈现胞质回缩、细胞间隙增大时,加入等体积的完全培养基终止消化,800 r/min离心3 min,吸去上清,加入新的完全培养基重悬,按1∶3接种至新培养皿,37℃、5%CO2培养箱中继续培养。
1.8 细胞冻存与复苏
1.8.1 细胞冻存液配制 DMEM高糖培养基中加入10%DMSO(9∶1),4℃预冷备用。
1.8.2 细胞的冻存 待胰酶消化组织块贴壁法中传代培养的细胞生长到对数期时进行冻存,吸去培养基,PBS清洗2次,0.25%胰蛋白酶消化,显微镜下观察,当呈现胞质回缩、细胞间隙增大时,加入等体积培养基终止消化,收集至离心管中并计数。1000 r/min离心5 min,吸去上清液,加入冻存培养液重悬,细胞最终密度为5×106~10×106/mL。轻轻混匀后加入1 mL悬液于无菌冻存管,将冻存管放入程序降温盒中,-80℃冻存过夜,次日将冻存管转入液氮冻存。
1.8.3 细胞的复苏 从液氮中快速取出冻存管,在37℃水浴锅内尽快融化,吸出细胞悬液至离心管,加入5倍以上体积的培养液,混匀后800 r/min离心3 min,弃上清,加入完全培养基重悬,接种于培养皿中,放入CO2培养箱静置培养。细胞生长至3 d后进行传代。
1.9 前列腺PSC免疫荧光鉴定
对胰酶消化组织块贴壁法培养的第2代细胞进行免疫荧光鉴定。取3.0×104细胞接种至24孔板中,制备细胞爬片;PBS浸洗爬片3次;加4%多聚甲醛固定爬片30 min,PBS浸洗爬片3次,4 min/次;加 0.2%Triton X-100室温通透 3 min,PBS浸洗爬片3次,3 min/次;3%牛血清白蛋白室温封闭 30 min,PBS浸洗爬片 3次,3 min/次;加400 μL小鼠抗波形蛋白抗体(1∶500)及兔抗平滑肌α肌动蛋白抗体,4℃过夜,PBS洗3次,3 min/次;加400 μL FITC标记山羊抗小鼠IgG,室温1 h,避光,PBS 洗 3次,3 min/次;DAPI(1∶1000)染细胞核1 min,PBS洗4次;防荧光淬灭剂封片,荧光正置显微镜成像。
1.10 前列腺PSC增殖曲线测定
取第3代细胞,以约1.0×104/孔接种于24孔板,每天取3孔细胞,弃掉培养基,加0.25%胰蛋白酶消化贴壁细胞,用血球计数板计数贴壁细胞,取3孔细胞计数的平均值作为该时间组的细胞数目。连续计数7 d,记录并绘制生长曲线。
2 结果
2.1 不同原代培养方法的比较
图1A为胶原酶消化法的原代细胞,贴壁细胞少,状态差;图1B是采用组织块贴壁法培养14 d后得到的细胞,细胞游出速度较慢,细胞量少且未展开贴壁;图1C、D为采用胰酶消化组织块贴壁法培养7 d后的细胞量,细胞透明度高,折光性强,形态均一,呈长梭形。
10 d细胞生长至瓶底的70%~80%,进行1∶2传代,3 d左右细胞即可融合成片。细胞多呈长梭形,融合后呈纤维状排列(图2A)。细胞状态好,予以冻存,复苏后细胞存活率约为80%(图2B)。本实验传到第3代,细胞状态较好。
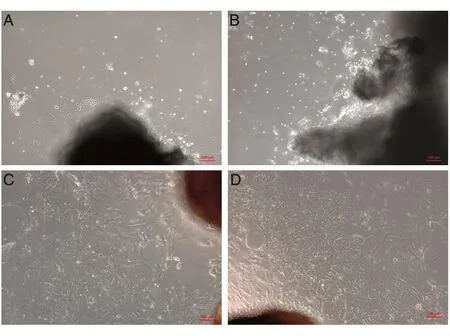
图1 不同方法培养人前列腺PSC显微图像
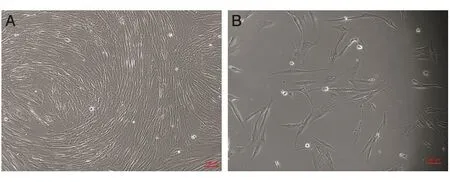
图2 细胞传代及复苏显微图像
2.2 原代前列腺PSC纯度鉴定
选取第3代前列腺PSC进行免疫荧光鉴定,平滑肌α肌动蛋白与波形蛋白染色均为阳性(图3),显微镜下随机选择5个不同区域计数阳性细胞与细胞总数之比,结果显示,获取的第3代前列腺PSC纯度为95.3%±2.4%。

图3 前列腺PSC免疫荧光鉴定
2.3 前列腺PSC增殖活力测定
由于胰酶消化组织块法的原代细胞与第2代培养的前列腺PSC内混杂有少量上皮细胞,因此仅对纯化后的第3代PSC进行生长曲线分析[8-9]。血球板计数法连续7 d计数PSC的增殖能力,结果见图4。生长前2 d细胞增殖较少,提示PSC在此时间段增殖能力较弱;2~4 d增殖变化比前2 d显著(P<0.05),提示此段时间内细胞出现增殖,处于对数生长期;5~7 d增殖停滞,与理性的实验细胞生长曲线一致。

图4 前列腺PSC生长曲线
3 讨论
良性前列腺增生以中老年男性为高发群体,是引起排尿障碍的最常见病因。BPH可导致患者尿道延长、受压变形以及尿道阻力增加,使得膀胱内压升高,继而引起排尿期、储尿期相关症状,甚至造成上尿路功能及结构损害,临床出现下尿路梗阻症状,虽然其属于良性病变,但严重影响患者的生活质量[10]。原代培养的细胞生物学特性未发生很大变化,仍具有二倍体遗传特性,能最接近和反映体内生长特性[11-12]。为了解BPH疾病的发病机理,建立一种高效可行的人前列腺基质细胞的原代培养方法尤为重要。
临床来源的组织,因其组织位置、离体后储存、长距离运输,极易被微生物污染,且术中采用的电切术可致组织表面部分呈焦状,增加了污染风险,加大了实验难度,因此需要快速取出且放入无菌缓冲液中运至实验室进行原代分离培养。本实验所用组织来源于经尿道前列腺电切术的患者,大部分组织表面呈焦状,此部分细胞已无法进行分离培养,需用眼科剪将焦状部分祛除,再用含双抗的PBS清洗3~4次,然后进行组织块的剪切和消化操作,最后加入完全培养基进行培养。经多批次、长时间摸索,既规避了因污染导致原代培养失败的可能性,使细胞生长状况得到改善,同时也使细胞数目增多、生长周期缩短。
据有关资料显示,多数国家统计表明组织学上增生发生率与年龄成正相关,其发生几率几乎是50岁以上50%、60岁以上60%、70岁以上70%、80岁以上80%~100%[13]。实验中的临床组织来源患者均大于70岁,由于年龄较大,使得组织活性较低,细胞爬出速度慢,细胞量极少,很难获得非恶性和高度分化的基质细胞株[14]。本研究结果表明,预处理后的组织先进行胰酶消化,能使组织内部细胞变得松散,便于细胞游离出,缩短培养周期;胰酶消化后将组织块贴壁培养,贴壁较牢,不易脱落且易于细胞游离出,采用完全培养基继续培养,可使细胞游出更快、得率更高。
通过设计系列对照实验,采用胰酶消化组织块贴壁法、完全培养基,成功培养了人前列腺基质细胞,所得细胞生长状态良好,且能够进行传代,为后续研究提供了简单易行的方法。

