结合肽P201与5-氟尿嘧啶联合用药对肝癌HepG2细胞的协同杀伤作用及抗耐药分子机制
郭红萍,敖智广,王隽,王思怡,付鹏德,刘新荣,茆灿泉
西南交通大学 生命科学与工程学院,四川 成都 610031
肝癌是世界第二大癌症死亡原因,其发病率逐年增高[1]。肝癌细胞对放射治疗不敏感,同时具有对各种细胞毒性化疗药物的多药耐受(multi-drug resistance,MDR)特性[2]。MDR1又称P-糖蛋白,属于ATP结合盒式(ATP-binding cassette,ABC)转运蛋白家族,是一种跨膜泵,用于清除多种有毒化合物,包括主要的癌症化疗药物[3],且ABCG2转运蛋白同样是与肿瘤多药耐药有关的新的药物排出泵。5-氟尿嘧啶(5-fluorouracil,5FU)是一种常用的化疗药物,可治疗多种恶性肿瘤,然而由于5FU耐药性的频繁发生,化疗效果有限[4-5]。叉头盒 M1(forkhead box M1,FoxM1)转录因子是细胞周期进程[6]、转移[7]和耐药的关键叉头盒转录因子家族成员[8],具有保守的翼螺旋DNA结合域(DNA binding domain,DBD)[9]。本实验室前期通过噬菌体随机十二肽库展示技术,获得了对FoxM1-DBD有高亲和力的结合肽P201[10],且已证实多肽9R-P201可以显著抑制肝癌细胞HepG2的增殖、迁移与侵袭,并诱导细胞凋亡[11]。在本研究中,我们通过多种方法探讨P201+5FU联合用药对HepG2细胞的协同杀伤作用及抗耐药分子机制,期望为克服肿瘤化疗耐药瓶颈提供新线索。
1 材料与方法
1.1 材料
人源肝癌HepG2细胞;9R-P201(上海强耀生物科技有限公司合成,纯度98.0%);5FU(Sigma公司);胎牛血清(Gibco公司);CCK-8试剂盒、AOEB荧光双染试剂盒、AnnexinⅤ-FITC细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);TRIzol试剂、逆转录试剂盒、ECL化学发光试剂盒(赛默飞世尔科技公司);荧光定量PCR试剂盒(罗氏诊断产品上海有限公司);抗FoxM1、MDR1鼠单克隆抗体,羊抗鼠IgG-Biotin二抗(武汉博士德公司)。
1.2 CCK-8细胞毒性实验
将 HepG2 细胞以 5.0×103/孔接种 100.0 μL 于96孔板,实验设立对照组、P201组(45.0、50.0 μg/mL)、5FU组(80.0、100.0 μg/mL)、P201+5FU联合用药组[P201(45.0 μg/mL)+5FU(80.0 μg/mL)、P201(45.0 μg/mL)+5FU(100.0 μg/mL)、P201(50.0 μg/mL)+5FU(80.0 μg/mL)],每组设6个复孔,于37℃、5%CO2、饱和湿度的细胞培养箱中培养,到达处理时间后观察细胞形态并拍照,后加CCK-8试剂,避光孵育1.5 h,用酶标仪测定D450nm值,按下式计算细胞存活率:

其中,D0为调零组吸光度值,D1为实验组吸光度值,D为对照组吸光度值。
1.3 细胞划痕实验
HepG2细胞按2.5×103/孔铺至6孔板,细胞融合达80%~90%后用200.0 μL无菌枪头划痕,各实验组分别处理细胞24和48 h后于倒置显微镜下观察、拍照,最后用Image J软件定量细胞迁移率。实验重复3次。
1.4 Transwell细胞迁移实验
各实验组处理48 h后调整HepG2细胞浓度至 2.5×103/mL,按 200.0 μL/孔将细胞悬液加到Transwell小室的上室中,培养箱中继续培养12 h,加入4%多聚甲醛固定15 min,0.1%结晶紫染色15 min,显微镜下观察拍照。实验重复3次。
1.5 吖啶橙/溴化乙锭(AO-EB)荧光双染
HepG2细胞按2.5×104/孔铺至6孔板后加药处理48 h,加入预先配置的AO-EB工作液(20.0 μL AO 储液+20.0 μL EB 储液+100.0 μL PBS,混匀后避光储存),荧光显微镜下观察拍照。
1.6 AnnexinⅤ-FITC/PI细胞凋亡检测
将HepG2细胞处理48 h后,分组收集实验组和对照组细胞,从中取 2.0×103~2.5×103细胞,离心去上清,加入500.0 μL AnnexinⅤ-FITC/PI结合缓冲液重悬,再依次加入5.0 μL AnnexinⅤ-FITC、5.0 μL PI混匀,室温避光孵育15 min,用流式细胞仪(Beckman公司)检测分析。
1.7 平板克隆形成实验
HepG2细胞按1.0×103/孔铺至培养皿(直径6 cm),37℃孵育24 h后加药处理,后每隔3 d换含有各处理药的培养液,处理14 d到达作用时间后,用4%多聚甲醛固定20 min,结晶紫染色20 min,PBS洗脱3次,拍照,以克隆数>50计作1个克隆。实验重复3次。
1.8 qRT-PCR
将HepG2细胞按2.5×103/孔铺至6孔板中过夜培养,加药处理48 h。TRIzol法提取样本总RNA,再用Invitrogen M-MLV第一链合成试剂盒合成总cDNA。采用FastStart DNA Green Master(Roche公司)试剂盒,在LightCycler 96实时荧光定量PCR仪(Roche公司)上进行qRT-PCR。实验重复3次。检测基因及内参GAPDH的引物信息见表1。
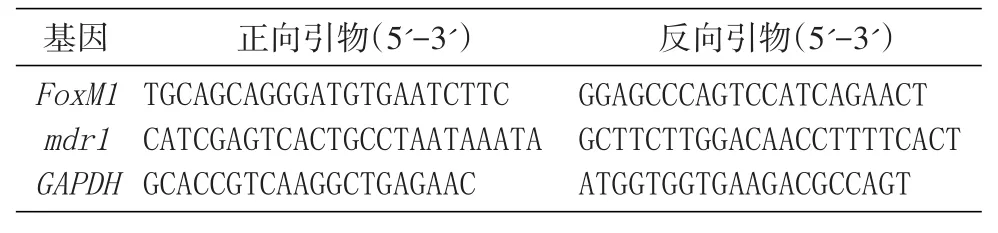
表1 实时荧光定量PCR引物
1.9 Western印迹
各加药处理组作用HepG2细胞48 h后提取细胞总蛋白,BCA法定量蛋白浓度,取30.0 μg样品蛋白进行SDS-PAGE后,PVDF转膜,5%脱脂奶粉封闭,一抗孵育过夜,TBST清洗,二抗孵育2 h,洗膜,ECL显色曝光。
1.10 统计学分析
实验数据采用Origin 8和SPSS 22软件处理,结果以x±s表示,P<0.05为有统计学差异,P<0.01为显著差异,P<0.001为极显著差异。
2 结果
2.1 多肽P201+5FU联合用药对HepG2细胞的抑制杀伤作用
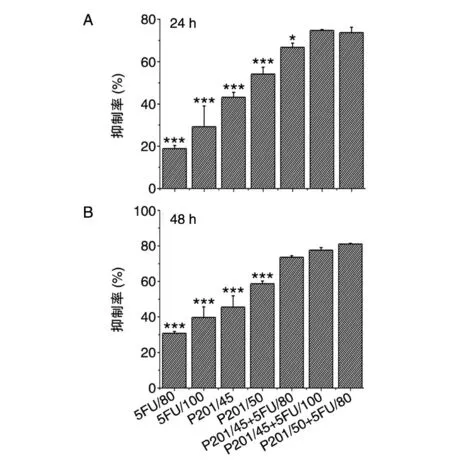
图1 CCK-8法测定加药处理24(A)、48 h(B)后HepG2细胞的存活率
如图1所示,联合用药组处理HepG2细胞48 h后,与对照组比较,均能显著抑制HepG2细胞的增殖,随着药物浓度的增大,细胞杀伤作用增强。与相同浓度的单药 P201(45.0 μg/mL)、5FU(100.0 μg/mL)相比较,联合用药组[P201(45.0 μg/mL)+5FU(100.0 μg/mL)]对细胞的抑制杀伤作用更强,且差异极显著(P<0.001),两药具有协同作用。因此,在本实验设计中联合用药最优处理时间为48 h,最优联合浓度为P201(45.0 μg/mL)+5FU(100.0 μg/mL),后续实验均照此处理。
2.2 联合用药对HepG2细胞的促凋亡作用
图2A示AO-EB荧光双染。处理48 h后对照组细胞大小、形态均匀,呈绿色荧光;各加药组细胞形状呈不规则变化,核染色质出现程度不一的固缩和橙色荧光,呈现典型的细胞凋亡特征,且联合用药组具有凋亡特征的细胞比例呈显著上升趋势。这也被进一步的AnnexinⅤ/PI流式细胞仪检测分析所确认(图2B),5FU、P201及联合用药组早期凋亡率分别为8.04%、7.75%和19.73%,晚期凋亡率分别为11.37%、17.41%和23.68%。
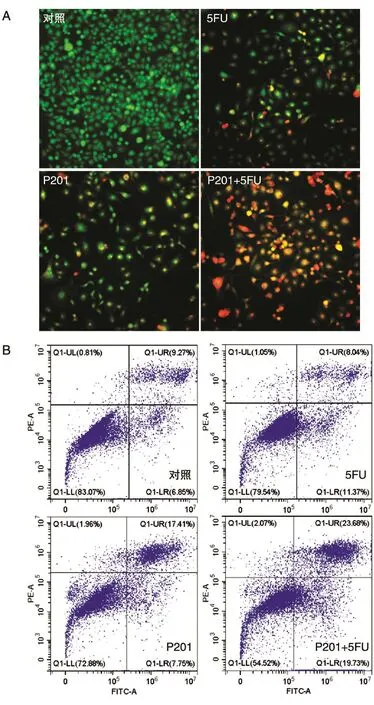
图2 加药处理对HepG2细胞的促凋亡作用
2.3 联合用药对HepG2细胞增殖与迁移能力的影响
由图3可知,联合用药处理HepG2细胞后,与对照组及各单药处理相比,其克隆形成能力、迁移距离均明显下降。加药处理后各组培养14 d,对照组克隆数显著高于各加药处理组,单药处理有少量克隆数,而联合用药组未出现细胞克隆数(图3A)。联合用药组处理24、48 h后HepG2细胞划痕愈合能力均呈减弱趋势,与对照组和各单药处理相比差异显著(P<0.01)(图3C、E)。进一步的Transwell实验也验证了这种迁移抑制作用,联合用药组HepG2细胞迁移率仅为对照的10%(图3B、D)。
2.4 联合用药对HepG2细胞中FoxM1和mdr1等相关基因表达的影响
qRT-PCR结果如图4A、B,与对照组相比,HepG2细胞经5FU单独处理48 h后,FoxM1下调,mdr1上调;经P201单独处理后mdr1下调;联合用药组FoxM1、mdr1均显著下调。这与蛋白水平结果一致,且ABCG2蛋白水平下调(图4C、D)。联合用药组抑制FoxM1、mdr1和ABCG2的表达作用更强,结果具有显著性差异(P<0.01)。
3 讨论
化疗是目前癌症治疗的主要途径之一。然而,肿瘤细胞对几乎所有化疗药物和靶向药物的耐药性已成为普遍现象。自发现系列耐药蛋白以来,药物外排抑制一直是采用维持化疗药物细胞内浓度来克服耐药性的主要策略[12]。新的证据表明,FoxM1水平升高会促进癌症的进展,并与人类癌症的多种侵袭性和化疗耐药性有关[13]。本课题组自2007年起即开展FoxM1的研究工作,结合噬菌体随机肽库筛选,获得了多条对FoxM1蛋白有高亲和力的结合肽[10]。前期研究发现,P201多肽可通过显著下调FoxM1的表达从而对肝癌细胞产生选择性杀伤作用。同时裸鼠肝癌HepG2细胞移植瘤模型结果显示,P201(60.0 μg/mL)处理后FoxM1下调,但5FU化疗药对肝癌移植瘤模型中FoxM1的表达不敏感[11]。文献报道,FoxM1的过表达往往与肿瘤细胞的化药耐药有关,这也可能是部分癌细胞对5FU产生耐药性的原因[14]。同时,肿瘤细胞的多药耐药是肿瘤治疗中遇到的严重障碍,MDR可以保护癌细胞免受各种结构和功能不同的药物的伤害,是肿瘤化疗中的一个主要问题[15]。
我们通过转录组测序发现9R-P201可直接或间接地调控HepG2细胞中数千个差异表达mRNA和长链非编码RNA(lncRNA),参与了多个癌症相关的生物学过程和信号通路[16]。为此,本研究设计了P201联合化疗药5FU的用药方式,拟通过P201抑制FoxM1在肝癌细胞中的过表达,使肝癌HepG2细胞重新对化疗药5FU产生敏感性。实验结果表明,P201+5FU联合用药处理48 h后,其对HepG2细胞的增殖抑制率均显著高于单独用药,差异极显著。同时,研究发现联合用药对细胞凋亡和迁移的抑制作用显著强于各单独用药,其差异具有统计学意义。为进一步探索P201+5FU联合用药对肝癌细胞的协同杀伤作用及抗耐药分子机制,我们还采用qRT-PCR和Western印迹检测相关耐药基因在mRNA和蛋白水平的表达情况,发现联合用药处理HepG2细胞后FoxM1、mdr1、ABCG2等耐药基因和蛋白显著下调。
图3 加药处理对HepG2细胞增殖及迁移能力的影响(200×)
综上,结合本实验室前期对P201靶向FoxM1抗癌作用机制的揭示,提示P201可能通过对FoxM1/mdr1信号通路的抑制,一方面直接杀伤细胞,同时通过影响和降低mdr1等耐药相关基因的表达,提高肿瘤细胞对5FU的敏感性并可能维持胞内5FU浓度,增强细胞的杀伤作用。本研究为克服肿瘤化疗耐药瓶颈提供了新思路。

图4 qRT-PCR和Western印迹检测加药处理后HepG2细胞相关基因及蛋白的表达

