人转录因子FoxM1B的生物信息学分析
杨潮,戴京,张欣宇,陈慧
赣南师范大学 生命科学学院,江西 赣州 341000
转录因子在真核生物基因转录调控中发挥重要作用,是真核生物基因表达调控的重要手段之一。人叉头框蛋白是一类富含转录因子且广泛分布于多种组织细胞中的蛋白家族,最早在果蝇中被发现。该家族蛋白具有多种生物学功能,在胚胎发育、细胞周期调控和生理代谢中发挥重要作用[1-2]。随着研究的深入,发现叉头框家族成员表达异常与人体多种疾病的发生密切相关,如卵巢疾病、多种恶性肿瘤等疾病[3-4]。
转录因子FoxM1B是叉头框蛋白家族的一员,具有该家族典型的翼状螺旋结构[5]。FoxM1B主要通过招募共激活因子和转录基本因子共同作用来激活相应的靶基因,在细胞的多种生理和病理活动中发挥作用。在细胞增殖中,FoxM1B可与一系列G2和M期相关基因的启动子结合并进行调控,促进细胞周期中各时相的转换[6]。近年来研究发现FoxM1B与癌症的发生发展密切相关,不仅能够促进上皮间质转化(EMT)影响癌细胞的迁移、浸润和转移等过程,还与肿瘤耐药、抵抗化疗和患者预后不良相关[7-8]。因此,转录因子FoxM1B是癌症治疗的潜在靶基因和药物靶标。我们利用生物信息学方法,对人转录因子FoxM1B的基因及其编码蛋白的性质、结构和互作网络进行预测分析,为了解FoxM1B的相关性质和机制提供理论参考依据。
1 材料与方法
登陆NCBI的GenBank数据库检索人(HOMO)的FoxM1B基因,获得其全长基因序列(Gene ID:2305)和氨基酸序列(NP_001230017),并存为FASTA格式,利用表1所列软件进行预测分析。

表1 在线生物信息学软件
2 结果与分析
2.1 人FoxM1B基因序列分析
人FoxM1B基因全长19 475 bp,位于12号染色体,包括10个编码区,分别位于1~236、2631~3179、4909~5060、8402~8593、10635~10763、11757~11801、12404~12473、12661~12836、15744~15857、17493~19475,可编码748个氨基酸残基,相对分子质量为82 742.10,属于亲水性蛋白。
2.2 人FoxM1B基因启动子预测
用3种启动子分析软件对人FoxM1B基因5'侧翼2000 bp序列进行预测,所得结果存在差异(表2)。Network Promoter Prediction分析发现在人FoxM1B基因5'侧翼1543~1593 bp位置存在1个启动子,分值为0.97。FPROM预测表明在1349 bp存在1个启动子,1315 bp存在1个TATA盒。Promoter 2.0则预测出人FoxM1B基因启动子区域有2个,分别位于900和1700 bp,均为临界性预测。
对FoxM1B基因5'侧翼2000 bp进行甲基化CpG岛图谱预测,MethPrimer预测表明在1299~1894 bp存在596 bp的甲基化CpG岛,EMBOSS预测出长度为613 bp的甲基化CpG岛位于1331~1943 bp(图1)。2种软件预测的甲基化CpG岛位置存在重叠,所以本次启动子预测结果具有一定的准确性。

表2 人FoxM1B基因启动子预测
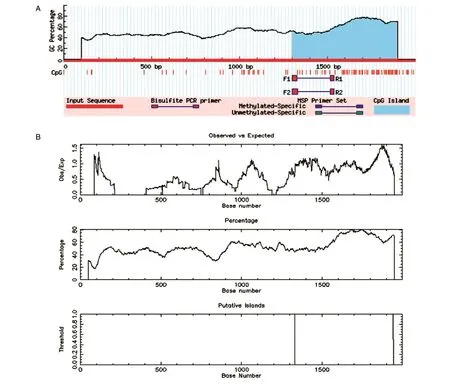
图1 FoxM1B基因甲基化CpG岛图谱
2.3 人FoxM1B蛋白一级结构预测
由于外显子剪接的不同,FoxM1基因产生了3个不同的亚型FoxM1A、FoxM1B和FoxM1C,其中只有FoxM1B、FoxM1C具有转录活性,而FoxM1A因会导致活性区域的断裂而不具有转录活性。研究多集中于FoxM1B,对转录因子FoxM1B的分析将有助于更好地理解人体中的基因表达调控过程及其相应的作用机制,进而为癌症的研究和治疗提供新的理论依据和方案。Protparam预测人FoxM1B蛋白的理化性质见表3。
2.3.1 FoxM1B蛋白亲疏水性分析 Protscale计算FoxM1B蛋白质亲疏水性分布图,结果如图2。用Hphob/Kyte&Doolittle算法分析,横坐标示氨基酸位置,纵坐标示标度得分,<0表示亲水,>0表示疏水,结果显示亲水性肽段分布于整个氨基酸序列,且亲水性肽段明显多于疏水性肽段。总体分析而言,转录因子FoxM1B亲水性氨基酸较多,由此推测此蛋白为亲水性蛋白。Protparam预测结果显示其蛋白平均疏水指数为-0.616,说明也有一定数量的疏水性氨基酸,这些氨基酸通过疏水作用聚集到蛋白质颗粒的中间部位,亲水部位则分布在外,有利于其在细胞中的稳定性。

表3 人FoxM1B蛋白理化性质分析表
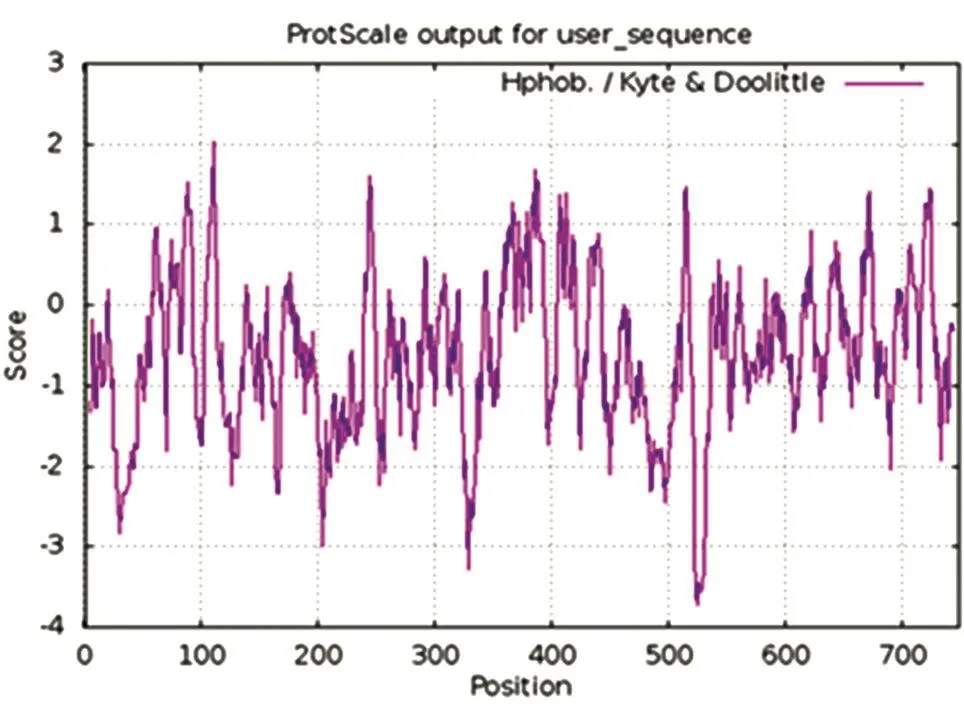
图2 FoxM1B蛋白亲疏水性分析
2.3.2 跨膜区结构预测与信号肽分析 TMHMM 2.0软件分析表明人FoxM1B不含跨膜区,说明其不是跨膜蛋白(图3A)。信号肽是分泌性蛋白质多肽链中用于指导蛋白质跨膜转位的N端氨基酸序列,一般由15~30个氨基酸残基组成。用SignalP 4.1软件对人FoxM1B进行分析(图3B),发现所有氨基酸的C值、S值、Y值均远低于平均值0.5,说明人FoxM1B不含信号肽,为非分泌性蛋白。事实上人FoxM1B作为一个转录因子,需要进入细胞核与DNA相应区域结合进而发挥转录调控的功能,上述预测结果与这一描述在理论上是相符合的。
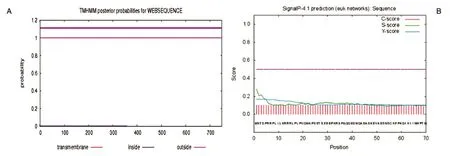
图3 FoxM1B蛋白信号肽和跨膜区预测
2.4 人FoxM1B蛋白二级结构预测
采用SOPMA工具对FoxM1B蛋白的二级结构进行预测分析,结果如图4,不同颜色的竖线表征不同的蛋白二级结构,其中蓝色竖线为α螺旋,红色竖线为延伸链,绿色竖线为β转角,紫色竖线为无规卷曲。FoxM1B蛋白二级结构中含有18.98%的α螺旋、10.56%的延伸链和2.41%的β转角,其余68.05%氨基酸残基均处于无规则卷曲状态。无规卷曲为FoxM1B蛋白的主要折叠形式,而α螺旋占比相对较少,可能不利于蛋白质的稳定。
2.4.1 模体预测 模体(motif)是一种蛋白的二级结构,是蛋白中具有特定空间构象和特定功能的结构成分。用NCBI的Conserved Domain Search Service(CD Search)软件,输入FoxM1B的氨基酸序列,获得该蛋白质的模体预测结果,包含翼螺旋结构(FH)和 herpesvirus_ICP4_C super familiy结构(图5)。翼螺旋结构是其DNA结合区,也是Fox蛋白家族的典型特征。
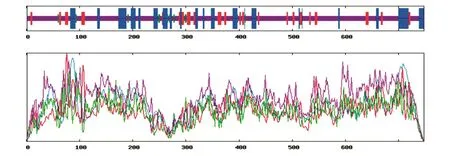
图4 FoxM1B蛋白的二级结构
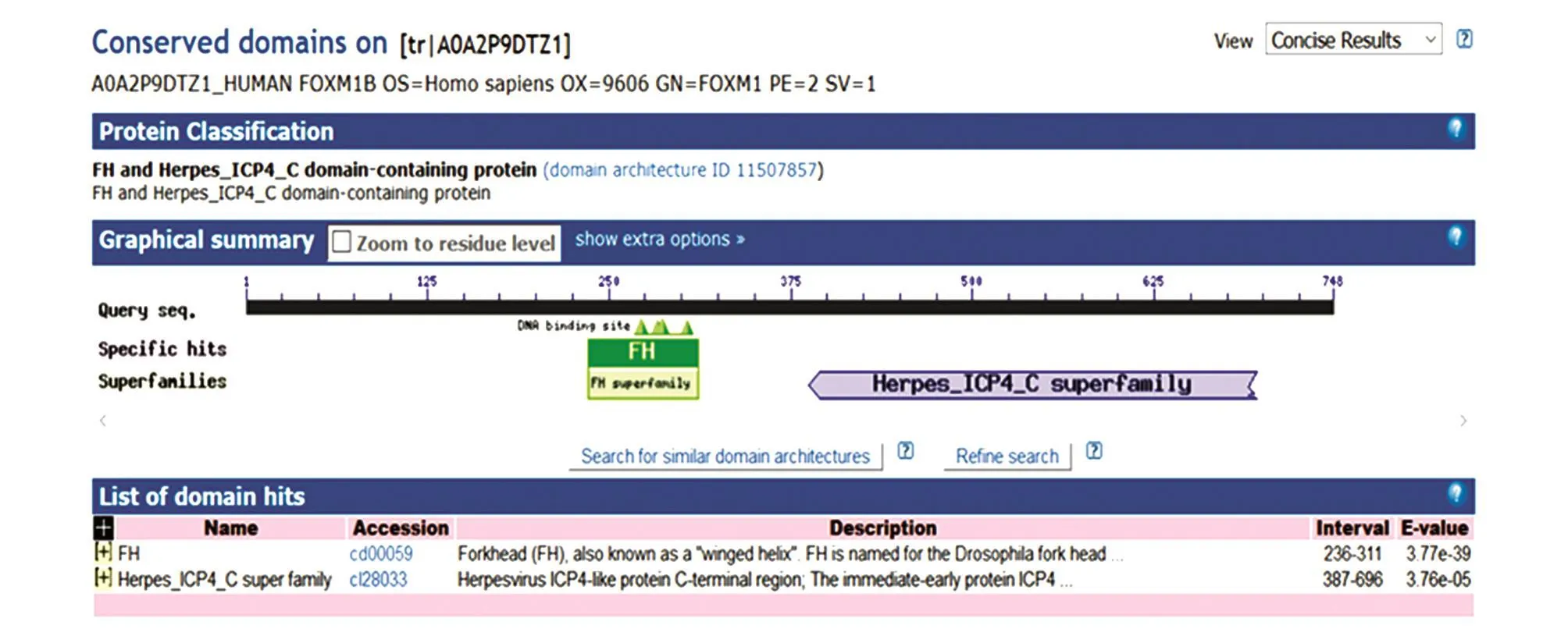
图5 FoxM1B蛋白的模体结构
2.4.2 结构域与蛋白相互作用网络 转录因子在调控基因转录时需要与多种辅助因子相互作用形成复合物共同参与调节,因此分析FoxM1B蛋白互作对指导其功能研究具有重要意义。运用Smart软件预测的FoxM1B蛋白结构域和相互作用网络结果如图6。FoxM1B蛋白234~321位氨基酸残基对应一个FH结构域;FoxM1B与多种蛋白质相互作用,图6给出了得分前10位的相互作用蛋白质。
2.4.3 蛋白信息预测 对FoxM1B蛋白信息预测结果见图7,该蛋白存在9个蛋白结合位点,缺少多核苷酸结合位点,有3个螺旋区域。
2.4.4 蛋白三级结构预测 蛋白质的结构决定其生物功能,因此解析蛋白质高级空间结构有利于对其具体的生物学功能进行分析和理解。运用Swiss-model构建FoxM1B蛋白的三级结构模型,得到3个预测结构模型Model01、Model02、Model03,3个模型的氨基酸序列相似性分别为99.20%、45.83%、43.82%。根据序列相似性的比较,选择Model01作为FoxM1B的三级结构模型进行后续分析,结果如图8。在目标模板对准结合性质的质量估计(Global Model Quality Estimation,GMQE)中,所得分值为0.07,处于合理范围(GMQE:0~1);在综合计分功能的全局分析和局部模型的质量分析估计(Qualitative Model Energy Analysis,QMEAN)中,所得分值为-0.29,表明该模型与实验中所得到的结构具有较好的相似性。在三级结构模型中可以明显看到α螺旋和β转角相对较少,存在大量无规卷曲,预测结果与用SOPMA软件预测的蛋白二级结构性质吻合。
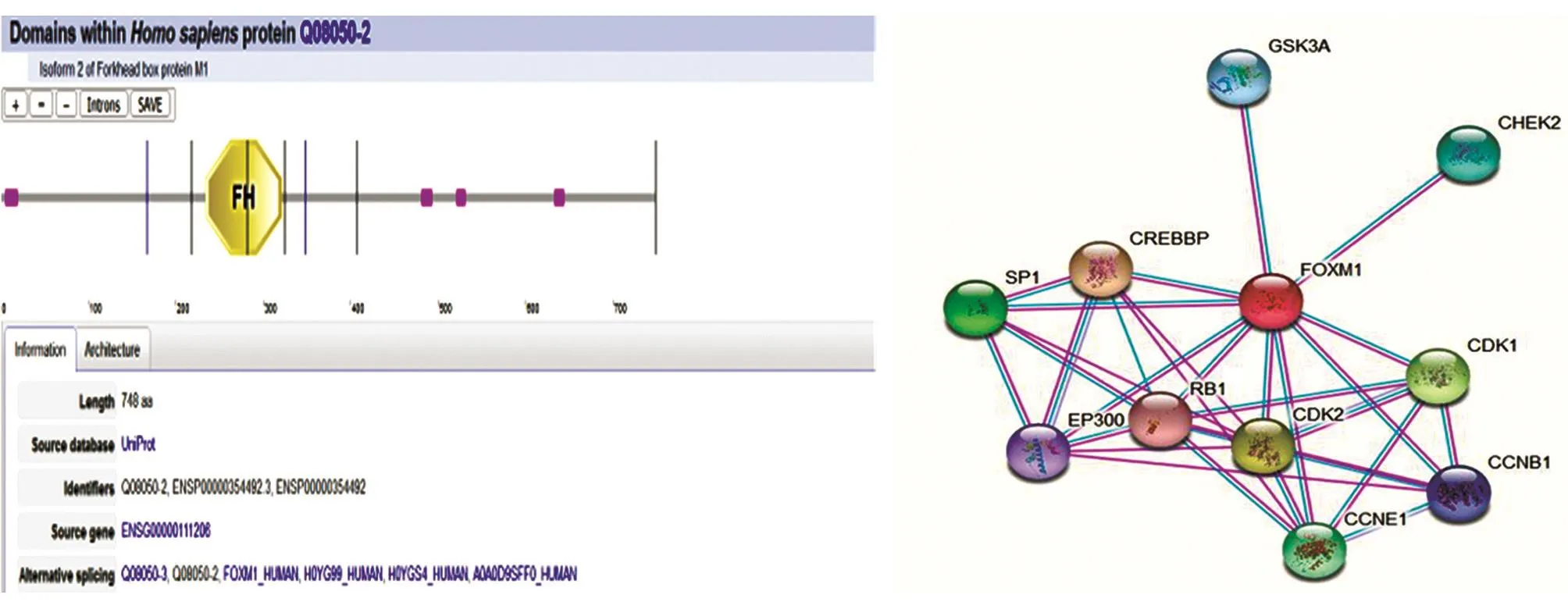
图6 FoxM1B蛋白的功能域预测(A)和相互作用分析(B)

图7 FoxM1B蛋白信息预测
3 讨论
人FoxM1B基因5'侧翼存在转录起始位点及启动子,且启动子的侧翼有1个CpG岛。人FoxM1B蛋白包含748个氨基酸残基,理论等电点8.57,脂肪系数75.24,半衰期30 h,不稳定系数77.76超过40,总平均疏水性-0.616为负值,表明该蛋白是一种不稳定的亲水性蛋白。二级结构预测表明FoxM1B蛋白既无信号肽,又无跨膜区域,存在9个蛋白结合位点,缺少多核苷酸结合位点,有3个螺旋区域,无规则卷曲为其主要折叠形式。运用Swiss-model构建FoxM1B蛋白的三级结构模型,表明该蛋白含有1个FH结构域,并可能与一些蛋白存在物理性的相互作用。
目前对于FoxM1B的功能研究多集中于癌症。研究发现FoxM1B在多种恶性肿瘤细胞和临床样本中高表达[9-10],并且通过促进Wnt/β-catenin信号通路活化、抑制细胞周期蛋白依赖性激酶抑制剂等多种途径,影响周期蛋白或周期蛋白依赖性蛋白激酶的活性,还可通过生长激素来促进癌细胞的增殖,进而诱发肿瘤的恶性生长[11-12]。FoxM1B还被发现可调控上皮标志物(E-cadherin)和间质标志物(Snail、N-cadherin、Slug)的表达,促进肺癌细胞发生上皮间质转化,进而促进癌细胞的侵袭和转移,在肿瘤的发生和发展中具有重要意义[13-15]。此外还有研究报道FoxM1B能够促进Rad51的表达进而增加肿瘤细胞的耐药性和化疗抵抗,成为患者预后差的一个主要因素[8,16]。越来越多的研究表明FoxM1B可以作为癌症治疗的靶点,因此研发FoxM1B的抑制剂成为治疗癌症的有力手段。
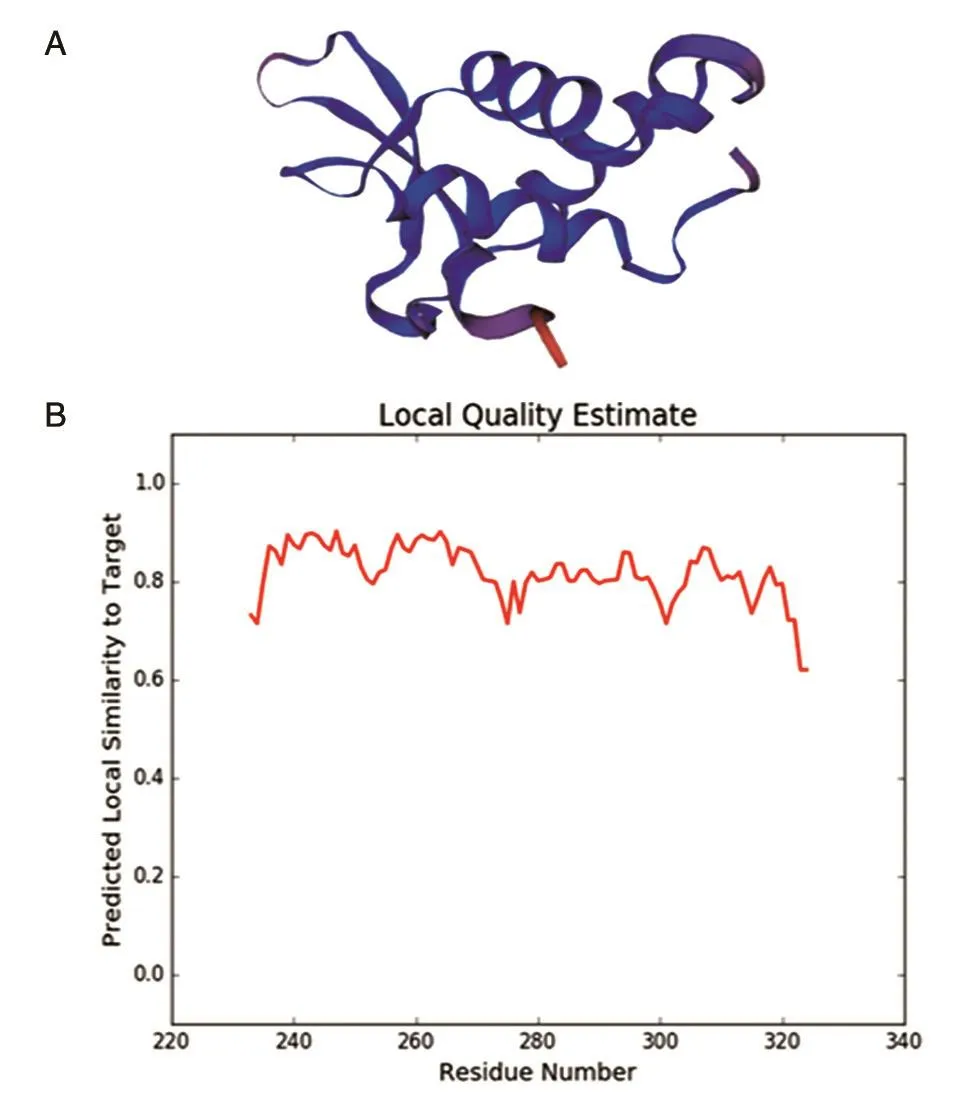
图8 FoxM1B蛋白的三级结构预测
本研究从人FoxM1B基因序列出发,通过生物信息学方法预测分析了人FoxM1B蛋白的性质、结构与功能特征。该部分的工作为进一步探索人FoxM1B的生物学功能提供了一定的依据和线索,奠定了重要的信息基础。

