基于转录组测序探索创伤弧菌MO6-24/O小RNA
周亚男,李宗城,张晓彤,胡成进,应晓敏,曹源
1.潍坊医学院 医学检验学系,山东 潍坊 261053;2.解放军第九六〇医院 实验诊断科,山东 济南250031;3.解放军总医院第五医学中心南院区 肿瘤学研究室,北京 100071;4.军事医学研究院军事认知与脑科学研究所,北京 100850
创伤弧菌(Vibrio vulnificus)是一种嗜温嗜盐的革兰阴性弧菌,外型为棒状或弧状,兼性厌氧,广泛分布于河海交界处。它属于机会致病菌,主要有2种感染途径:一是经口感染,比如生食带菌食物等,可导致败血症或菌血症,病死率高达50%;二是经皮肤伤口感染,主要是开放性伤口接触带菌物体等,可导致骨髓炎、蜂窝织炎和败血症等,如治疗不及时,易导致患者截肢或死亡[1]。在中国,创伤弧菌的致死率为18%~56%[2-3]。因此,探讨创伤弧菌的致病机制,对于预防和感染后的治疗是非常必要的。
细菌小 RNA(small RNA,sRNA)是长度为40~500核苷酸(nt)的非编码 RNA(non-coding RNA,ncRNA),主要位于基因间、编码基因5'与3'非翻译区(untranslated regions,UTR)等,可通过与RNA碱基配对或靶向蛋白质发挥功能[4]。研究发现,sRNA参与细菌转录调控、RNA加工、RNA修饰、mRNA稳定和翻译、蛋白质降解、质粒复制以及细菌感染等过程[5-7],且对于细菌维持体内平衡和适应生长变化的能力至关重要[8]。根据其主要调节机制,可将sRNA分为5类:调节蛋白质活性的 sRNA、顺 式 编 码 sRNA(antisenseRNA,as-RNA)、反 式 编 码 sRNA(trans-encodedsRNA,trans RNA)、5'UTR调控元件,以及CRISPR/Cas系统[9]。调控过程通常涉及伴侣蛋白Hfq(host factor for QB)和 Csr(carbon storage regulator)A[10],这些蛋白参与sRNA与靶mRNA的相互作用、mRNA翻译或RNA衰变过程。它们可以通过结合起始靶位点、隔离核糖体备用位点或者利用RNA酶促进mRNA降解来抑制翻译,还可通过暴露隔离的核糖体结合位点或掩蔽核糖体切割位点来保护mRNA从而激活翻译[11]。因此,在研究功能之前,细菌sRNA的确定和验证是至关重要的。
随着高通量测序和生物信息学的发展,基于ncRNA基因的全基因组定位及生物信息学方法被广泛用于预测原核生物中的sRNA,随后通过实时荧光定量PCR(RT-PCR)和Northern印迹等方法进行验证[12]。研究表明,创伤弧菌MO6-24/O株基因组由2条圆形染色体组成,大小为5.01 Mb,GC含量为47%,注释基因4701个,编码蛋白4562个。染色体1包含2980个编码序列(coding sequence,CDS)、8个16S-23S-5S rRNA操纵子拷贝和100个tRNA;染色体2包含1582个CDS、1个rRNA操纵子和11个tRNA[13]。我们采用转录组测序技术(RNA sequencing,RNA-seq)识别创伤弧菌MO6-24/O的sRNA,并通过RT-PCR进行验证。
1 材料和方法
1.1 材料
创伤弧菌MO6-24/O株由韩国首尔国立大学Sang Ho Choi教授惠赠;海洋培养基2216E购自青岛海博生物公司;总RNA提取试剂盒购自天根生化科技(北京)有限公司;创伤弧菌sRNA建库及测序由武汉生命之美科技有限公司完成。
1.2 细菌培养及RNA提取
将创伤弧菌的过夜培养物按1∶100稀释于1 L海洋培养基中,在20℃摇床上使细胞生长至静止期,通过D600nm值测量生长。第1个样品在2 h(指数生长早期,D600nm=0.18)时收集,然后每2 h收集一次,直至进入静止期(12 h,D600nm=1.91)。每次取样后将-20℃的7 mL 100%乙醇加入7 mL细菌培养物中以防RNA降解。4℃离心后,将细胞沉淀保存于-80℃,直至RNA制备。
将上述样品进行总RNA提取,然后用Smartspec Plus分光光度计(BioRad公司)测定D260nm/D280nm值,用1.5%琼脂凝胶电泳验证RNA的完整性,以保证用于转录组测序的样品RNA合格。
1.3 转录组建库及测序
将每个样品的10 μg总RNA用于RNA-seq文库制备。先用RiboMinus rRNA depletion kit(Ambion公司)去除rRNA,然后制备RNA-seq文库,用Hiseq 2000测序仪进行100 nt双端测序。
1.4 转录组数据分析
去掉接头序列和低质量reads,得到有效序列。用bowtie容2-nt的错配比对到创伤弧菌参考基因组中(ftp://ftp.ncbi.nlm.nih.gov/genomes/Bacteria/Vibrio_vulnificus_MO6_24_O_uid62243/),然后从每一个样品中检出基因数,最后检测reads在基因组不同区域的分布和覆盖度,用RPKM(reads per kilo base of a gene per million reads)[14]分析基因表达量。
2 结果
2.1 通过测序获得数据
为了接近自然生长条件,我们用海洋培养基在20℃条件下培养创伤弧菌MO6-24/O株。由于许多调控RNA只在特定条件下表达,我们收集了创伤弧菌生长过程中从早期指数增长期到静止期6个不同时间点的菌液,并对提取的总RNA样品进行ncRNA高通量测序和mRNA高通量测序,对每个基因的mRNA表达量进行分析。

图1 创伤弧菌MO6-24/O基因在染色体上的分布及表达
总RNA建库和高通量测序分析显示,样品大片段测序量为400万reads,Clean比例大部分在60%左右;样品小片段测序量为1612万reads,Clean比例大部分在84%左右,说明测序数据质量较好。染色体1和2共14 087 240 reads,能够匹配到基因组的共12 927 465 reads,定位在染色体1的有10 031 702 reads,定位在染色体2的有2 410 348 reads。染色体1的长度为3 194 232 nt,染色体2的长度为3 194 232 nt。见表1。
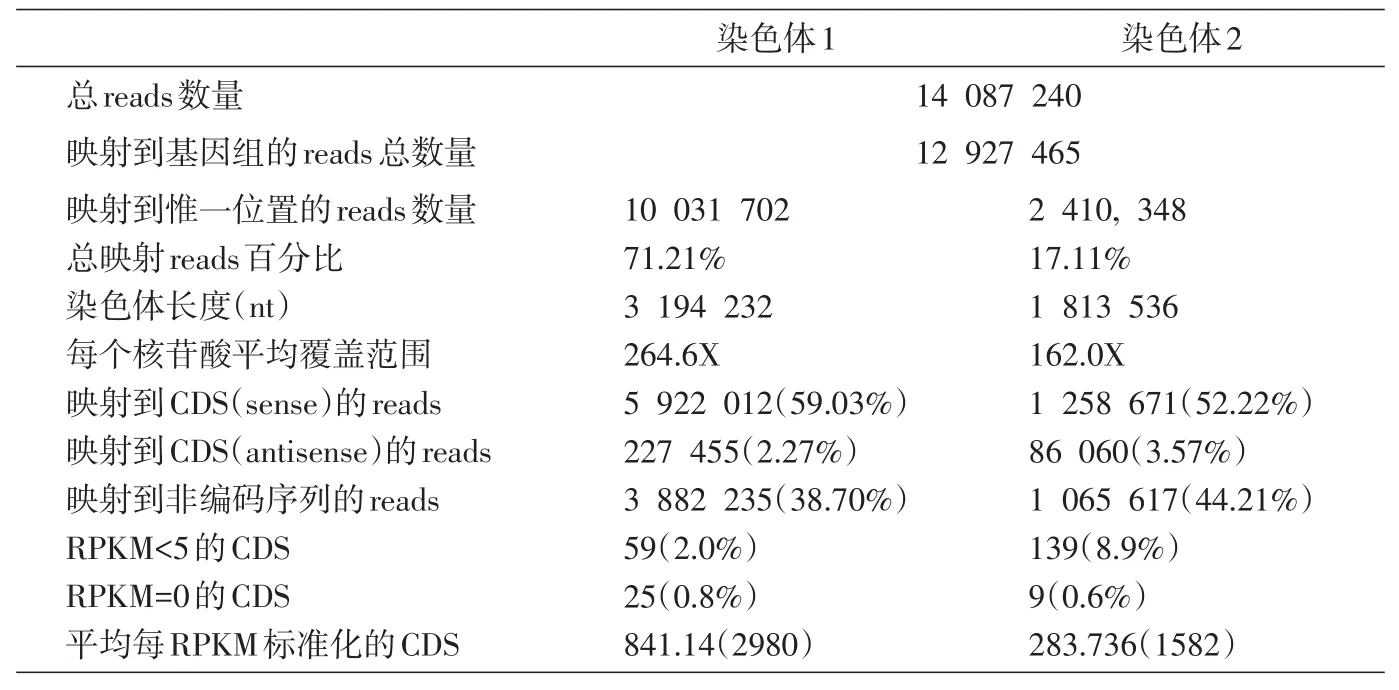
表1 转录组测序组装结果
2.2 2条染色体具有不同的表达水平
表1显示,染色体1每个核苷酸的平均覆盖度是染色体2的1.63倍,表明在我们的检测条件下,染色体1的表达量高于染色体2。在2条染色体中,定位到注释基因序列的reads均大于非编码序列。但是,染色体1中定位到带注释序列的reads略高于染色体2,而定位在非编码序列的reads略低于染色体2。只有2.27%(染色体1)和3.57%(染色体2)的reads定位在顺式编码序列。另外,基因表达水平采用RPKM值标准化,染色体1和2的RPKM值等于零的CDS分别为0.8%和0.6%,小于5的CDS分别为2.0%和8.9%。
2.3 ncRNA的预测
分析结果显示,总共获得了2725个反转录产物,我们将reads聚类到可能的转录本中,并将这些聚类划分为与可能的调控RNA相对应的3类,即trans RNA、5'UTR调控元件和asRNA。最后共发现102个trans RNA、1431个5'UTR调控元件和59个asRNA。图2表示细菌sRNA在基因组上的位置。
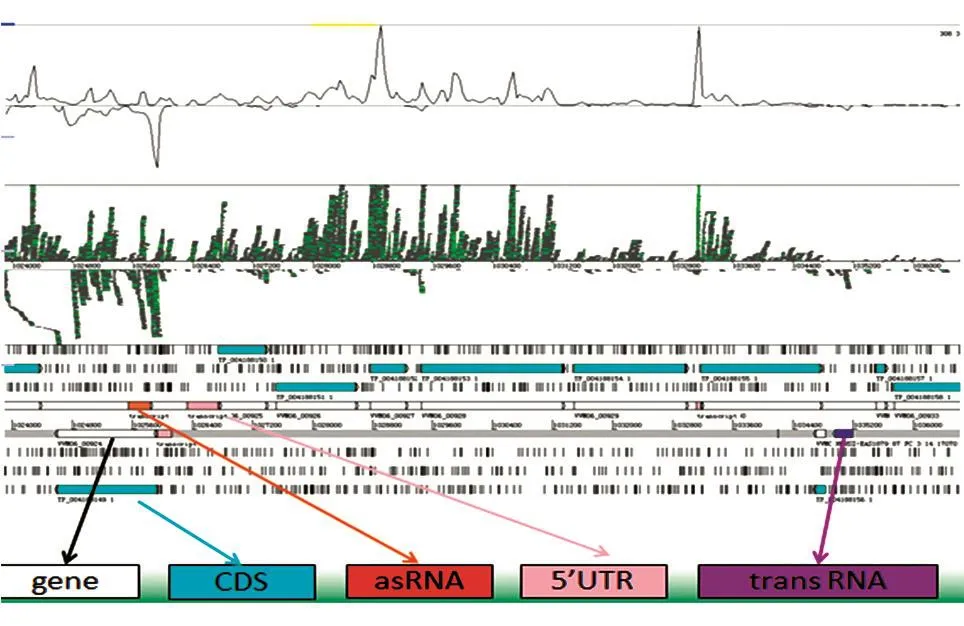
图2 细菌sRNA在基因组上的位置
2.4 5'UTR调控元件的鉴定
分析发现MOCO_RNA_MOTIF、赖氨酸核糖开关和甘氨酸核糖开关为5'UTR调控元件。而且在3个时间点,MOCO_RNA_MOTIF、赖氨酸核糖开关和甘氨酸核糖开关在2 h均表达较高,6 h表达最低,10 h表达仍较低,表明这些sRNA在进入静止期后均表达较少(图3A)。RT-PCR结果显示2、6、10 h时 MOCO_RNA_MOTIF 均 为 100~200 nt,菌液D600nm值分别为0.6、1.7、2.4(图3B)。
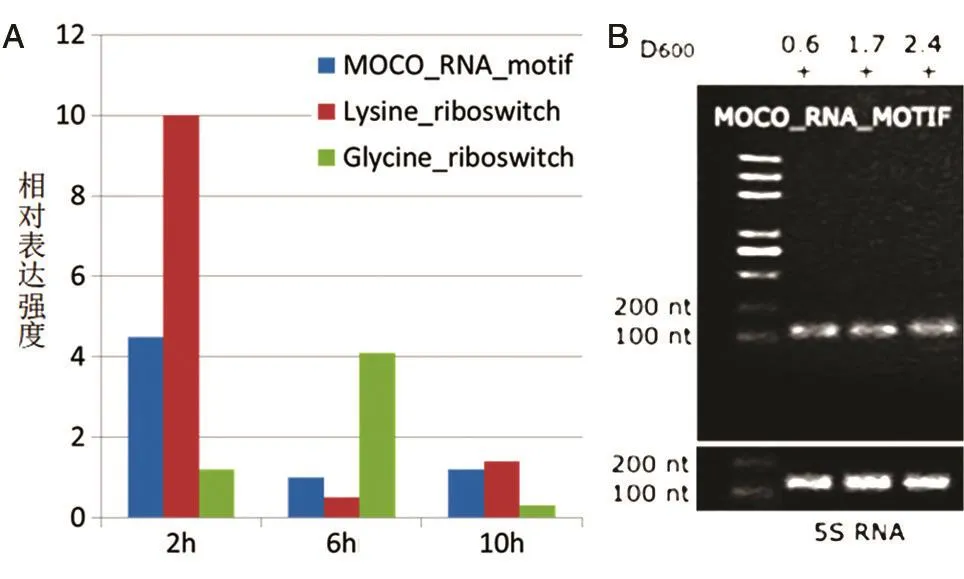
图3 RT-PCR验证3个时间点5'UTR调控元件
2.5 4种CsrB sRNA的鉴定
经鉴定,创伤弧菌有4种CsrB sRNA,均为trans RNA,分别为CsrB1、CsrB2、CsrB3、CsrB4,它们的基因定位见图4A。RT-PCR结果显示3个时间 点(2、6、10 h)CsrB1、CsrB2、CsrB3、CsrB4 sRNA的大小为300~500 nt(图4B)。
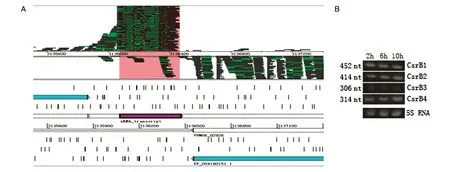
图4 trans RNA验证
2.6 asRNA的鉴定
本研究鉴定出的asRNA VVR19与VVMO6_00972碱基互补,而VVMO6_00972有可能是一个膜蛋白(图5A),通过TMHMM跨膜蛋白预测程序发现后者有9个跨膜域(图5B)。
3 讨论
近年来,创伤弧菌引发的疾病对人类造成了极大影响,但其生物学、基因学、毒力能力和流行病学相关的许多方面仍在探索中[15]。本研究中我们通过对创伤弧菌转录组测序分析揭示了创伤弧菌MO6-24/O基因组中sRNA的重要性,鉴定了59个asRNA、102个trans RNA和1431个5'UTR。
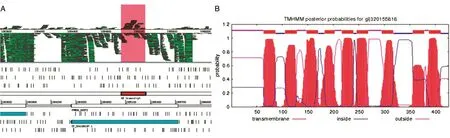
图5 asRNA的鉴定
天然存在的asRNA是可以在特定互补区域与靶mRNA配对的小分子。它可以通过抑制引物成熟、阻止激活因子RNA形成、影响mRNA降解从而调控质粒拷贝数,或者通过转录衰减、抑制翻译等影响细胞功能[16]。例如,MucD_AS作为铜绿假单胞菌的asRNA可以调节MucD基因表达以及诱导生物膜形成[17]。在本研究中,我们发现创伤弧菌MO6-24/O株中asRNA VVR19的表达从指数生长期开始逐步增高,到静止期后减弱,这表明在MO6-24/O株指数生长过程中asRNA VVR19可能发挥重要作用,但其具体调控机制仍须进一步探索。
此外,García等报道,从副溶血弧菌中鉴定出的3种CsrB sRNA基因表达增加可能与更快碳代谢相关[18]。在大肠杆菌中,CsrB sRNA是CsrA的拮抗剂,CsrA是碳存储的核心要素,其抑制糖原合成、分解代谢和糖异生等[19]。因此我们猜想从创伤弧菌MO6-24/O株中鉴定出的4种CsrB sRNA可能与其碳代谢相关。
核糖体开关可以控制氨基酸、核苷酸、金属离子等多种基因。近年来,许多经典的核糖体开关相关机制被报道,例如在单核细胞增生李斯特菌中发现2种维生素B12结合核糖体依赖机制可以控制丙二醇和乙醇胺分解代谢。另外,核糖体开关SreA和SreB已被证明具有反式功能,可以控制PrfA表达。PrfA是单核细胞增生李斯特菌毒力因子表达的主要调节因子,核糖体开关SreA和SreB可与PrfA的5'UTR结合,降低PrfA转录物稳定性或mRNA翻译,以控制PrfA表达,从而控制单核细胞增生李斯特菌的毒力[20]。因此,本研究鉴定出的创伤弧菌MO6-24/O株核糖体开关可能与毒力调控相关,并且在指数生长早期相对表达最强,这可能是因为在指数生长早期创伤弧菌MO6-24/O株的毒力最强,需要更高水平的核糖体开关来控制毒力表达。

