白念珠菌氧化应激机制的研究进展
胡婵 曹智 吴煜昊 张国龙 王秀丽
(上海市皮肤病医院光医学治疗科,上海 200433)
健康宿主抵御白念珠菌的第1道防线是依赖巨噬细胞和中性粒细胞等吞噬细胞的吞噬作用。吞噬细胞通过呼吸爆发产生一系列活性氧(ROS),包括过氧化氢(H2O2)等[1],诱导白念珠菌发生程序性细胞死亡[2];相反,白念珠菌也可通过增加抗氧化基因表达量、诱导菌丝形成、激活相应的氧化应激通路等机制来抵御ROS的氧化损伤。病原菌耐受ROS等氧化物质能力的增强可能会导致其形成免疫耐受,使感染难以控制。近年来,对于白念珠菌如何逃避氧化应激损伤得到了广泛的关注和研究。
1 ROS对白念珠菌蛋白质、脂类和核酸的损伤效应
ROS与蛋白质、脂类和核酸相互作用[3],对病原体造成不可逆的损害。ROS引起的DNA损伤包括化学结构的改变、单双链的断裂与交叉连接。氧自由基反应引起的脂质过氧化可导致细胞膜的损伤。ROS与蛋白质的相互反应导致蛋白质交联、肽链氧化以及氨基酸侧链可逆或不可逆的氧化。另外ROS在吞噬细胞内还可以转化成其他的毒性化合物[4]。如H2O2能在髓过氧化物酶(MPO)的作用下与氯离子(Cl-)反应形成次氯酸(HOCl)。此外,由一氧化氮合酶(iNOS)诱导产生的氧化氮自由基与超氧化物相互作用,产生剧毒的过氧亚硝酸盐(ONOO)[5]。
2 白念珠菌对ROS的反应
2.1 白念珠菌对ROS的转录应答
ROS可诱导真核生物编码mRNAs,合成抗氧化应激蛋白和修复蛋白。当暴露于H2O2时,白念珠菌可以诱导抗氧化基因[6-7],包括编码过氧化氢酶(Cat1),谷胱甘肽过氧化物酶(Gpx)和超氧化物歧化酶(Sod)的基因,也包括编码谷胱甘肽/谷氧还蛋白(Gsh1,Trr1)的基因和硫氧还蛋白系统(Tsa1,Trx1,Trr1)基因,它们在修复氧化损伤、蛋白折叠与硫代谢中起着至关重要的作用。
2.2 高渗应激可抑制白念珠菌对ROS的反应
除ROS以外,吞噬细胞也通过产生阳离子K+以及超氧阴离子等高渗状态来抵抗白念珠菌[5,8-9],高渗应激还可抑制白念珠菌的氧化应激反应,这种现象被称为“应激通路干扰(stress pathway interference)”[10]。在H2O2单独作用下,白念珠菌的抗氧化关键基因,如CAT1和TRR1表达明显增加,然而如果有H2O2和高渗应激双重作用时,以上基因则不能正常表达。
2.3 白念珠菌特有的适应机制——细胞外抗氧化酶
白念珠菌对ROS的耐受性可能与SOD家族有关,白念珠菌在细胞表面表达SOD等抗氧化酶,其中包括分布在不同部位的6种SOD酶。Sod1-3是细胞内酶,Sod4-6是抗糖基磷脂酰肌醇(GPI)锚定于细胞壁的相关酶。白念珠菌被吞噬后诱导产生含有铜或锌的Sod,可抵抗巨噬细胞的杀伤作用[11]。
2.4 ROS对白念珠菌形态的改变
在吞噬作用后,白念珠菌可以从出芽态转变为菌丝态,以逃避巨噬细胞和中性粒细胞对其的氧化损伤,菌丝可以穿透吞噬体膜[12],甚至可以杀伤吞噬细胞[13]。ROS可以诱导精氨酸合成基因表达增加,对白念珠菌被吞噬后的菌丝形成至关重要[14]。某些对ROS异常敏感的突变白念珠菌被吞噬后,不能形成菌丝,无法抵御吞噬细胞的杀伤作用。
3 ROS对白念珠菌信号通路的影响
目前已知ROS可激活白念珠菌的3种信号通路:包括Cap1通路、Hog-MAPK通路和Rad53(DNA损伤检验点)通路。
3.1 Cap1通路
Cap1与酿酒酵母的Yap1和粟酒裂殖酵母的Pap1高度同源,Yap1和Pap1在氧化应激和多药耐药中的作用是非常明确的[14-15]。白念珠菌的cap1⊿菌株也被证实对ROS和药物非常敏感[16-17]。CAP1的下游基因包括关键的抗氧化基因TRX1和耐药基因MDR1[18]。
Cap1的调控机制 与酿酒酵母Yap1类似,H2O2可以使白念珠菌的Cap1在细胞核内迅速累积[17,19]。在非应激条件下,位于转录因子C段的Crm1核输出因子,可以使Cap1穿梭于细胞质和细胞核之间。在H2O2的作用下,Cap1结构发生改变,从而阻止Cap1和Crm1的相互作用,Cap1在核内大量积聚、磷酸化,并诱导抗氧化基因的表达。Cap1的激活可以被硫氧还蛋白(Trx1、Trx2)抵消[20]。另外,白念珠菌的Cap1氧化过程需要Gpx3(一种类似谷胱甘肽过氧化物酶的酶)[19];Gpx3介导的Cap1氧化反应还需要Ybp1蛋白,Ybp1与Cap1相结合形成复合物[19,21](见图1)。
Cap1对毒力的影响 缺失CAP1或其调控因子GPX3和YBP1基因,会使白念珠菌的毒力有所减弱。CAP1、GPX3或YBP1突变株被吞噬后无法形成菌丝[19]。CAP1可以诱导TRX1的表达,对于白念珠菌的生存至关重要[20,22]。
3.2 Hog-MAPK通路
Hog-MAPK信号转导通路广泛存在于真核细胞内,可以提高细胞适应周围环境的能力[23]。它们是由保守的三级激酶级联系统构成:MAPKKK(Ssk2)-MAPKK(Pbs2)-和MAPK(Hog1)。暴露于H2O2的白念珠菌,上游信号(Sln1等)促使磷酸基团由MAPKKK向MAPK逐步传递,Hog通路被激活,最后磷酸化的Hog1发生核转位进入细胞核内,调控基因转录,从而使细胞可以耐受氧化应激压力[7](见图2)。缺乏Hog1的白念珠菌对ROS敏感性增加,表明Hog1激活是白念珠菌氧化应激反应的重要组成部分[24-25],而且只有相对高浓度的H2O2才能激活Hog1。
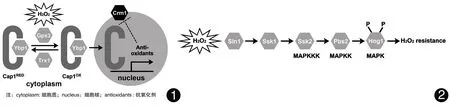
图1H2O2促进白念珠菌Gpx3 / Ybp1介导的氧化反应,激活Cap1转录因子(Cap1RED→Cap1ox)。Cap1ox不再与核输出因子Crm1相互作用,导致Cap1在核内积聚,激活 Cap1依赖的抗氧化应激的基因,保证细胞的存活。经过细胞自身调整,Cap1ox又可以在Trx1的调控下转化为失活状态(Cap1RED)。图2H2O2激活Hog-MAPK通路。上游信号(Sln1等)促使磷酸基团由MAPKKK向MAPK逐步传递,Hog通路被激活,最后磷酸化的Hog1发生核转位进入细胞核内,调控基因转录,使细胞可以耐受氧化应激压力。
Fig.1H2O2promoted Gpx3/Ybp1-mediated oxidation ofCandidaalbicansand activated the transcription factor Cap1REDto Cap1ox. Cap1oxcould no longer interact with the nuclear export factor Crm1, which caused the accululation of Cap1 within the nucleus. Then the expression of Cap1-dependent anti-oxidative stress genes were up-regulated, ensuring the survival of the organism. As a strategy for homeostasis, Cap1oxcould be transformed into inactive state (Cap1RED) in the existence of Trx1.Fig.2H2O2activated the Hog-MAPK pathway. The upstream signals such as Sln1 promoted the transferance of phosphate group from MAPKKK to MAPK, then the Hog pathway was activated. Finally, the phosphorylated Hog1 was transferred into the nucleus and regulated the expression of related genes, which allowing theCandidaalbicansto withstand oxidative stress.
Hog-MAPK通路对毒力的影响 在ROS、渗透压和抗菌肽的作用下,白念珠菌的Hog1磷酸化,并且在核内大量积聚[26]。在小鼠感染或其他共生模型中[26-28],缺乏Hog1的白念珠菌,其毒力受到明显抑制,更容易被巨噬细胞或中性粒细胞杀死[29]。因为Hog1调控不同的应激反应,因此很难判断是Hog1通过氧化应激的作用间接影响了毒力,还是Hog-MAPK通路直接参与了毒力的形成。
3.3 Rad53(DNA损伤检验点)通路
暴露于H2O2后,白念珠菌形成超极化芽(hyperpolarized buds)[20]从而逃避吞噬作用,它在形态上不同于菌丝和假菌丝。H2O2诱导的超极化芽的出现,不依赖于菌丝形成的调节因子Efg1和Cph1,而是通过Rad53激活的[30]。遗传毒性压力如紫外线,甲基磺酸甲酯(MMS)和羟基脲,可以激活白念珠菌的Rad53激酶[30],ROS可以造成DNA损伤[31],并触发Rad53 DNA检查点通路的激活[32],引起Rad53磷酸化,形成超极化芽[20]。Rad53缺失或Rad53上游调控子缺失后,则不能生成超极化芽[30]。
3.4 氧化应激相关的其他信号途径
cAMP/PKA信号转导通路对白念珠菌氧化应激有负向调节作用。该通路通过灭活磷酸二酯酶Pde2,降解cAMP,从而导致白念珠菌对H2O2的敏感性增加[33]。法尼醇通过抑制cAMP/PKA信号通路,导致白念珠菌对H2O2的耐受性增强,这一过程可能涉及一系列抗氧化基因表达水平的变化[34]。
4 小 结
白念珠菌氧化应激机制是一个重要的研究领域,对于病原真菌来说,耐受氧化应激是一种重要的毒力,对氧化应激不耐受的白念珠菌,对抵御吞噬细胞的杀伤能力下降。氧化应激可以对白念珠菌产生损伤,但相反白念珠菌也通过各种机制来应对氧化损伤。目前关于白念珠菌的氧化应激及毒力还有很多问题亟待解决,这对于我们理解疾病发展过程中白念珠菌与宿主之间的相互作用至关重要,同样氧化应激也可能成为新型抗真菌药物的作用靶点。

