萘普生片溶出曲线相似性评价及体内外相关性研究
唐婉,尹菁,张圆,石蓓佳,李攀,3,陆益红,樊夏雷
(1.徐州医科大学药物分析教研室,徐州 221004;2.江苏省食品药品监督检验研究院,南京 210009;3.中国药科大学,南京 210009)
仿制药质量差异直接影响药物安全性和有效性。2017年2月,国务院正式发布《“十三五”国家药品安全规划》,将一致性评价列入产品质量升级工程,其重要性已经上升到国家战略层面[1]。临床推广使用仿制药的前提,是仿制药必须与指定的参比制剂药学等效(pharmaceutical equivalence,PE)和生物等效(bioequivalence,BE),以避免仿制过程中的质量误差。仿制药和原研药在多种不同pH值溶出介质中溶出行为相似性是评价固体口服制剂PE的重要组成部分,也是对口服固体制剂内在质量评价的最主要方法[2-3]。体外溶出曲线的拟合可帮助仿制药企业对处方工艺进行筛选与优化[4]。GastroPlusTM软件[5]是一种基于机制性生理模型的药动学、药效学(physiologically based pharmaeokineties/pharmacodynanfics,PBPK/PD)模拟软件,目前已在美国食品药品管理局(FDA)、国家药品监督管理局(National Medical Products Administration)、欧洲药品管理局(European Medicines Agency,EMA)以及全球顶尖制药公司中得到广泛应用,被誉为同类软件中的“黄金标准”。萘普生 (naproxen)为苯丙酸类非甾体解热镇痛药,临床主要用于治疗风湿性疾病、痛风及术后疼痛等[6],属于生物药剂学分类系统(biopharmaceutics classification system,BCS)II类(低溶解性、高渗透性)药物。《中华人民共和国药典》2015年版[7]、《英国药典》(British Pharmacopoeia,BP2017)[8]、《美国药典》(United States Pharmacopoeia,USP40)[9]及日本橙皮书[10]均有收载。其中2015年版《中华人民共和国药典》溶出度项下溶出介质pH值、溶出装置、取样时间、检测波长及限值与日本橙皮书收载方法均有较大差异。笔者对这两种方法进行比较,以便进一步完善现有检测标准。采用GastroPlusTM软件构建萘普生片体内外PK模型,结合体外溶出结果,对各仿制药进行评价研究,为开展仿制药质量和疗效一致性评价提供可以借鉴的思路。
1 仪器与试药
1.1仪器 自动溶出仪(采用针式取样方式,瑞士SOTAX公司),UV-2550型紫外检测器(日本岛津公司),真空脱气机(天大天发科技有限公司)。
1.2试药 磷酸二氢钾(批号:20171209)、磷酸氢二钠(批号:20170306)、冰醋酸(批号:20180118)、氢氧化钠(批号:20160720)以及盐酸(批号:20171214)均为分析纯,均购自国药集团化学试剂有限公司;萘普生对照品(中国食品药品检定研究院,批号:100198-201205,纯度:99.9%)。参比制剂萘普生片[日本田边三菱(Mitsubishi Tanabe Pharma Corporation)公司,批号:B041A,规格:0.1 g];仿制制剂分别为A企业样品(批号:160908),B企业样品(批号:170301),C企业样品(批号:160501),D企业样品(批号:160802),E企业样品(批号:150108),F企业样品(批号:160703),G企业样品(批号:170204),H企业样品(批号:009150502)。8家国产制剂规格均为0.1 g。
2 方法与结果
2.1溶出度测定方法的选择
2.1.12015年版《中华人民共和国药典》与日本橙皮书收载溶出度方法比较 将参比制剂分别按照日本橙皮书 (浆法,转速:50 r·min-1,pH值6.8磷酸盐缓冲液为溶出介质,体积900 mL,检测波长272 nm)和2015年版《中华人民共和国药典》(篮法,转速:100 r·min-1,pH值7.4磷酸盐缓冲液作为溶出介质,体积900 mL,检测波长331 nm)中的溶出度检查方法,测定0,5,10,15,30,45和60 min累积溶出量,以确定更适宜的溶出方法用于本研究,结果见表1。由表1可知,2015年版《中华人民共和国药典》溶出条件较剧烈,在5 min时累积溶出量已达90.81%。日本橙皮书中收载方法更符合药物在体内释放过程[11]。将同一溶出样品分别于272和331 nm波长处测定吸光度值,计算溶出量,采用SPSS16版统计软件对结果进行t检验分析。结果表明,两波长下检测结果差异无统计学意义(P=0.992,>0.05)。272 nm波长处检测时,需对样品进行第二步稀释,该操作可能造成一定误差,为减少操作误差、减轻工作负担,本研究推荐331 nm为检测波长。
表1 两种溶出方法累积溶出量测定结果
Tab.1Resultsofcumulativedissolutionwithtwodissolutionmethods

%
2.1.2pH值-溶解度曲线的测定 取过量萘普生原料药,加入37 ℃溶出介质中振荡过夜,取适量适宜倍数稀释,采用HPLC法[7]测定峰面积,按外标法计算振荡过夜后溶液中萘普生含量,推算萘普生在不同pH值溶出介质中的溶解度(表2)。一般释放介质的体积为药物饱和溶液所需介质体积的至少3倍量时认为满足漏槽条件[2],表2中以3倍计,根据饱和所需介质体积是否小于释放介质体积900/3=300 mL来判断是否满足漏槽条件。
表2结果显示,pH值5.5处于漏槽条件的边缘,随着pH值增高,萘普生溶解度上升显著。pH值6.8、pH值7.4溶出介质满足漏槽条件,萘普生在相同pH值缓冲液中,依磷酸盐、枸橼酸盐、醋酸盐顺序溶解度逐渐增大。
2.1.3溶出曲线测定方法的确定 根据“2.1.1”项溶出度方法比较结果,以及pH值-溶解度曲线测定结果,确定溶出曲线测定方法为浆法,转速50 r·min-1,体积900 mL,检测波长331 nm。同时依据pH值-溶解度曲线测定结果,以及萘普生在体内主要吸收部位,选择以下溶出介质[12]:①pH值6.8磷酸盐缓冲液(取磷酸二氢钾1.70 g和磷酸氢二钠1.775 g,用水溶解并稀释至1000 mL);②pH值6.0磷酸盐缓冲液(0.2 mol·L-1氢氧化钠溶液28 mL,加磷酸二氢钾6.80 g,水溶解并稀释至1000 mL);③pH值5.5醋酸盐缓冲液(2 mol·L-1醋酸溶液3.0 mL,加醋酸钠5.98 g,水溶解并稀释至1000 mL);④pH值1.2盐酸溶液(盐酸7.65 mL,加水稀释至1000 mL);⑤水。
表2 萘普生原料药在不同溶出介质中的溶解度
Tab.2Solubilityofnaproxenindifferentdissolutionmedia
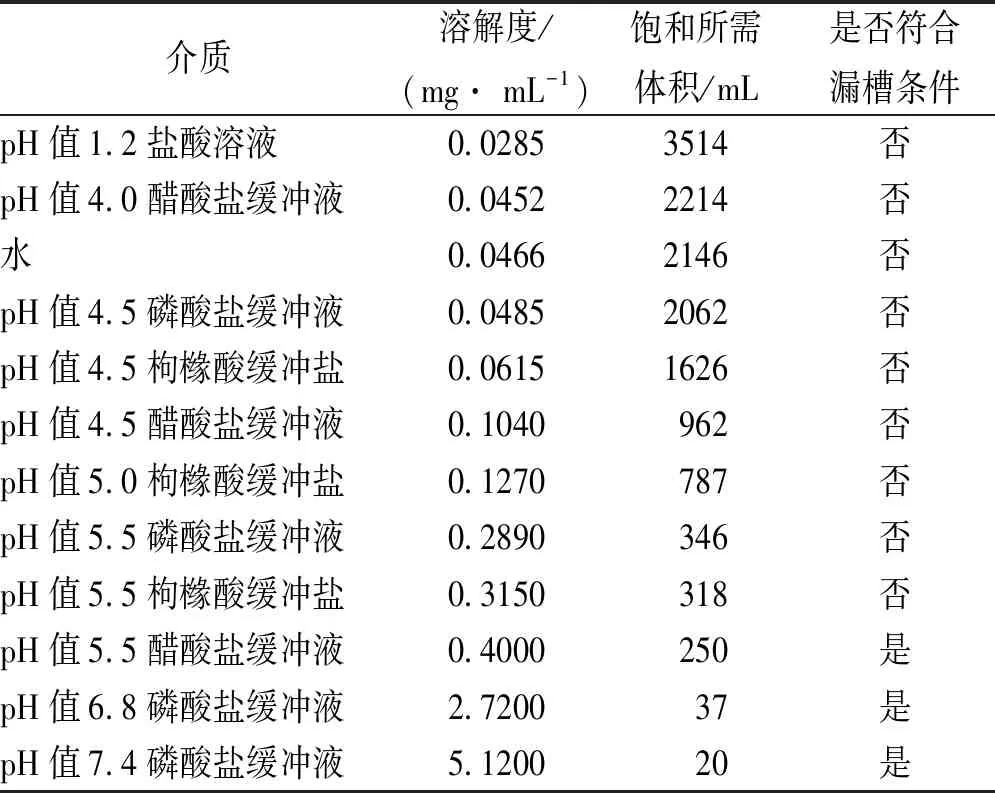
介质溶解度/(mg· mL-1) 饱和所需体积/mL是否符合漏槽条件pH值1.2盐酸溶液0.02853514否pH值4.0醋酸盐缓冲液0.04522214否水0.04662146否pH值4.5磷酸盐缓冲液0.04852062否pH值4.5枸橼酸缓冲盐0.06151626否pH值4.5醋酸盐缓冲液0.1040962否pH值5.0枸橼酸缓冲盐0.1270787否pH值5.5磷酸盐缓冲液0.2890346否pH值5.5枸橼酸缓冲盐0.3150318否pH值5.5醋酸盐缓冲液0.4000250是pH值6.8磷酸盐缓冲液2.720037是pH值7.4磷酸盐缓冲液5.120020是
2.2溶出度测定方法的验证
2.2.1稳定性考察 取萘普生原料药,置溶出杯中,在上述溶出度测定条件下,分别加入上述5种溶出介质(37 ℃),于30,45,60,90,120,240 min取样测定331 nm波长处吸光度,结果表明萘普生在240 min内稳定。
2.2.2线性关系考察 取萘普生原料药105.66 mg,精密称定,置100 mL量瓶,用pH值6.8溶出介质溶解并定容,精密吸取适量,用溶出介质稀释,得21.13,42.26,63.40,84.53,105.66,126.79,149.50 μg·mL-1系列溶液,测定波长331 nm处各浓度溶液的吸光度值,分别为0.1468,0.2904,0.4352,0.5821,0.7165,0.8625,1.0218。线性方程为:Y=0.0068X+0.0037,r2=0.9999。
2.2.3回收率实验 取相当于萘普生片1片的辅料,按比例精密称定,置100 mL量瓶,分别加入适量萘普生对照品,用pH值6.8溶出介质溶解并定容,精密吸取适量,用溶出介质稀释,制成相当于浓度水平为80%,100%,120%的溶液,测定波长331 nm处吸光度,计算回收率。回收率(%)=测得量/称样量×100%。结果见表3,平均回收率99.46%,RSD=0.41%。
2.3溶出曲线的绘制 对8种仿制制剂和参比制剂各取1批,按“2.1.3”项确定的溶出介质和方法进行溶出曲线的绘制。pH值5.5、pH值6.0、pH值6.8介质在5,10,15,30,45,60 min时取样,pH值1.2介质与水中取样点分别延长至120和240 min,每个时间点取样10 mL,及时补液10 mL,计算不同时间点累积溶出量,结果见图1。
表3 pH值6.8溶出介质中萘普生片回收率测定结果
Tab.3ResultsofrecoverytestsonnaproxentabletsindissolutionmediaatpH6.8

n=9
结果表明,参比制剂和仿制制剂在pH值1.2溶出介质和水中尽管均溶出不完全,但溶出速率、累积溶出量仍存在较大差异。参比制剂在pH值5.5、pH值6.0、pH值6.8溶出介质中,10 min时平均溶出率均>85%;8种仿制制剂在pH值5.5、pH值6.0溶出介质中,10 min时平均累积溶出量均<85%;在pH值6.8溶出介质中,仅C厂家制剂在10 min时平均累积溶出量>85%。综合以上结果,8种仿制萘普生片在5种溶出介质中与参比制剂的累积溶出量均存在较大差异。
2.4溶出曲线相似性评价 采用FDA推荐的相似因子(f2)法,分别对pH值6.8、pH值6.0、pH值5.5溶出介质中仿制制剂与参比制剂的溶出曲线进行相似性评价。f2计算公式如下[13]:f2=50*lg { [1+1/n*∑(Rt-Tt)2]-1/2*100}
其中,n为溶出度试验取样点个数;Rt与Tt分别为参比制剂与仿制制剂t时间平均累积溶出量(%)。当两条曲线f2值>50时,可认为溶出曲线相似,且值越大相似度越高。结果见表4。
结果显示,在pH值5.5、pH值6.0溶出介质中8种仿制萘普生片与参比制剂溶出曲线相似因子f2值均<50;在pH值6.8溶出介质中仅有C厂家生产的萘普生片f2值>50。即国内8种萘普生片体外溶出曲线与参比制剂基本不一致。

A.pH值6.8缓冲液;B.pH值6.0缓冲液;C.pH值5.5缓冲液;D.pH值1.2溶液;E.水
表4 不同溶出介质中萘普生片溶出曲线相似性分析结果(f2值)
Tab.4Similarityanalysisofdissolutionofnaproxentabletsindifferentmedia(f2)
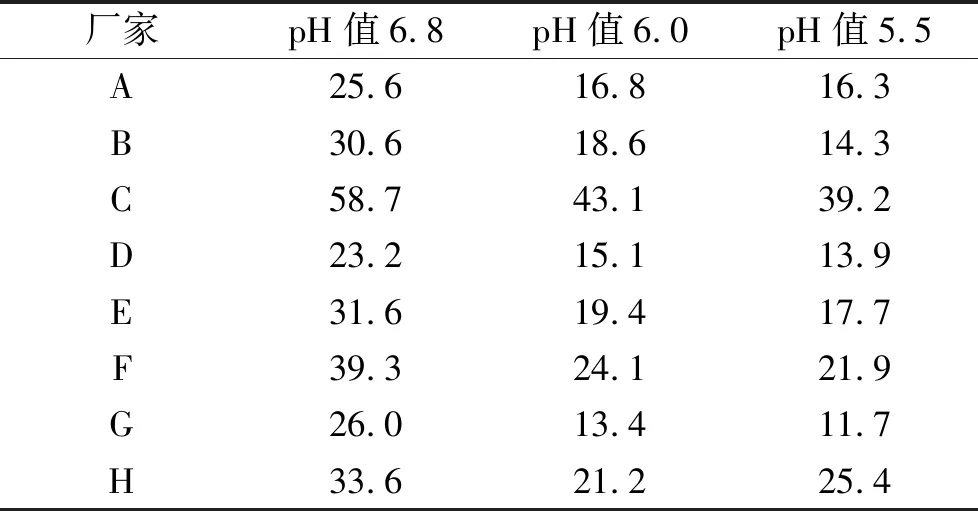
厂家pH值6.8pH值6.0pH值5.5A25.616.816.3B30.618.614.3C58.743.139.2D23.215.113.9E31.619.417.7F39.324.121.9G26.013.411.7H33.621.225.4
2.5GastroPlusTM软件建立萘普生片体内外相关性模拟的研究 收集文献报道的不同给药途径、给药剂量的药动学曲线,以及GastroPlusTM软件基于萘普生化学结构预测的理化参数。主要参数有:logP[14]为3.18,pKa[14]为4.15,溶解度(pH值3.96)为0.0649 mg·mL-1,扩散系数为0.87×105cm2·s-1,粒子密度为1.2 g·mL-1,渗透性为1.461×104cm·s-1,半衰期为12.8 h,血浆清除率为1.249 16 L·h-1,表观分布容积为0.048 94 L·kg-1。
2.5.1萘普生验证性PK模型的构建 在软件吸收和处置模型中加载相应理化参数和静脉注射药-时曲线数据[15],模拟药物体内消除过程,对比预测值与文献收载实测值差异,评估模型预测准确性,通常模型预测的Cmax和AUC值与实际值误差≤2倍、拟合度>0.7即可证明建立的模型较准确[16],拟合度 (R2)越高,模型预测越准确。结果见图2。
图2显示,预测曲线与实测数据点基本重合,PK模型R2达0.976;表明初步建立的PK模型能够较好地反映萘普生给药后在人体内的清除和分布特征。
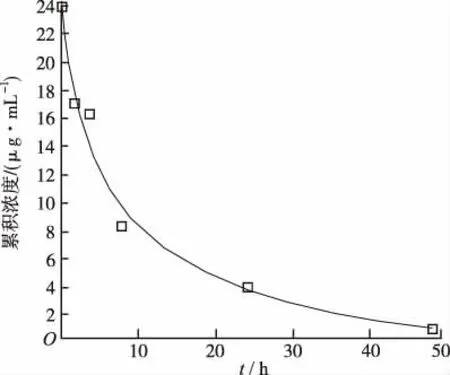
图2 静脉给药PK曲线模拟(曲线)与实测结果(方格)
Fig.2SimulativePKmodel(line)andclinicaldata(squares)ofintravenousadministration
2.5.2口服萘普生500 mg的PK模型验证 由于口服药物在人体胃肠道存在溶出和吸收过程,且处置过程较静脉给药复杂,故用文献收载的萘普生片实测数据[17]对GastroPlus软件预测理化参数和药动学参数进行验证,评估GastroPlus软件模型对口服萘普生给药后预测的准确性(图3)。模型预测参数与实测参数基本吻合,R2达0.980,表明模型溶解、溶出过程的公式以及所应用的相关参数较合理地描述了萘普生相应特征,建立的PK模型可行。

图3 口服萘普生片500 mg PK曲线模拟(曲线)与实测结果(方格)
Fig.3SimulativePKmodel(line)andclinicaldata(squares)oforaladministrationofnaproxenat500mg
2.5.2以pH值6.8为溶出条件预测体内PK曲线 在已验证的模型基础上,将参比制剂及8家萘普生片仿制制剂在pH值6.8溶出介质下的体外溶出数据加载到GastroPlusTM软件,将Dissolution Model设置为Z-factor,软件通过体外溶出曲线计算萘普生Z-factor值,并将溶出曲线转换成体内PK曲线,同实测的体内药时曲线进行对比,结果见图4。
结果表明,除参比制剂外,8家萘普生片仿制制剂的PK模拟曲线同实测数据均存在较大差异,说明8种萘普生片仿制制剂与参比制剂体内过程基本不一致。
2.5.3模拟PK参数比较 结合溶出曲线等信息,利用所建立的PK模型,对不同企业样品以及参比制剂的体内药动学参数进行预测,计算与文献实测曲线的拟合度。
结果表明,除参比制剂所得参数同文献参数基本一致,R2为0.979。8家仿制制剂Cmax、tmax同文献记载参数均存在较大差异,R2均低于0.7。故8家仿制萘普生片与参比制剂PE和BE基本不一致。
3 讨论
萘普生片的原研制剂为FDA认可的0.5 g规格的“Naprosyn”(ATHNAHS PHARMA US LTD),但目前已停产。日本橙皮书公布的萘普生参比制剂为MITSUBISHI Tanabe Pharmaceutical Co.Ltd.(田边三菱公司)“NAIXIN”0.1 g 规格,且与国内多数仿制制剂规格相同,故本研究采用其为参比制剂。目前,已发表的文献中,考察萘普生在多种溶出介质中的溶出行为的研究笔者较少见到,且尚未见探究萘普生片体内外相关性的报道,故本研究可为我国仿制药质量的提升及质量和疗效一致性评价提供可以借鉴的思路。
本研究中,由于参比制剂与8家仿制制剂在pH值1.2和水两种溶出介质中溶出率较低,因此仅对pH值6.8、pH值6.0、pH值5.5三种溶出介质中萘普生片的溶出度数据进行f2计算。由体外溶出曲线可看出,与参比制剂相比,8种仿制制剂溶出速率均较慢,溶出过程中崩散也较慢,故推测其不一致可能由辅料差异和压片工艺造成。
因无法获得参比制剂的体内实测数值,故将参比制剂和8家仿制制剂体外溶出数据在已验证模型基础上预测的体内参数同文献实测参数[16]进行比较。结果发现参比制剂所得参数同文献报道参数基本一致,而8家仿制制剂所得参数与文献报道的存在一定差异,主要表现为Cmax较低,而Tmax较大,考虑是由于辅料的差异导致药物延迟时间存在差异,故影响体内药物的吸收速度和程度。
剖析各家制剂处方工艺,由于萘普生为难溶性药物,参比制剂选用了聚维酮改进活性药物成分(active pharmaceutical ingredient,API)的溶出度,而仿制制剂处方中大多未见增溶辅料。结合一致性评价结果,仿制制剂处方工艺有必要进一步优化,以达到质量和疗效与参比制剂一致。
通过GastroPlusTM软件建立萘普生片的吸收和处置模型,建立仿制药和原研药体外溶出曲线与体内药动学曲线之间的相关性模型是一致性评价工作一种有益的尝试。若药物的体外溶出与体内吸收之间能建立良好的相关性,则可通过体外溶出数据预测药物的体内吸收过程,从而减少BE试验带来的经济负担,并且缩短药物的研发周期,降低制剂生物不等效风险。
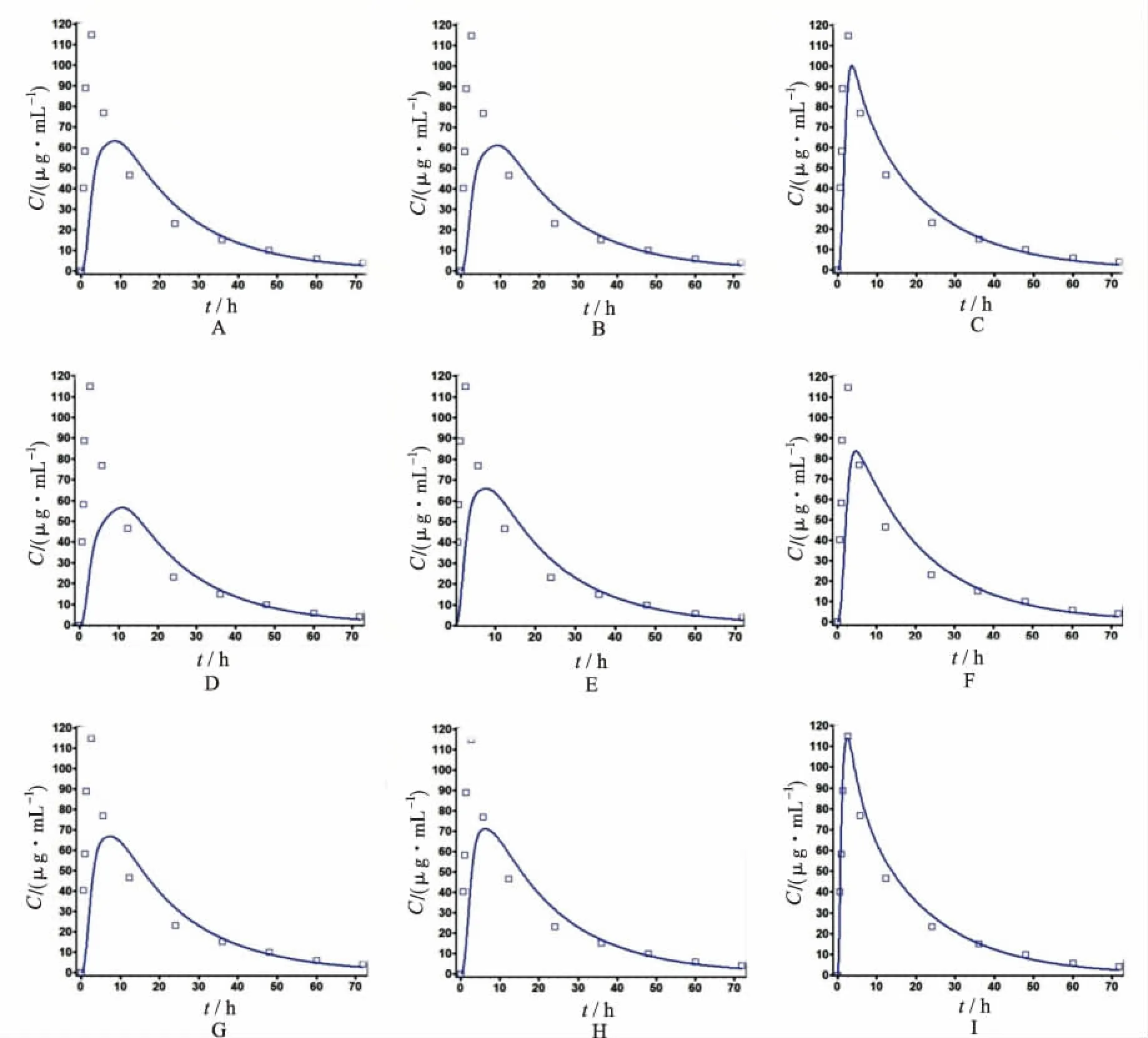
A.A企业样品;B.B企业样品;C.C企业样品;D.D企业样品;E.E企业样品;F.F企业样品;G.G企业样品;H.H企业样品;I.参比制剂
图4 参比制剂与8种国产萘普生片PK曲线模拟(曲线)与实测结果
A.sample A;B.sample B;C.sample C;D.sample D;E.sample E;F.sample F;G.sample G;H.sample H;I.reference
Fig.4SimulativePKmodel(line)andclinicaldete(squares)ofreferencelisteddruganddomesticnaproxentabletsfromeightcompanies
表5 参比制剂与8种仿制制剂体内PK参数模拟及拟合度比较
Tab.5ComparisonofinvivoparametersimulationandR-squaredamonggenericdrugsfromeightpharmaceuticalcompaniesandreferencelisteddrug
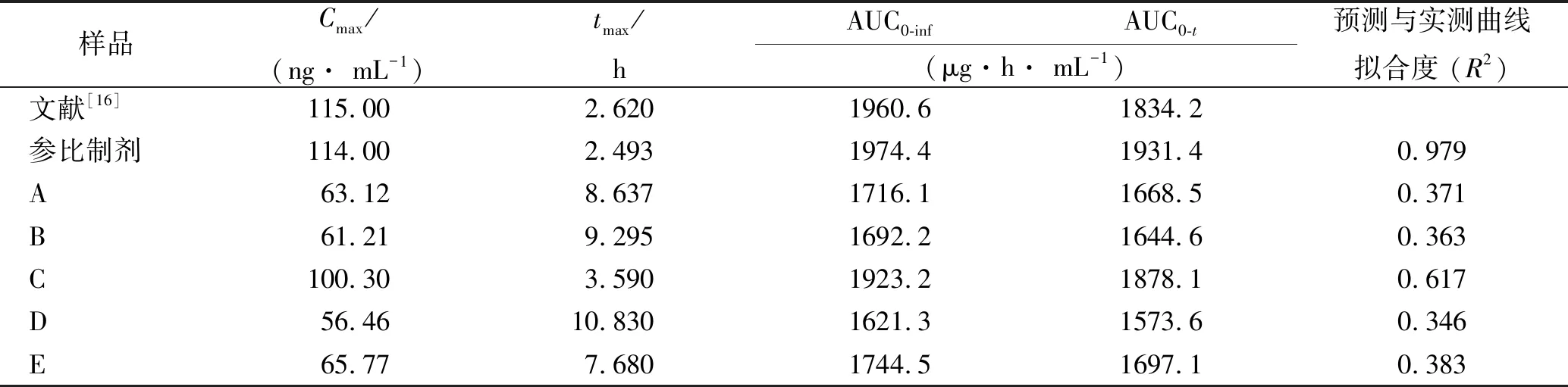
样品Cmax/(ng· mL-1)tmax/hAUC0-infAUC0-t(μg·h· mL-1)预测与实测曲线拟合度 (R2)文献[16]115.002.6201960.61834.2参比制剂114.002.4931974.41931.40.979A63.128.6371716.11668.50.371B61.219.2951692.21644.60.363C100.303.5901923.21878.10.617D56.4610.8301621.31573.60.346E65.777.6801744.51697.10.383
续表5 参比制剂与8家仿制制剂体内PK参数模拟及拟合度比较
Tab.5ComparisonofinvivoparametersimulationandR-squaredamonggenericdrugsfromeightpharmaceuticalcompaniesandreferencelisteddrug

样品Cmax/(ng· mL-1)tmax/hAUC0-infAUC0-t(μg·h· mL-1)预测与实测曲线拟合度 (R2)F83.714.7081856.81810.50.473G66.707.3801753.21705.80.387H71.136.1441787.71740.60.407

