KDM4A调控肝癌细胞增殖机制*
孙黎,戴宇翃,邹曼,邱红
(华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030)
组蛋白赖氨酸去甲基化酶KDM4家族包括KDM4A-D,在调节染色质结构、基因转录及细胞分化中起重要作用。其中对KDM4A/JMJD2A的研究最为深入。目前已知KDM4A的催化酶作用包括H3K9、H3K36、H1.4K26位点的去甲基化[1]。研究发现,KDM4A除催化酶功能之外,还可以与多种转录因子及受体结合并影响细胞增殖,而这种功能可能并不依赖于催化酶活性[2]。研究显示,KDM4A表达水平与肝癌预后密切相关,肿瘤组织高表达KDM4A的患者较低表达组生存率明显下降。因此,本研究拟分析KDM4A基因表达对肝癌细胞增殖的影响及其作用机制,以期为肝癌的治疗提供新靶点。
1 材料与方法
1.1细胞系和材料 Hep3B细胞、293T细胞由华中科技大学同济医学院附属同济医院分子医学中心传代培养。慢病毒包装质粒和Myr-AKT质粒由美国Wake Forest大学Hui-Kuan Lin教授惠赠,KDM4A shRNA序列慢病毒载体购自Sigma公司(批号:TRCN0000013496,TRCN0000013497)。抗体均购自Santa Cruz公司,包括:-Actin抗体(sc-47778),KDM4A抗体(sc-81302), AKT抗体(sc-5298),P-Akt T308抗体(sc-135650),GSK-3b抗体(sc-377213),P- GSK-3b ser9抗体(sc-11757),HA抗体(sc-7392)。
1.2慢病毒的包装 常规培养293T细胞,转染包装质粒、衣壳质粒、表达质粒三质粒系统。转染后48~72 h收取含病毒的上清液,经孔径0.45 μm过滤器过滤备用。
1.3细胞的感染 常规培养Hep3B细胞,感染上述制备的慢病毒。添加感染增强剂Polybrene,保证终浓度为 8 μg·mL-1。病毒感染12 h后,观察细胞状态。病毒感染细胞 72 h 后,荧光显微镜下观察细胞,评估慢病毒感染目的细胞的效率。加入2 μg·mL-1Puromycin筛选。
1.4平板克隆形成实验 取对数生长期各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,将细胞悬浮在10%胎牛血清DMEM培养液备用。稀释细胞悬液,以1×103细胞接种含10 mL预温培养液的6孔板中,轻摇动,使细胞分散均匀。置于37 ℃5%二氧化碳(CO2)培养箱培养2周。培养皿内出现肉眼可见克隆时,终止培养。弃去上清液,磷酸盐缓冲液(PBS)小心浸洗2次。加4%多聚甲醛5 mL固定细胞15 min。去除固定液,加适量GIMSA染色液染15 min,PBS洗去染色液,空气干燥。显微镜计数克隆数,最后计算克隆形成率。克隆形成率(%)=(克隆数/接种细胞数)×100%。
1.5Western Blot分析 收取各组实验细胞,提取总蛋白后Western Blot检测KDM4A、AKT、P-AktT308、GSK-3、P-GSK-3(ser9)等蛋白表达水平,以β-Actin作为内参蛋白,比较各组细胞蛋白表达水平。
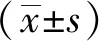
2 结果
2.1肝癌临床数据分析 临床数据证实,KDM4A表达与肝癌患者生存率显著相关。因此,笔者对相关机制进行了研究,以探讨肝癌治疗的新靶点。随访肝癌患者365例,其中女119例(32.6%),男246例(67.4%)。临床分期Ⅰ期170例(46.6%),Ⅱ期84例(23.0%),Ⅲ期83例(22.7%),Ⅳ期4例(1.1%),N/A24例(6.6%)。观察终点死亡病例130例(35.6%)。免疫组化分析KDM4A高表达74例(20.3%),KDM4A低表达291例(79.7%)。5年生存率KDM4A高表达组23%,KDM4A低表达组52%(P=1.39×10-5)。(数据来源于网络公共数据库“人蛋白图谱The human protein atlas”,链接https://www.proteinatlas.org/ENSG00000066135-KDM4A/pathology/tissue/liver+cancer。),见图1。

图1 肿瘤组织高表达KDM4A组与低表达KDM4A组生存率比较(P=1.39×10-5)
Fig.1ComparisonofthesurvivalratebetweenKDM4AoverexpressiongroupandKDM4Alow-expressiongroup(P=1.39×10-5)
2.2KDM4A基因knockdown抑制肝癌细胞Hep3b增殖 见图2,Western Blot验证shKDM4A#1和shKDM4A#2细胞系中KDM4A的表达较对照组明显下降。平板克隆形成实验肉眼可见,与对照组比较,两个shKDM4A细胞系形成的克隆面积小,数目少。以对照组为基础,计算相对克隆形成率。结果显示,shKDM4A#1和shKDM4A#2组克隆形成率显著低于shctr组,P<0.01(t=2.85)和P<0.01(t=3.46)。
2.3KDM4A基因敲除抑制AKT/GSK-3β通路蛋白表达 KDM4A基因敲除后可以观察到肝癌细胞AKT磷酸化水平明显下降。AKT下游信号P-GSK-3 ser蛋白表达水平显著下降。实验以β-Actin为内参(图3)。
2.4shKDM4A细胞中高表达Myr-AKT能够逆转KDM4A对Hep3B细胞增殖的影响 在KDM4A knockdown Hep3b细胞中稳定高表达AKT持续活化的Myr-AKT,可观察到与转染vector相比细胞克隆形成数目明显增多(P<0.01,t=3.30)。而shKDM4A+vec对比ShCtr克隆形成数目明显减少(P<0.01,t=2.67),与前期实验结果一致(图4)。
3 讨论
组蛋白赖氨酸残基的甲基化状态可以调节染色质空间结构,是最为重要的组蛋白转录后修饰形式。在肿瘤的发生过程中存在多种赖氨酸甲基化异常,因此认为肿瘤发病与组蛋白赖氨酸基团甲基化/去甲基化调节失衡有关。KDM4/JMJD2家族主要催化H3K9、H3K36、H1.4K26位点去甲基化[1-2]。因此,近年来越来越多的研究关注KDM4/JMJD2与肿瘤相关性,其中对KDM4A/JMJD2A的研究最为深入。多项研究发现,KDM4A/JMJD2A、KDM4B/JMJD2B及KDM4C/JMJD2C在多种肿瘤中高表达,对肿瘤细胞增殖至关重要,包括乳腺癌、结直肠癌、前列腺癌、肺癌等其他多种肿瘤。KDM4/JMJD2家族也参与调节转移因子,例如KDM4A/JMJD2A可以与雄激素受体、雌激素受体以及P53结合并影响其功能,但该过程多依赖于KDM4A催化功能。也有研究发现KDM4A以独立于催化组蛋白去甲基化功能之外的机制调控细胞增殖和分化,如KDM4A能够抑制53BP1的募集而影响DNA损伤修复。这为进一步探索KDM4A调控肿瘤细胞增殖的机制提供了新的线索[2-3]。目前组蛋白乙酰化酶及DNA甲基转移酶抑制剂已经被美国食品药品管理局(FDA)批准应用于肿瘤治疗。针对组蛋白甲基化酶及去甲基化酶的靶向药物也有望应用于临床治疗[4]。
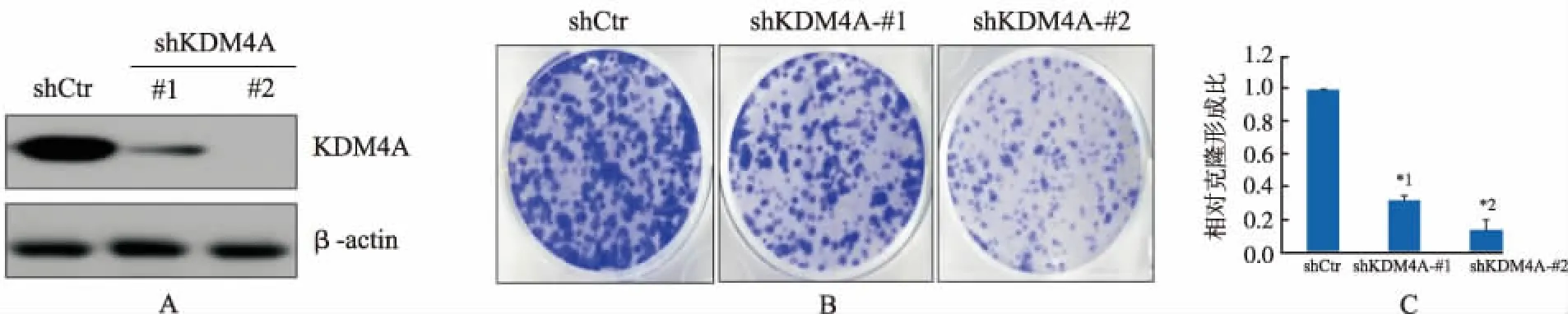
A.免疫印迹实验显示成功建立两个KDM4A knockdown细胞系;B.克隆形成实验:10 cm培养皿分别培养3组细胞,2周后观察克隆形成情况;C.相对克隆形成率分析结果;shKDM4A#1与shCtr比较,*1P<0.01;shKDM4A#2与shCtr比较,*2P<0.01
图2 Hep3b细胞中低表达 KDM4A抑制肝癌细胞克隆形成能力实验结果
A.Western blot confirmed KDM4A expression level in the two KDM4A knockdown cell lines;B.colony formation assay: clone formation condition after the three groups of cells were cultured for 2 weeks in 10 cm dishes;C.analysis results of relative colony formation rate; Compared with shCtr group,*1P<0.01;compared with shCtr group,*2P<0.01
Fig.2InhibitionoflowexpressionofKDM4AinHep3bcellsontheclonalformationofhepatocellularcarcinomacells
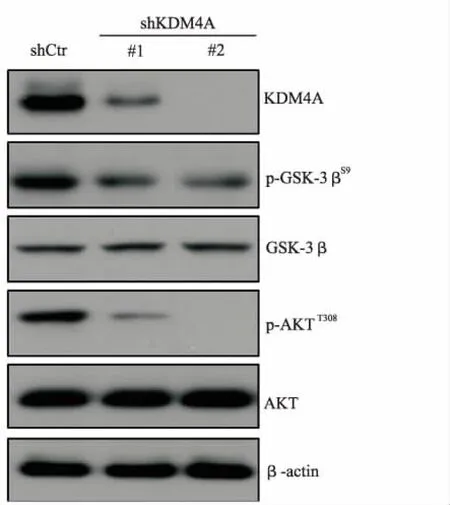
图3 KDM4A敲除抑制AKT激活实验结果
Fig.3InhibitonofKDM4AknockdownonAKTactivation
我国肝癌发病率及死亡率占全球一半以上。肝癌早期诊断困难,大部分患者确诊时已是晚期,总体5年生存率仅10.1%。由于治疗药物个体选择性差且不良反应大,进展期肝癌治疗受到很大限制。2006年索拉菲尼被批准应用于肝癌,但对总体生存期的延长并不理想[5]。肝癌是一种肿瘤异质性明显的疾病。个体之间肿瘤细胞形态、微环境、遗传易感性及信号转导通路均有差异。因此基于个体差异进行分子学分型有利于为患者提供更合适的药物治疗,提高疾病控制率。研究肿瘤细胞信号转导通路的异常可以明确肿瘤的发病机制,同时为个体化治疗提供理论依据。原发性肝癌的信号通路异常包括Wnt/β-catenin、 Ras/Raf/Mek/Erk、PI3k/Akt/mTOR、IGF、EGF、VEGF、PDGF等。针对这些分子异常药物目前在进行临床前研究,部分药物已进入临床试验阶段[6]。
KDM4A并不在所有肿瘤中均一高表达。体外实验也观察到KDM4A高表达或敲除并不影响HeLa细胞增殖[7]。因此KDM4A高表达存在组织特异性。而数据库资料显示KDM4A表达水平与肝癌的预后密切相关,肿瘤组织高表达KDM4A的患者较低表达组生存率明显下降。本研究通过体外实验证实KDM4A敲除肝癌细胞的增殖较对照组明显下降。这提示在肝癌治疗中KDM4A有望成为有效的治疗靶点。同时笔者也发现KDM4A通过激活AKT来调控细胞增殖,而该作用并不依赖于其去甲基化酶的活性。通过本研究,明确了KDM4A /AKT信号通路在肝癌发生发展过程中的重要作用,这为肝癌的分子靶向治疗提供了新的线索。

A.免疫印迹实验验证,shKDM4A细胞中成功高表达磷酸化AKT;B.克隆形成实验:10 cm培养皿培养细胞2周后观察的克隆形成情况,3组细胞分别为ShCtr对照、shKDM4A+Vec、shKDM4A+Myr-Akt;C.相对克隆形成率分析结果;与shCtr比较,*1P<0.01;与Vec比较,*2P<0.01
图4 KDM4A 低表达细胞中高表达Myr-AKT逆转KDM4A对Hep3B细胞增殖的影响
A.Western blot confirmed the overexpression level of p-AKT in ShKDM4A cells;B.colony formation assay: clone formation after the three groups of cells including ShCtr,shKDM4A+vec and shKDM4A+Myr-AKT were cultured for 2 weeks in 10 cm dishes;C.analysis results of relative colony formation rate;Compared with shCtr,*1P<0.01;compared with Vec,*2P<0.01
Fig.4ReversionoftheeffectofKDM4AoncellproliferationofHep3BcellswithKDM4Alow-expressionbyMyr-AKT

